波澜不惊,Nat Commun:乙酰辅酶A维持细胞内代谢稳态的新机制 |
您所在的位置:网站首页 › 如何提取细胞中的内质网 › 波澜不惊,Nat Commun:乙酰辅酶A维持细胞内代谢稳态的新机制 |
波澜不惊,Nat Commun:乙酰辅酶A维持细胞内代谢稳态的新机制
|
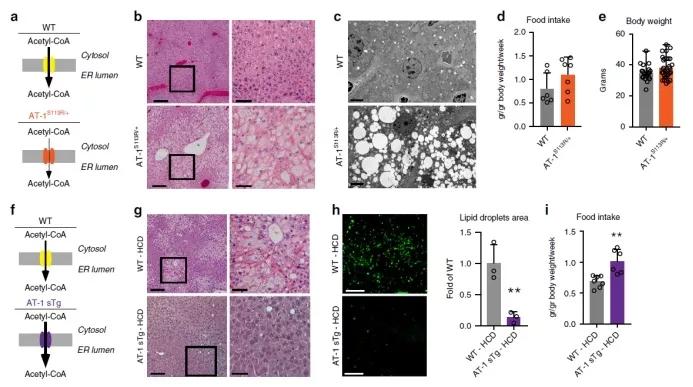
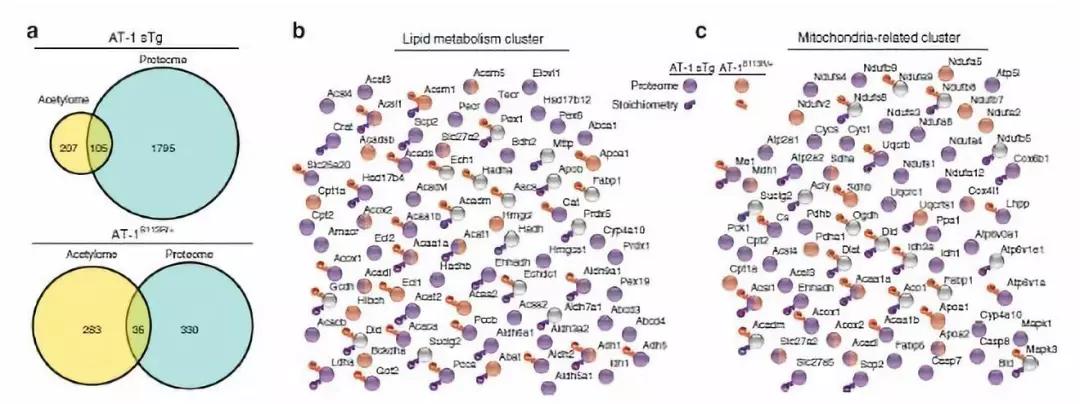
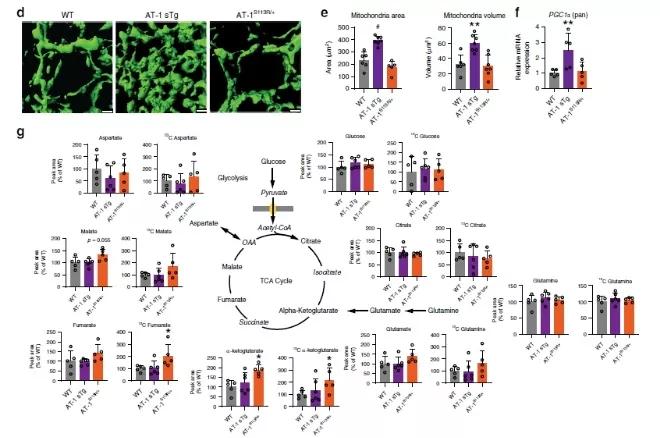
为了研究AT-1活性对细胞内乙酰辅酶A稳态的影响,研究者首先建立了两种AT-1失调的模型:AT-1单倍体突变小鼠模型(AT-1S113R/+)和AT-1过表达模型(AT-1 sTg),这些模型都表现出了包括脂质代谢的重编程和线粒体生物能量方面的代谢适应。跟正常组相比,AT-1S113R/+小鼠从细胞质到ER腔的乙酰-CoA转运减少约50%,组织学评估显示小鼠肝脏脂肪变性倾向性增加。 过表达AT-1的AT-1 sTg小鼠增加了乙酰辅酶A从胞质溶胶到ER腔的转运。研究者猜测,AT-1 sTg小鼠在用高糖高脂饮食下具有抗性。为了验证这个猜想,研究者在四周之内分别给对照小鼠和AT-1 sTg小鼠70%碳水化合物以及5.2%脂肪。正如预期的那样,高糖高脂饮食的对照组小鼠在肝脏切片中显示弥漫性脂肪变性和脂质积聚。 Figure 1 AT-1S113R/+表现出自发性脂肪变性,而AT-1 sTg对饮食诱导的脂肪变性具有抗性 为了剖析代谢适应的潜在机制,同时评估AT-1和乙酰辅酶A通过赖氨酸乙酰化调节蛋白质功能的能力,研究者使用蛋白质组学定量技术与乙酰化修饰组学技术,研究了AT-1 sTg和AT-1S113R/+小鼠肝脏内可能的蛋白质组与乙酰化修饰组变化。结果表明,在AT-1 sTg和AT-1S113R/+小鼠肝脏中,分别有2056和373个蛋白表达水平发生了显著变化,分别有105个蛋白和35个乙酰化位点发生了显著改变。 Figure 2. AT-1 sTg和AT-1S113R/+小鼠肝脏的组学分析 在两种AT-1失调模型中,61种蛋白质受到影响。 其中,22个蛋白与分泌途径相关,8个与线粒体相关,7个与细胞核相关,24个与细胞质相关。另外,研究者分别在AT-1 sTg和AT-1S113R/+小鼠肝脏中鉴定了3341和3003个赖氨酸位点。与WT相比,AT-1 sTg中有375个显著变化,而AT-1S113R/+中有415个显著变化。AT-1模型的比较显示,在显著改变的乙酰化位点中有12%(88个位点)重叠,在修饰蛋白中有21%(119个蛋白质)重叠。在富集途径中有57%重叠,包括脂质代谢,氨基酸代谢,线粒体和分泌途径以及蛋白质稳态。 通过结构照明显微镜(SIM)观察原代培养的肝细胞的线粒体,结果表明AT-1 sTg小鼠中线粒体呈显著扩散,线粒体区域和体积都显著增加。 接下来,研究者使用C13谷氨酰胺同位素示踪来测量原代肝细胞中的代谢物,并确定在组学数据中鉴定到的柠檬酸循环中蛋白质和修饰位点功能性的意义。结果显示,C13标记的α-酮戊二酸和延胡索酸盐水平增加,α-酮戊二酸总水平增加,并且AT-1S113R/+小鼠中苹果酸盐水平升高趋势。而在AT-1 sTg动物中未观察到TCA /柠檬酸代谢物的显著差异。 Figure 2. AT-1 sTg和AT-1S113R/+小鼠表现出显著的代谢和线粒体适应性 总的来说,研究者运用蛋白质组学、乙酰化修饰组学技术研究了失调的AT-1活性对细胞内乙酰辅酶A稳态的影响。研究发现,由低活性或过分活跃的AT-1引起的细胞内乙酰辅酶A通量的变化会对表型产生重要影响。AT-1是细胞内通讯网络的重要组成部分,可促进不同细胞区室和细胞器之间的功能性交流,从而维持乙酰辅酶A稳态。 参考文献 Dieterich IA, et al. (2019), Acetyl-CoA flux regulates the proteome and acetyl-proteome to maintain intracellular metabolic crosstalk. Nat Commun. 本文景杰学术团队编辑报道,欢迎转发到朋友圈。如有转载、投稿、等其他合作需求,请添加微信ptm-market咨询。返回搜狐,查看更多 |
【本文地址】