阿尔茨海默病中的人脑连接组 |
您所在的位置:网站首页 › 大脑皮层表面积增大皮层变薄 › 阿尔茨海默病中的人脑连接组 |
阿尔茨海默病中的人脑连接组
|
这篇综述发表于nature reviews neurology,由Meichen Yu, Olaf Sporns & Andrew J. Saykin撰写,非常详细总结了阿尔茨海默病中与Aβ蛋白、tau蛋白以及基因组相关的人脑连接组的研究。 Abstract阿尔茨海默病(AD)的病理损害了结构和功能性大脑网络,导致认知障碍。最近的连接组学研究结果现在已经将AD中结构和功能网络组织的变化与淀粉样β蛋白和tau蛋白积累和扩散的模式联系起来,为该疾病的神经生物学机制提供了见解。此外,基因相关连接组变化的检测可能有助于AD的早期诊断,并促进开发在疾病谱系早期阶段有效的个性化治疗策略。在本文中,我们回顾了不同亚型和阶段的AD中连接组变化与淀粉样β蛋白和tau蛋白病理以及分子遗传学之间关联性的研究。我们还强调了连接组衍生计算模型对复制实证发现以及跟踪和预测生物标志物指示的AD病理生理学进展的实用性。 Key Points淀粉样β蛋白(Aβ)病理与阿尔茨海默病(AD)临床前期默认模式网络(DMN)中枢节点连接性降低有关,随着疾病的进展,这种关联扩展到其他大脑网络。选择性枢节点脆弱性可能解释了为什么在临床前AD中,Aβ在DMN的内侧枢节点中优先积累,而tau在内侧颞叶枢节点中积累。tau病理沿着结构连接从内侧颞叶枢节点扩散到其他大脑区域,支持了致病扩散假说。Aβ病理在晚发型AD、常染色体显性AD和早发型AD中都有驱动DMN低连通性的共同作用;然而,在不同的AD亚型中,Aβ病理与DMN低连通性之间的关联受不同遗传变异调控。空间基因表达谱可能有助于解释Aβ和tau积累模式与结构和功能连接组变化模式之间的关系。计算建模研究将对理解连接组在与Aβ、tau和其他AD致病特征进展相关方面的作用起到重要作用。 -Introduction阿尔茨海默病(AD)是一种常见且具有残疾性的神经退行性疾病,其特征为进行性神经元和突触丧失,伴随着神经元连接性下降。这些病理特征破坏了结构和功能性脑网络,导致认知和行为严重受损。临床上,早期AD通常表现为由颞叶内侧神经退行性引起的记忆障碍(Clinical diagnosis of Alzheimer's disease: recommendations of the International Working Group - ScienceDirect)。随着疾病的进展,这种神经退行性逐渐扩散到颞叶和顶叶皮层,最终影响大部分皮质区域。AD相关的障碍也观察到于其他认知领域,如语言、视觉空间能力、注意和执行功能。例如,患者可能变得难以记住人或物的名称、在开车时导航、或做出重要的财务或其他决定。在生物学上,AD的定义是由两个主要的神经病理标志物组成:细胞外含有Aβ淀粉样蛋白的斑块和细胞内含有tau的神经原纤维缠结。越来越多的证据表明,Aβ最初在默认模式网络(DMN)(The brain’s default network: updated anatomy, physiology and evolving insights | Nature Reviews Neuroscience)的内侧额叶皮层和内侧顶叶皮层中积累(Earliest accumulation of β-amyloid occurs within the default-mode network and concurrently affects brain connectivity | Nature Communications This article provides compelling evidence that Aβ accumulation preferentially starts in the DMN),而tau最初在颞叶内侧记忆系统中沉积(A pathophysiological framework of hippocampal dysfunction in ageing and disease | Nature Reviews Neuroscience),从内嗅皮层扩散到海马和海马旁皮层,然后到其他脑区。 可以使用脑脊液(CSF)检测或PET技术在人体内体外检测Aβ和tau。此外,现在已经开发了有前途的基于血液的AD病理生理学检测方法,这些方法不仅侵入性较小,成本也较低于CSF和PET的替代方法。神经退行性或神经元损伤的生物标志物可以使用多种技术进行检测,包括PET(葡萄糖代谢)、MRI(结构、功能和扩散)、EEG和脑磁图(MEG)(Update on hypothetical model of Alzheimer’s disease biomarkers - PMC (nih.gov))。值得注意的是,AD生物标志物的变化遵循一系列阶段,Aβ和tau在没有认知障碍的人群中开始积累于AD症状发作的数十年之前(AD前期)。临床前期AD的定义是出现初始轻度认知症状,通常伴随着生物标志物的变化,包括指示神经退行性的标志物。最后,AD痴呆的定义是认知障碍与执行日常生活的工具性活动能力下降的存在。A/T(N)框架是一个实用的研究分析方案(Prevalence of Biologically vs Clinically Defined Alzheimer Spectrum Entities Using the National Institute on Aging–Alzheimer’s Association Research Framework | Dementia and Cognitive Impairment | JAMA Neurology | JAMA Network),基于特定的生物标志物,提供了AD机制性脑网络研究的明确定义的生物学基础。 AD可以基于基因变异、起病年龄和临床表型分类为家族性(或常染色体显性遗传)AD和散发性AD(Genetic variants in Alzheimer disease — molecular and brain network approaches | Nature Reviews Neurology)。在散发性AD患者中,晚发AD(起病年龄≥65岁)是典型的,但一小部分人有早发AD(起病年龄a | 一个示例网络模型由三个社群(点状圆圈)和三个连接器中心枢纽(红色)组成。这三个相互连接的中心枢纽构成了一个富俱乐部。三条蓝色线显示了两个蓝色节点之间的最短路径。b | 富俱乐部区域和连接构成了一个人类结构连接组的平均群体。c | 一个人类功能连接组的平均群体例子包括四个社群,包括默认模式网络、额顶叶网络、扣带顶网络和视觉网络。The connectome in AD 结构和功能性网络研究都表明,与无认知障碍的老年人相比,阿尔茨海默病患者的大脑网络特征是小世界特征的丧失(趋向于随机和/或规则网络拓扑)、模块结构受到干扰以及核心节点区域的变化——特别是位于DMN和内侧颞叶的核心节点。值得注意的是,楔前叶/PCC(属于DMN)和内嗅皮质(位于内侧颞叶)分别是Aβ和tau蛋白的初始沉积部位(图2)。许多关于无认知障碍个体以及阿尔茨海默病患者人类连接组研究的总结都可用。在这里,我们特别讨论提供有关Aβ病理学、tau病理学和遗传变异对不同亚型和阶段AD中功能和结构网络组织影响的研究。 Fig. 2: Patterns of tau accumulation in AD.  5 名年轻健康成年人、17 名淀粉样蛋白-β (Aβ) 阴性老年人、16 名 Aβ 阳性老年人和 15 名阿尔茨海默病 (AD) 患者的 Tau 积累模式。通过 18F-AV-1451 PET 成像测量 Tau 积累; Aβ 状态是根据Pittsburgh compound B PET signal定义的。在年轻健康成人的皮层区域未观察到 tau 积聚。 Aβ 阴性的老年人在一些内侧颞叶区域(例如内嗅皮层和海马旁回)以及一些下方和外侧颞叶区域有 tau 积聚。 Aβ 阳性的老年人在与 Aβ 阴性的个体相同的区域有 tau 积聚,但程度更高。此外,在 Aβ 阳性的个体中,在楔前叶等顶叶区域观察到 tau 蛋白积累。在患有 AD 的个体中,颞叶和顶叶区域的 tau 蛋白积累显着高于其他老年人组;在患有 AD 的个体的更广泛的顶叶区域以及额叶和视觉皮质中也观察到 tau 积聚。 SUVR,标准化摄取值比率。经 ref.78, Elsevier 许可转载。Aβ-associated changesStructural connectome 5 名年轻健康成年人、17 名淀粉样蛋白-β (Aβ) 阴性老年人、16 名 Aβ 阳性老年人和 15 名阿尔茨海默病 (AD) 患者的 Tau 积累模式。通过 18F-AV-1451 PET 成像测量 Tau 积累; Aβ 状态是根据Pittsburgh compound B PET signal定义的。在年轻健康成人的皮层区域未观察到 tau 积聚。 Aβ 阴性的老年人在一些内侧颞叶区域(例如内嗅皮层和海马旁回)以及一些下方和外侧颞叶区域有 tau 积聚。 Aβ 阳性的老年人在与 Aβ 阴性的个体相同的区域有 tau 积聚,但程度更高。此外,在 Aβ 阳性的个体中,在楔前叶等顶叶区域观察到 tau 蛋白积累。在患有 AD 的个体中,颞叶和顶叶区域的 tau 蛋白积累显着高于其他老年人组;在患有 AD 的个体的更广泛的顶叶区域以及额叶和视觉皮质中也观察到 tau 积聚。 SUVR,标准化摄取值比率。经 ref.78, Elsevier 许可转载。Aβ-associated changesStructural connectome成像研究的结果显示,Aβ病理对不同结构连接组特征的影响具有明显的阶段特异性效应。从结构性MRI数据构建的结构协方差网络(包括灰质网络和皮层厚度网络)的拓扑结构显示,个体在主观认知衰退(SCD)或轻度认知障碍(MCI)时,与Aβ病理总体程度相关。特别是,几项灰质网络研究显示,在Aβ阳性的SCD个体中,通过CSF Aβ42和PET成像测量的Aβ病理严重程度与灰质体积的全局或局部不相关,但与灰质网络小世界性的降低相关,尤其是在DMN中央颞叶和中心枢纽区域(前扣带回区和眶额皮质)。这些研究涉及每个参与者的灰质网络构建(单个参与者连接组),而不是常见的在群体水平上构建灰质网络的做法。其他单个参与者灰质网络研究的结果表明,Aβ阳性个体的灰质网络拓扑结构与从SCD到MCI或AD痴呆的临床进展风险相关,可以预测未来海马萎缩和认知障碍。值得注意的是,这种关联没有在Aβ阴性的年龄匹配个体中观察到,表明灰质网络拓扑结构和海马萎缩之间的关系特异于AD临床前阶段的Aβ病理个体。 和灰质网络相一致,对于没有认知障碍的Aβ阳性个体的皮层厚度网络显示没有区域性的皮层萎缩,但是全局效率、模块化和中心性比没有认知障碍的Aβ阴性个体要低。这些结构网络的变化早于可检测到的皮层变薄,表明来自结构协方差网络的指标与Aβ病理标志物有关。 报告中关于Aβ病理和DTI-derived结构网络指标之间的关系在研究中存在不一致性。其中一项研究指出,局部结构连接性的加权结构联通网络度量(包括节点强度、加权局部效率和加权聚类系数)随着疾病阶段的发展(没有认知障碍 > MCI > AD)而降低,特别是在双侧额叶和颞叶区域(The Alzheimer Structural Connectome: Changes in Cortical Network Topology with Increased Amyloid Plaque Burden | Radiology (rsna.org))。这些加权结构联通网络指标与皮质Aβ负荷呈负相关,与大脑区域无关。另一项DTI研究探讨了没有痴呆的个体的皮质Aβ负荷和死后结构连接网络拓扑之间的关系。在这项研究中,Aβ负荷与全局性(全局效率、度和聚类系数)和局部性(后扣带区节点度和扣带前部聚类系数)连接性度量呈负相关,但与高度连接的后扣带区局部效率呈正相关。关于局部效率的不一致性可能是由于使用了不同的图度量(应用于加权或非加权网络),DTI数据采集(在体或原位)以及两项研究之间处理差异导致的。 以上所述的DTI研究提供了证据,表明Aβ病理随着AD连续过程(AD continuum)的进展,导致网络拓扑结构向更规则的方向转变,并出现局部结构连接的扩散性丧失。值得注意的是,在一项扩散MRI研究中,比较了具有MCI和AD的个体与没有认知障碍的老年人,发现DMN的 posteromedial hubs 的结构连接降低,然而,白质纤维束的退化也出现在那些没有Aβ病理的个体中,这表明神经退行性变化不是特别与Aβ病理相关(Fibre-specific white matter reductions in Alzheimer’s disease and mild cognitive impairment | Brain | Oxford Academic (oup.com))。白质完整性的DTI衍生测量,例如:FA和MD,在预临床AD中对于预测认知下降是有用的标记物,但证据表明,Aβ病理在AD早期阶段并不影响白质完整性。这些发现的可能解释是:全局和局部结构脑连接组学测量比白质完整性测量对Aβ相关变化更敏感。进一步研究Aβ病理与DTI衍生结构性脑连接组学异常之间的可能联系,可以提供更多有关Aβ病理对网络级神经退行性变化及其与认知功能障碍之间关系的影响的信息。值得注意的是,2018年发表的一项研究报告称,与具有混合Aβ阳性的认知正常个体相比(27%为Aβ阳性),AD患者 along the uncinate fasciculus, superior longitudinal fasciculus and cingulum bundle 的白质连接的完整性发生了改变;然而,在两组之间没有观察到结构性脑连接组学组织上的显著差异(Preserved Structural Network Organization Mediates Pathology Spread in Alzheimer’s Disease Spectrum Despite Loss of White Matter Tract Integrity - IOS Press)。这种不一致可能是网络阈值问题(参见框3)的结果。此外,应该谨慎解释DTI衍生的结构性脑连接组学研究的结果,因为结构连接性测量的解剖学准确性以及道路图估计的可靠性仍然是方法学调查和改进的课题。 Box 3 Graph theoretical analysis: methodological considerations为了描述网络拓扑,通常会对结构或功能连接矩阵应用阈值,以消除由于低相关性(噪声)而产生的虚假链接,并生成稀疏连接的邻接矩阵。由于不同的阈值将从同一数据生成具有不同数量的链接(或链接密度)的网络,因此通常使用一系列阈值来探索网络的拓扑特性。多项研究表明,大多数网络特性依赖于链接密度;因此,任意选择阈值或阈值范围会导致估计的网络拓扑存在偏差。有研究表明,对连接矩阵进行加权网络分析而不应用阈值可以解决链接密度问题,但由于患者和对照组之间整体连接强度的差异,网络比较仍然存在偏差。使用归一化网络指标可以减少但不能完全消除无权重和有权重网络分析中的偏差。提出了几种新的网络构建方法和统计方法,但到目前为止,没有一种方法完全解决了上述方法问题,这可能会影响患者和对照组之间网络拓扑的可靠和可重复比较(The minimum spanning tree: An unbiased method for brain network analysis - ScienceDirect;Consistency-based thresholding of the human connectome - ScienceDirect;Overcoming the effects of false positives and threshold bias in graph theoretical analyses of neuroimaging data - ScienceDirect;Thresholding functional connectomes by means of mixture modeling - ScienceDirect)。因此,应谨慎解释这些组之间的差异的图论分析结果。 Functional connectome功能性连接组研究通常涉及到对静息大脑活动的fMRI或电磁记录。这些研究的结果表明,在患有 AD 的个体中,Aβ 积累和异常的大脑网络连接在空间上共定位于高度连接的枢纽区域。在早期AD,包括临床前和亚临床期AD,使用不同的神经影像技术,如MEG和fMRI,已经发现功能性脑网络连接的异常程度与Aβ病理(CSF和PET),而不是tau病理(CSF)有关(Selective impairment of hippocampus and posterior hub areas in Alzheimer’s disease: an MEG-based multiplex network study | Brain | Oxford Academic (oup.com);Evaluating resting-state BOLD variability in relation to biomarkers of preclinical Alzheimer's disease - ScienceDirect)。这些发现表明,与tau病理不同,Aβ病理在AD早期驱动了功能性连接组的变化。事实上,一项重要的基于fMRI的连接组研究发现,在患有AD的个体中,Aβ倾向于在DMN中的皮层枢纽积累,包括PCC / precuneus,外侧顶叶皮层,外侧颞叶皮层以及前额叶的内侧和外侧皮质(Cortical Hubs Revealed by Intrinsic Functional Connectivity: Mapping, Assessment of Stability, and Relation to Alzheimer's Disease | Journal of Neuroscience (jneurosci.org))。此外,观察到Aβ沉积和异常枢纽连接的惊人共定位,伴随着Aβ沉积水平和度中心性的强正相关。随后的几项研究发现,Aβ病理与减少DMN连接(特别是DMN的后内侧成分 posteromedial )的关联也可在临床前AD、亚临床期AD和早发性AD中确定。证据还表明,DMN连接的降低在亚临床期AD中介导了Aβ病理和认知障碍之间的关联。 一项纵向研究的结果显示,在CSF Aβ42和Aβ-PET水平正常的个体中,随着CSF Aβ42水平转变为异常,Aβ最初在DMN和额顶叶网络的部分区域积累;在这些早期阶段,感觉运动和视觉网络的Aβ积累最少(参见图3)。值得注意的是,当CSF Aβ42水平变为异常时,个体在DMN内部和DMN与额顶叶网络之间出现了连接偏低的情况,但没有出现脑萎缩或葡萄糖代谢减低。这一发现表明,在AD的临床前期,Aβ相关的网络连接减少优先于其他神经退行性生物标志物,如脑萎缩和葡萄糖代谢减低(Earliest accumulation of β-amyloid occurs within the default-mode network and concurrently affects brain connectivity | Nature Communications)。在另一项fMRI研究中,DMN连接性在AD连续不同阶段进行了研究:没有认知障碍、SCD、早期MCI、晚期MCI和AD。结果支持这一假设,即AD相关的网络失效在DMN的后部组成部分中开始,在PET成像能够识别淀粉样斑块之前,并通过网络中心向其他脑区扩散(Cascading network failure across the Alzheimer’s disease spectrum | Brain | Oxford Academic (oup.com))。 Fig. 3: Early Aβ accumulation in resting-state functional brain networks.  早期淀粉样β蛋白(Aβ)积累的大脑区域(红色)和包含六个关键静息态功能性大脑网络的区域(蓝色)被叠加在大脑表面的3D渲染上。在阿尔茨海默病的临床前期,Aβ主要积累在默认模式网络的区域,以及额顶叶网络、腹侧和背侧注意力网络、额颞叶网络的较小程度。感觉运动网络和视觉网络在临床前期显示出最少的Aβ积累。转载自ref.4,CC BY 4.0(知识共享组织 早期淀粉样β蛋白(Aβ)积累的大脑区域(红色)和包含六个关键静息态功能性大脑网络的区域(蓝色)被叠加在大脑表面的3D渲染上。在阿尔茨海默病的临床前期,Aβ主要积累在默认模式网络的区域,以及额顶叶网络、腹侧和背侧注意力网络、额颞叶网络的较小程度。感觉运动网络和视觉网络在临床前期显示出最少的Aβ积累。转载自ref.4,CC BY 4.0(知识共享组织多项研究结果表明,Aβ相关的功能网络连接异常不仅限于 DMN,而是涉及到早期和晚期 AD 的其他脑网络。在一项 MEG 研究中,与健康对照组相比,年轻(平均年龄 60.6±5.4 岁)的 AD 患者在左海马、DMN 后部和枕叶区等多个中枢区域的连接出现异常。在 AD 患者中,这些中枢区域连接的异常程度与认知损伤的严重程度和 Aβ 病理(CSF Aβ42)呈正相关。多项 fMRI 研究已经发现 Aβ 相关的连接变化出现在多个静息态网络中。例如,一项 fMRI 研究报道称,没有认知障碍的个体中,Aβ 病理区域严重程度与 DMN、额顶叶网络和颞叶皮层之间的功能连接随时间的变化呈负相关。一项密集采样(3 年内 5 次观测)的 fMRI 研究(Longitudinal degradation of the default/salience network axis in symptomatic individuals with elevated amyloid burden. - ScienceDirect)发现,在 AD 前期个体中,Aβ 病理对 DMN 和显著性网络的连接随时间的变化以及认知表现和海马体体积的变化有类似的影响(效应大小相当)。然而,网络连接的变化与认知表现和海马体体积的变化是独立的,这表明 DMN 和显著性网络的功能网络连接可以用来跟踪 AD 进展的某些方面,而这些方面无法通过认知和结构性测量捕捉到。 人类颞叶内侧区包括海马、海马旁皮层、内嗅皮层和鼻周皮层,对支持情景记忆发挥着重要作用,而这种记忆在患有AD的个体中通常会受到干扰。因此,有假设认为AD病理(Aβ和/或tau)导致颞叶内侧区与DMN前后部分之间的功能连接减少,从而导致早期AD的认知功能障碍。与此理论一致,一项纵向多模态MRI(fMRI和DTI)研究报道了Aβ与颞叶内侧区和DMN之间功能连接的相关变化,包括在对Aβ呈阳性的无认知功能障碍者和对Aβ呈阳性的MCI患者中(Medial temporal lobe connectivity and its associations with cognition in early Alzheimer’s disease | Brain | Oxford Academic (oup.com))。具体而言,在与对Aβ呈阴性的无认知功能障碍者相比较时,对Aβ呈阳性的无认知功能障碍者颞叶内侧区前部与DMN前部之间的功能连接减少,对Aβ呈阳性的MCI患者海马与DMN内侧后部之间的连接减少。值得注意的是,对Aβ呈阳性的无认知功能障碍者颞叶内侧区和DMN前部之间的功能连接的功能低连接度程度与tau病理(通过CSF磷酸化tau(p-tau)测量)和基线记忆障碍相关;低连接度程度与记忆障碍之间的关系在基线和8年的随访期间均存在。对Aβ呈阳性的MCI患者颞叶内侧区和DMN后部之间的功能低连接度程度与内嗅皮层萎缩和前海马旁回纤维束白质完整性降低相关。这些发现不仅支持了功能网络异常和/或早期AD的认知功能障碍由Aβ病理驱动并先于结构变化出现的理论,而且还暗示了随后在MCI期的结构变化与增加的tau病理相关,Aβ病理促进了疾病的进展。 总之,本节讨论的研究提供了一致的证据,表明Aβ病理优先与早期AD的DMN和颞叶内侧区功能连接减少相关,并且随着疾病的进展,这种关联扩展到其他脑网络。 Tau-associated changesStructural connectome有关 tau 病理在 AD 中的进展的一个假设是,tau 蛋白从 medial temporal lobe 向其他网络枢纽(特别是 posteromedial DMN)扩散(Towards clinical application of tau PET tracers for diagnosing dementia due to Alzheimer's disease - Ossenkoppele - 2021 - Alzheimer's & Dementia - Wiley Online Library)。正在进行的研究试图确定 tau 病理进展的细胞机制,可能包括细胞间的“朊病毒”扩散;但是,目前的神经影像技术无法解决这种细节水平的问题。在一项里程碑式的多模式(Aβ-PET、tau-PET 和结构和扩散 MRI)的纵向成像研究中,研究者在患有 AD 前期的个体中显示出 tau 确实从 medial temporal lobe 中的海马向 posteromedial DMN(特别是 PCC)扩散,通过 hippocampal cingulum bundle (Structural tract alterations predict downstream tau accumulation in amyloid-positive older individuals | Nature Neuroscience This article provides evidence that tau spreads through structural connections facilitated by Aβ pathology)。该研究报告了海马扣带捆弥散性和 PCC 中的 tau 沉积之间的关联,并且这种关联在存在更高水平的 Aβ 沉积的情况下更为强烈,提供了证据表明 Aβ 病理促进 tau 的扩散。此外,海马扣带弥散性在对 Aβ 为阳性且在 PCC 中 tau 沉积高的个体中预测了逐渐加重的记忆功能障碍,提供了证据表明 Aβ 和 tau 病理促进了记忆功能障碍的发生。 在另一项多模式研究中,轻度认知障碍或轻度AD患者的tau沉积水平与结构连接之间的关系基于Aβ状态有所不同。例如,在没有认知障碍的Aβ阴性个体中,内侧颞叶和整个大脑的tau沉积水平与结构连接呈正相关。相反,在Aβ阳性且伴有轻度认知障碍或轻度AD的个体中,tau沉积与内侧颞叶区域、整个大脑以及一些DMN枢纽(包括前扣带皮质、后扣带皮质和楔前叶)的结构连接呈负相关。这些结果表明,随着AD的进展,tau和结构连接之间的关系会因Aβ依赖性而发生变化。 目前还没有关于tau病理对通过传统的基于MRI的结构性测量,如灰质体积和皮质厚度值来估计的结构性连接组组织的影响的数据。然而,相当多的研究已经检测到在AD的不同阶段,tau负担升高和皮质萎缩以及灰质病变之间的前瞻性和回顾性关系。由于结构协方差网络指标在捕捉Aβ病理对AD进展的影响方面显示出比常规结构测量更高的敏感性(见Aβ相关的结构连接组变化部分),未来的研究将需要探究tau在塑造AD发生的结构协方差网络组织的变化中是否具有额外或独特的作用。 Functional connectome根据假设,Tau病理学对人类功能性连接组有特定的影响,这取决于并且/或独立于Aβ病理学。早期研究调查了功能性网络连接性与Tau病理学(脑脊液中p-tau水平)之间的关系。例如,在MEG和fMRI研究中,临床前AD(无认知障碍和/或MCI)中CSF p-tau水平较高,CSF Aβ42水平较低,与DMN的前部和后部(PCC)枢纽以及内侧颞叶区域的功能连接性降低独立相关。 随着体内tau-PET探针的开发,最近的研究集中于检查tau病理与功能性脑连通组织的空间关联。迄今为止,大多数研究使用了Aβ阳性个体或混合Aβ状态(Aβ阳性和Aβ阴性)的个体群体的数据。一项静息态fMRI研究提供了证据,表明在无认知障碍的Aβ阳性个体中,较高的颞下皮质tau沉积与DMN和显著性网络的功能连接性降低相关,而这些区域是Aβ优先沉积的区域(Phases of Hyperconnectivity and Hypoconnectivity in the Default Mode and Salience Networks Track with Amyloid and Tau in Clinically Normal Individuals | Journal of Neuroscience (jneurosci.org))。这个结果表明,在早期AD阶段,tau与功能连接性之间的关联可能受到Aβ病理的调节。此外,一项最新的基于任务的fMRI研究在混合Aβ状态下的无认知障碍个体中指出,颞叶内存系统的异常tau沉积与medial temporal lobe和DMN的posteromedial hubs的神经激活增加相关(Alzheimer’s pathology targets distinct memory networks in the ageing brain | Brain | Oxford Academic (oup.com) This study reports evidence that tau and Aβ pathologies target distinctive functional brain networks in the ageing brain)。值得注意的是,虽然tau和Aβ的初始沉积在大脑中的位置不同,但在AD的临床前阶段,两者的沉积都与认知表现呈负相关。实际上,一项在无认知障碍的老年人和年轻人中的fMRI研究表明,tau病理在健康老化中断开了海马与内侧颞叶的其他组成部分之间的联系,导致记忆表现更差(Tau deposition is associated with functional isolation of the hippocampus in aging | Nature Communications)。 在早期认知障碍进展为AD痴呆的过程中,Aβ病理学已经扩散到整个大脑皮层。因此,如果Aβ病理学促进了Aβ阳性AD痴呆中tau病理学与功能连接的关联,那么在这个疾病阶段,tau病理学应该会影响多个脑网络和全局网络属性。最近的静息态研究表明,在Aβ阳性AD痴呆中,tau负担与功能连接的关联似乎并不仅限于DMN,而是也影响其他静息态网络。特别是,一项静息态fMRI研究的结果显示,在Aβ阳性AD痴呆中,tau累积的协变性与多个静息态网络内部和/或之间的功能连接呈正相关,包括DMN、前顶叶网络、边缘网络、背/腹侧注意力网络、视觉和感觉运动网络(见图4)(Functional brain architecture is associated with the rate of tau accumulation in Alzheimer’s disease | Nature Communications This study reports the spatial relationships between that tau accumulation and functional brain networks in AD)。该研究还发现,基线时的功能网络连接水平和tau累积水平可以准确预测未来的tau累积,进一步支持tau在AD中通过功能连接扩散的假设(Functional connectivity associated with tau levels in ageing, Alzheimer’s, and small vessel disease | Brain | Oxford Academic (oup.com))。此外,AD患者fMRI研究的结果表明,多个静息态网络的中心区域显示比非中心区域更多的tau累积(Tau burden and the functional connectome in Alzheimer’s disease and progressive supranuclear palsy | Brain | Oxford Academic (oup.com) This study was the first to assess the relationship between tau burden and fMRI-based functional network topology characterized by graph-theoretic measures)。这种中心区域的tau积累与局部连接的减少(通过加权度和局部效率进行量化,可以在不阈值化的加权脑网络中计算度和局部效率)相关,支持tau病理学在AD痴呆中影响网络中枢的假设。 Fig. 4: Association between functional connectivity and covariance in tau-PET change.  a | 两个独立样本(来自阿尔茨海默病神经影像学计划(ADNI)数据集的53名参与者和来自BioFINDER数据集的41名参与者)中,阳性淀粉样β蛋白(Aβ)个体的全脑水平(顶部面板)和七个静息态网络水平(下部面板)之间的群体平均功能连接性与tau-PET协方差之间的关联。功能连接性分析使用了来自人类连接组计划的500名参与者的功能性MRI数据派生的静息态连接组模板。功能连接性与tau积累模式显著相关,无论是在全脑水平还是在每个静息态网络的水平。DAN,背侧注意力网络;DMN,默认模式网络;FPN,前顶叶控制网络;Limbic,边缘系统;SMN,感觉运动网络;VAN,腹侧注意力网络;VIS,视觉网络。转载自ref.129,CC BY 4.0(知识共享组织 a | 两个独立样本(来自阿尔茨海默病神经影像学计划(ADNI)数据集的53名参与者和来自BioFINDER数据集的41名参与者)中,阳性淀粉样β蛋白(Aβ)个体的全脑水平(顶部面板)和七个静息态网络水平(下部面板)之间的群体平均功能连接性与tau-PET协方差之间的关联。功能连接性分析使用了来自人类连接组计划的500名参与者的功能性MRI数据派生的静息态连接组模板。功能连接性与tau积累模式显著相关,无论是在全脑水平还是在每个静息态网络的水平。DAN,背侧注意力网络;DMN,默认模式网络;FPN,前顶叶控制网络;Limbic,边缘系统;SMN,感觉运动网络;VAN,腹侧注意力网络;VIS,视觉网络。转载自ref.129,CC BY 4.0(知识共享组织一个假设是Aβ和tau病理影响不同的静息态网络。该假设也表明,在AD的晚期阶段,与认知下降和其他AD生物标志物的变化相关的是tau病理而不是Aβ病理(Biomarkers for tau pathology - ScienceDirect)。几项研究支持这一观点,报告Aβ沉积的模式主要重叠于DMN,而tau沉积的模式与其他静息态网络(如边缘网络、前颞网络和视觉网络)重叠。在这些研究中,tau沉积的程度也与多个下游生物标志物相关,包括葡萄糖代谢减低、白质完整性和灰质体积,以及多种认知功能。因此,在同一研究中集成Aβ和tau成像数据可能有助于确定神经退行和认知障碍的特定贡献者。 这里需要注意的是,上述研究中的tau病理和功能连接之间的关联可能会受到Aβ病理存在的影响。事实上,最近的几项研究已经报道了Aβ和tau在功能连接上的交互作用。例如,一项多模态神经影像学研究测量了老年人无认知障碍状态下的fMRI、Aβ PET和tau PET。Aβ阳性且新皮质tau水平低的参与者的DMN和显著性网络连接水平高于Aβ阴性的参与者,并且这些网络的连接性随着这些个体随时间的tau水平上升而下降(Phases of Hyperconnectivity and Hypoconnectivity in the Default Mode and Salience Networks Track with Amyloid and Tau in Clinically Normal Individuals | Journal of Neuroscience (jneurosci.org))。然而,另一项fMRI-PET研究发现,在老年人无认知障碍的情况下,颞下皮层中的tau沉积与海马活动增加有关,但与Aβ沉积无关(Tau Accumulation in Clinically Normal Older Adults Is Associated with Hippocampal Hyperactivity | Journal of Neuroscience (jneurosci.org))。因此,为了分离Aβ病理对tau和功能连接之间关联的影响,需要在Aβ阴性的个体中进行研究。 id:: 641fbfa1-83a2-4177-9495-868dee9ca877 支持这一观点的是,一项fMRI-PET研究报告了更高的任何一对脑区之间的功能连接性与更强的tau协方差之间的关联,特别是在颞下皮层和内侧颞叶(Functional connectivity associated with tau levels in ageing, Alzheimer’s, and small vessel disease | Brain | Oxford Academic (oup.com))。重要的是,在检测不到Aβ病理的情况下,即在无认知障碍的Aβ阳性或Aβ阴性个体以及MCI或AD诊断的个体中都观察到了tau和功能连接之间的关联。实际上,另一项fMRI-PET研究通过内丘脑种子区域的连接性分析确认,内丘脑种子区域与其他脑区域之间更强的连接性与更高水平的tau沉积有关。此外,尽管Aβ沉积增加了tau和功能连接之间的关系,但在Aβ阴性的个体中,这种关系仍然存在。 The connectome in subtypes of ADLate-onset ADFunctional connectome不同类型的阿尔茨海默病(AD),如晚发型AD、常染色体显性AD和早发型AD,与特定的遗传变异相关,这引发了一个问题,即这些亚型是否以不同的方式改变连接组。APOE ε4在晚发型AD的神经病理学和认知功能障碍中具有优势作用,因此,在这个AD亚型中的连接组研究重点关注比较APOE ε4携带者和非携带者。来自多个fMRI研究的收敛证据表明,APOE ε4在AD不同阶段中对于调节网络连通性变化,特别是在DMN中,起着重要作用。早期的fMRI研究报告称,在没有异常Aβ沉积的情况下,APOE ε4携带者在DMN中的功能连通性低于APOE ε4非携带者。随后的fMRI研究结果支持了这一发现,并在多个静息状态网络中(包括显著性、颞叶、视觉、前顶叶和感觉运动网络)确定了APOE ε4相关的功能网络连通性和网络拓扑学的变化,在AD的临床前期阶段。值得注意的是,在一项纵向fMRI研究中,APOE ε4在SCD患者的DMN连接中的影响随着疾病的进展而持续存在,无论Aβ沉积的水平如何(Differential default mode network trajectories in asymptomatic individuals at risk for Alzheimer's disease - ScienceDirect This article provides evidence that APOE ε4 leads to changes in DMN, independent of Aβ pathology)。 家族史与功能网络连接性之间的关系也在APOE ε4非携带者晚发型AD中进行了研究。即使没有APOE ε4,具有晚发型AD家族史的无认知障碍个体的静息态DMN连接性也比没有该疾病家族史的个体低150。在具有晚发型AD家族史的个体中,SCD与更高的静息态DMN连接性相关;在这些记忆力下降的个体中,更高的连接性与基线时更好的记忆力、注意力和全局认知相关,但随时间的推移与更严重的记忆力下降相关。一个假设是,由于功能网络连接性测量与认知和临床表型密切相关,因此它们可能对预测具有晚发型AD和已知疾病家族史的个体的疾病进展有用。事实上,在一项机器学习研究中,DMN、显著性网络和边缘系统的功能网络连接性以及灰质体积,能够准确预测具有晚发型AD和家族史的个体的症状发作年龄(Brain properties predict proximity to symptom onset in sporadic Alzheimer’s disease | Brain | Oxford Academic (oup.com))。 Structural connectomeAPOE ε4相关的结构性脑连接组与功能性脑连接组的变化类似,主要涉及DMN和内侧颞叶。具体而言,DTI研究发现APOE ε4携带者在临床前晚发型AD中存在局部连接损失,其特征是相对于无认知障碍的非携带者控制组,集聚系数、局部效率和中介中心性均减少。这种减少影响DMN的后部和额叶中枢,包括楔前叶、内侧眶额皮质、前/后扣带皮层等。在这些DTI研究中,DMN连接异常程度与记忆障碍以及注意和执行功能障碍的程度有关。此外,研究表明APOE ε4携带者在内侧颞叶区域的结构连接也受到显著的破坏,例如右侧海马区的效率降低以及海马旁回的效率降低,这种情况在无认知障碍的个体和轻度认知障碍的个体中均有报道。值得注意的是,一项静息态DTI-fMRI研究发现,在中年时期就可以检测到APOE ε4相关的网络变化(Disrupted topology of the resting state structural connectome in middle-aged APOE ε4 carriers - ScienceDirect This study shows that APOE ε4-related structural connectome changes occur even in middle-aged individuals)。这一观察结果表明,APOE ε4对连接组组织的影响可以在症状发作数十年前就产生,因此可能成为早期检测AD的有前途的生物标志物。 超越APOE基因型,两个全基因组关联研究报告了结构连接组织变化和多个与AD相关的遗传变异之间的特定关联。其中一个研究是一项新颖的横断面基因组关联研究,研究了健康成年双胞胎之间的DTI结构连接组织和SPON1变异之间的全连接组、全基因组关联。值得注意的是,SPON1编码spondin-1(也称为F-spondin),在海马中表达,并促进海马胚胎神经元的生长。SPON1还与APOE相互作用,调节Aβ沉积。重要的是,具有SPON1变异的个体患痴呆症的病情较轻,而不受APOE基因型的影响,表明SPON1变异在临床前晚发性AD中具有保护作用。总之,这些发现间接表明SPON1在晚发性AD中发生的结构连接组织变化中发挥了作用,表明晚发型AD中的结构性脑网络变化与多个基因的变异相关,而不仅仅是APOE基因型。 Autosomal-dominant AD相比于晚发性AD和散发性早发性AD,常染色体显性遗传AD是由APP、PSEN1和PSEN2这三个基因中的一个单基因决定性突变引起的。此外,患有常染色体显性遗传AD的人常常表现出一致的生物标志物变化时间模式,即首先是Aβ(CSF Aβ42和Aβ-PET)的增加;其次是tau(CSF p-tau和tau-PET)的增加;第三是代谢下降;第四是皮层萎缩;最后是临床退化(Spatial patterns of neuroimaging biomarker change in individuals from families with autosomal dominant Alzheimer's disease: a longitudinal study - The Lancet Neurology)。常染色体显性遗传AD的发病年龄在家族内也是一致的。因此,在患有常染色体显性遗传AD的个体中研究脑连接组变化,可以比其他AD亚型的个体更精确地评估已知的基因突变和疾病进展的影响。 Structural connectome许多研究报道了在常染色体显性AD临床前期个体中,灰质萎缩和白质扩散性质改变的证据;但是,针对该疾病亚型的结构性脑连接组的研究仍然较少。一项全面的纵向研究对269名孟德尔型AD突变携带者和170名非携带者进行了结构性灰质网络构建;同时进行了横断面和纵向分析。在横断面分析中,突变携带者和非携带者之间最早的差异是在预测症状发作前约12年时携带者的标准化路径长度(尤其是在额枕部)较低。在纵向分析中,两组参与者之间最早的差异是在预测症状发作前6年时携带者的标准化聚类系数、连接密度和度数降低。在横断面分析中,与基线小世界系数较低相关的因素包括更高的Aβ堆积、更高水平的神经退行性生物标志物(葡萄糖代谢下降和额枕皮层变薄)和更大的认知衰退。在纵向分析中,更快的Aβ堆积、神经退行性生物标志物水平和认知衰退变化与随时间减少的小世界系数相关。该研究还发现,与APP或PSEN2突变携带者相比,PSEN1突变携带者的全局网络连接性较低,这表明不同孟德尔型AD基因的突变不会导致相同的连接性变化。 Functional connectome至今为止,关于自身显性遗传性AD的功能连接组变化,仅使用fMRI进行了评估。在其中一项fMRI研究中,Chhatwal等人评估了无症状的自身显性遗传性AD突变携带者(APP、PSEN1和PSEN2)和同一家族中的非携带者的DMN功能连接,发现突变携带者的连接性较低,特别是在后扣带回/楔前叶和右顶叶皮质。值得注意的是,随着疾病进展,突变携带者的DMN连接性破坏加重。在一项更近期的fMRI研究中,自身显性遗传性AD和晚发性AD均与多个静息态网络的功能连接减少有关,包括DMN、背侧注意网络和扣带-顶叶网络(也称为显著性网络)。与Chhatwal等人的研究结果相一致,自身显性遗传性AD突变携带者在多个静息态网络中的功能连接性比非携带者低,略早于其预计的症状发作年龄。这一系列fMRI连接性研究中最近的一项于2018年发表,还报道了自身显性遗传性AD突变对疾病临床前期的DMN和背侧注意网络降解的特异性影响。这三项fMRI研究的结果表明,APP、PSEN1和PSEN2的突变影响了网络级别的神经退行性。 还使用fMRI技术研究了各种AD亚型中功能连接组组织、tau蛋白沉积和认知下降之间的关系。特别是一项研究报告了额叶中枢区更高的功能连接与晚发性AD患者和自身显性遗传性AD突变携带者记忆和全球认知损害减缓之间的关联170。这种更高的连接性也与在具有临床前期Aβ阳性的晚发性AD患者中,tau对认知下降的影响更小有关。 Early-onset AD与晚发性和常染色体显性遗传性AD相比,零散性早发性AD的脑连接组学研究较少,其占所有AD病例的4-6%。在一项fMRI研究中,与没有认知障碍的个体相比,早发性AD患者的全局和局部网络连接发生了变化,其中感觉运动区的聚集系数降低,颞叶的路径长度增加(Brain network connectivity differs in early-onset neurodegenerative dementia | Neurology A functional brain network study shows distinctive network connectivity patterns in early-onset AD and frontotemporal dementia)。 一些DTI研究报告早发性AD与后部脑区的结构连接障碍和富俱乐部属性有关。如前一节所述,典型的晚发性AD表现为涉及DMN和海马的功能和结构网络连接的破坏,这些区域很可能在记忆加工中起着重要作用。因此,与早发性AD相关的后部脑区的连接变化可能解释了早发性AD患者通常在各种认知领域(包括视觉空间、注意力和执行领域)出现认知功能障碍,而晚发性AD则表现为失去陈述记忆的能力。 Pathological protein spread人类研究和转基因小鼠模型的一致证据表明,与神经退行性疾病有关的错折蛋白,如AD中的Aβ和tau,以及帕金森病中的α-突触素,都表现出典型的时空积累模式。一种假设是,这些模式反映了沿结构连接的朊病毒样跨神经元传播(Protein transmission in neurodegenerative disease | Nature Reviews Neurology)。这种假设得到了许多转基因小鼠模型的研究结果的支持。这些研究报道了通过神经元通路传播的错折tau,遵循类似朊样的过程,这似乎是由Aβ病理学所促进的。tau扩散假说也得到了将tau-PET与功能和/或扩散MRI相结合的人类研究的支持(Structural tract alterations predict downstream tau accumulation in amyloid-positive older individuals | Nature Neuroscience This article provides evidence that tau spreads through structural connections facilitated by Aβ pathology;Functional brain architecture is associated with the rate of tau accumulation in Alzheimer’s disease | Nature Communications This study reports the spatial relationships between that tau accumulation and functional brain networks in AD)。 另一个主要假说是,这些模式反映了特定脑区的选择性神经元异常(或易感性)(A critical appraisal of the pathogenic protein spread hypothesis of neurodegeneration | Nature Reviews Neuroscience;Selective Neuronal Vulnerability in Alzheimer’s Disease: A Network-Based Analysis - ScienceDirect)。这个假说起源于一个观察,即在AD的病程早期,一些神经元比其他神经元更早出现结构和功能异常。PET检测到的Aβ和tau沉积的初步模式似乎支持了这个假说,因为Aβ最初沉积在DMN的内侧节点(内侧前额叶和PCC / 楔前叶)中,而tau最初沉积在内嗅皮层,提供了证据表明特定的中心区域在Aβ和tau病理方面具有选择性易感性。此外,显示出早期Aβ沉积的中心区域也是高代谢需求区域(Aβ-induced vulnerability propagates via the brain’s default mode network | Nature Communications)。因此,在AD中网络中心区的选择性异常可以从代谢角度解释。具体而言,研究表明,高度连接的中心区域通过氧化葡萄糖代谢需要高代谢能量。此外,一个小鼠连通组学研究发现,中心区的连通性由调节ATP氧化合成和代谢的基因通路驱动(A transcriptional signature of hub connectivity in the mouse connectome | PNAS)。因此,当处于代谢压力下时,这些高成本中心区可能容易显示异常连接性。实际上,越来越多的证据表明,DMN中更高的Aβ沉积与DMN和其他功能连通的脑区的更强区域性代谢减退有关。在其他研究中,代谢减退的空间位置与不同亚型AD(晚发性AD早发性AD196和常染色体显性遗传AD)的tau沉积模式强相关。但是,在AD中,tau相关代谢减退与连接组变化之间的关系尚未被研究。未来,将连接组(通过MRI或MEG测量)与多模态(tau,Aβ和FDG)PET整合的研究可能有助于确定连接组,tau,Aβ和葡萄糖代谢减退之间的交互关系。 Box 4 Mechanistic insights from animal models尽管本综述主要关注人类研究,但动物模型研究也产生了有关连接组和淀粉样β蛋白(Aβ)和tau病理之间关系的证据。例如,转基因小鼠模型的证据表明,神经元活动可以调节特定脑区的Aβ积累,并促进tau的释放和细胞间传播。一项研究使用了tau病理的小鼠模型,并报告称,区域性的tau沉积主要由解剖连接而不是细胞内因素(基因表达谱)驱动。另一项研究将人类tau成纤维前体注入到转基因小鼠的海马中,诱导tau扩散,首先影响到了尾侧内侧颞叶皮层和对侧海马,这进一步支持了tau扩散与连接组之间的关系。此外,Aβ促进tau通过神经元连接扩散的假设也在小鼠模型中得到了验证。因此,尽管将动物模型直接转化为人类仍然存在挑战,但动物模型的研究结果可以为AD相关的连接组变化的发病机制提供重要的机制性见解。 Connectome-based computational models计算模型(见方框5)提供了一种测试理论假设的补充方法——模型发现可以与实证数据进行比较。特别地,计算模型可以用于模拟和复制PET成像数据中发现的Aβ和tau病理学模式,从而测试上述选择性易感性假说和病理学传播假说。超越复制实证结果,计算模型还可以用于跟踪和预测Aβ和tau进展的轨迹,揭示连通组变化和AD病理之间的动态关系。事实上,中枢对错误折叠蛋白质的选择性异常得到了使用神经质量模型模拟网络变化的研究结果的支持,这些模型通常建立在根据 DTI 数据估计的解剖网络上,并生成 EEG 和 MEG 样数据(方框 5)。特别地,AD的一个计算模型发现异常的中枢连通性是由过度神经活动引起的,导致网络退化(Activity Dependent Degeneration Explains Hub Vulnerability in Alzheimer's Disease | PLOS Computational Biology)。在最近的一项计算研究中,神经元活动的病理性增加对功能网络中枢的破坏(Neural oscillations and brain stimulation in Alzheimer’s disease - ScienceDirect)可能会被神经元兴奋性水平的有针对性调整所抵消(Altering neuronal excitability to preserve network connectivity in a computational model of Alzheimer's disease | PLOS Computational Biology)。一项 Aβ-PET 和 FDG-PET 研究报告称,Aβ 积累通过人类 DMN 中的中枢传播,导致空间遥远但功能相连的大脑区域代谢减退,这有助于证明远处 Aβ 积累可诱发区域代谢异常(Amyloid-PET and 18F-FDG-PET in the diagnostic investigation of Alzheimer's disease and other dementias - The Lancet Neurology)。这一观察结果在形成Aβ病理学但不形成神经纤维缠结(tau病理学)的转基因大鼠中得到了复制,表明Aβ引起的中枢异常连接与tau病理学无关。总之,这些发现凸显了网络中枢在维持信息传输的分离和整合之间的最佳平衡方面的重要性,并表明中枢可以促进AD病理的早期传播。 在一些研究中,流行病扩散模型(ESM)(见框5)成功地复制了在实证数据中发现的Aβ蓄积和tau扩散模式。特别是,一项模拟研究使用ESM测试了tau扩散假设(Spread of pathological tau proteins through communicating neurons in human Alzheimer’s disease | Nature Communications This computational modelling study provides evidence in humans that tau spreads through neuronal network pathways facilitated by Aβ accumulation)。将内嗅皮层作为起点,ESM应用于没有认知障碍的年轻个体的基于DTI的结构连接组,并解释了AD连续体中个体tau-PET信号的空间模式的a | 根据 Braak 分期 tau 病理学的假设模式。在第一阶段,tau 最初在内嗅皮层沉积,第二阶段传播到海马和扣带回,第三阶段传播到颞叶和扣带(例如后扣带皮层),最后在第四阶段扩展到额叶、视觉皮层和顶叶(例如枕叶)区域。b | 不同阶段的 AD 的 tau 病理模式,根据经验性 tau-PET 数据。c | 根据扩散张量成像数据导出的结构性连接组所建立的流行病传播模型 (ESM) 预测的 tau 病理模式。d | 根据静息态功能磁共振成像数据导出的功能性连接组所建立的 ESM 预测的 tau 病理模式。结构性连接组(第 c 部分)模拟的 ESM 预测的 tau 传播模式与假设(第 a 部分)和经验性(第 b 部分)tau 传播模式更相似,而功能性连接组(第 d 部分)模拟的 tau 传播模式与之相比则更不相似。请注意,经验性和预测的 tau 传播模式中的较暖颜色表示 tau 沉积水平较高。来源:来自文献202,CC BY 4.0 ([知识共享组织](https://creativecommons.org/licenses/by/4.0/)。%E3%80%82)) 网络扩散模型(NDN; 见Box 5)也被用于研究AD的病理模式。这些模型表明AD的病理是以扩散的方式传播的,并预测了未来皮质萎缩和葡萄糖代谢减低的模式(Models of Network Spread and Network Degeneration in Brain Disorders - ScienceDirect)。具体而言,一项研究报告称,在健康大脑中,基于少数几个候选AD基因(APP、MAPT、PRNP)的区域表达来预测线性模型,可以预测AD中网络中心的异常连接性(Regional vulnerability in Alzheimer's disease: The role of cell-autonomous and transneuronal processes - ScienceDirect)。此外,将NDN和区域基因表达模式组合在线性预测模型中,并选择内嗅皮质作为种子,可以提高该模型预测区域萎缩和葡萄糖代谢减低模式的能力。这些结果支持了脑连接模式在AD病理扩散中的作用,以及网络模型在预测疾病进展方面的重要性,超越了其作为表征脑结构和功能的描述性工具的实用性。需要注意的是,NDN和ESM都用于预测疾病进展,但两种模型的性能尚未使用相同的连接组数据进行直接比较,这可能是一个有趣的未来方向。 Box 5 Computational models in network neuroscience总体来说,网络神经科学领域的计算模型使用描述感兴趣变量的动态演化的一组微分方程,这些变量通常与神经元群体相关联。这些方程是在描述大规模解剖网络的结构连接矩阵上计算的。本文定义了在痴呆研究领域应用的三种这样的模型变体。 Neural mass models 神经群体模型由相互连接的节点组成,每个节点代表相互连接的兴奋性和抑制性神经元的大量群体(“神经群体”)中的平均神经活动。神经群体模型的特征是神经元群体的平均膜电位(例如模拟的脑电图或脑磁图信号)和射频密度(或发放率)。模型的局部动力学受到解剖途径连接的影响,这些途径连接空间远离的神经元群体和脑区域。耦合可以是相互的或定向的,这取决于用于定义耦合矩阵的解剖数据,通常包括连接权重以及距离依赖的时间延迟。 Network diffusion models 网络扩散模型通过结构网络模拟扩散模式。例如,这些模型可以通过使用网络热方程模拟跨结构连接网络的细胞间蛋白质扩散,网络热方程提供跨神经元扩散的解析闭式解。该模型假定脑区中所有神经元的平均激活信号与发放神经元数量成比例。 Epidemic spreading models 传染病扩散模型模拟信号(如有毒淀粉样蛋白和Tau蛋白)的流行病扩散过程,从预选的中心向不同的脑区域扩散。扩散模式在结构连接网络上进行模拟,可以为每个个体拟合几个模型参数,分别表示个体特定的全局生产率、全局清除率和起始时间。这些参数与区域结构连接模式结合使用,决定了扩散速度。与网络扩散模型不同,传染病扩散模型需要指定产生和/或清除项,并通过随机微分方程实现,而不是解析方程。 Challenges and opportunities尽管在阿尔茨海默病的脑网络分析方面已经取得了实质性进展,但还有两个重要的问题没有得到解决。首先,在临床前阶段的阿尔茨海默病中,Aβ最初在DMN中线的前部和后部枢纽积累,而tau最初积累在内侧颞叶枢纽——Aβ和tau病理在这个阶段影响不同的脑网络的原因尚不清楚。其次,Aβ和tau如何相互作用,以及它们如何相互作用和/或独立地影响AD中连接组的组织,目前还不清楚。因此,我们需要更好地了解这些AD病理和相关脑网络变化之间的联系,以及不同AD亚型观察到的生物标志物变化的根本原因和时间顺序。 一种被称为分子假说的假说认为,AD的遗传风险因素调节Aβ和tau病理以及AD中的下游连接组改变(The multiplex model of the genetics of Alzheimer’s disease | Nature Neuroscience)。因此,研究受Aβ和tau病理最严重影响的脑区的基因表达谱可能为上述两个问题提供部分答案。20,736个编码蛋白质的基因在健康大脑中的区域基因表达谱是通过Allen人类大脑图谱(AHBA)的大脑微阵列转录组数据获得的,并用于两项Aβ和tau沉积模式的研究中。在第一项具有横断面设计的研究中,Aβ-PET信号与AHBA中的APP区域表达水平相关联。具有AD的个体的皮质萎缩神经退行性与AHBA中MAPT的区域表达水平相关联。在后续的研究中,Aβ的纵向沉积模式,以PET为特征,与CLU和“轴突相关”的遗传表达谱的区域表达水平相关联,而tau扩散模式与MAPT和“树突相关”的遗传表达谱的区域表达水平相关(Neurogenetic contributions to amyloid beta and tau spreading in the human cortex | Nature Medicine This article was one of the first linking Aβ accumulation and tau spreading with brain-wide gene expression in the human AD)。值得注意的是,Aβ和tau传播模式也与“脂质代谢”的共同遗传表达谱相关,其中APOE基因起着关键作用。 这些基因-蛋白质空间关联可能解释了Aβ和tau沉积的局部化与它们被假定的下游神经退行性模式之间的不一致性。支持这种观点的是,转基因小鼠的一项研究报告称,LRP1是tau蛋白沉积和扩散的主要调节因子。值得注意的是,LRP1的蛋白产物(LRP1)参与胆固醇(一种脂类)代谢的调节,这是导致Aβ沉积的生物途径之一。LRP1调节转基因小鼠中的tau病理的观察结果引发了一个问题,即人类连接组的局部LRP1表达是否与不同AD阶段的tau沉积和扩散模式相关。在未来,整合空间基因表达谱与大脑结构和功能连接组的组织以及不同AD阶段的Aβ和tau传播模式信息的多模式神经影像学研究可能进一步增进我们对Aβ和tau病理特异但相关模式的理解(图6)。 Fig. 6: Gene expression, AD pathology and the human connectomes. 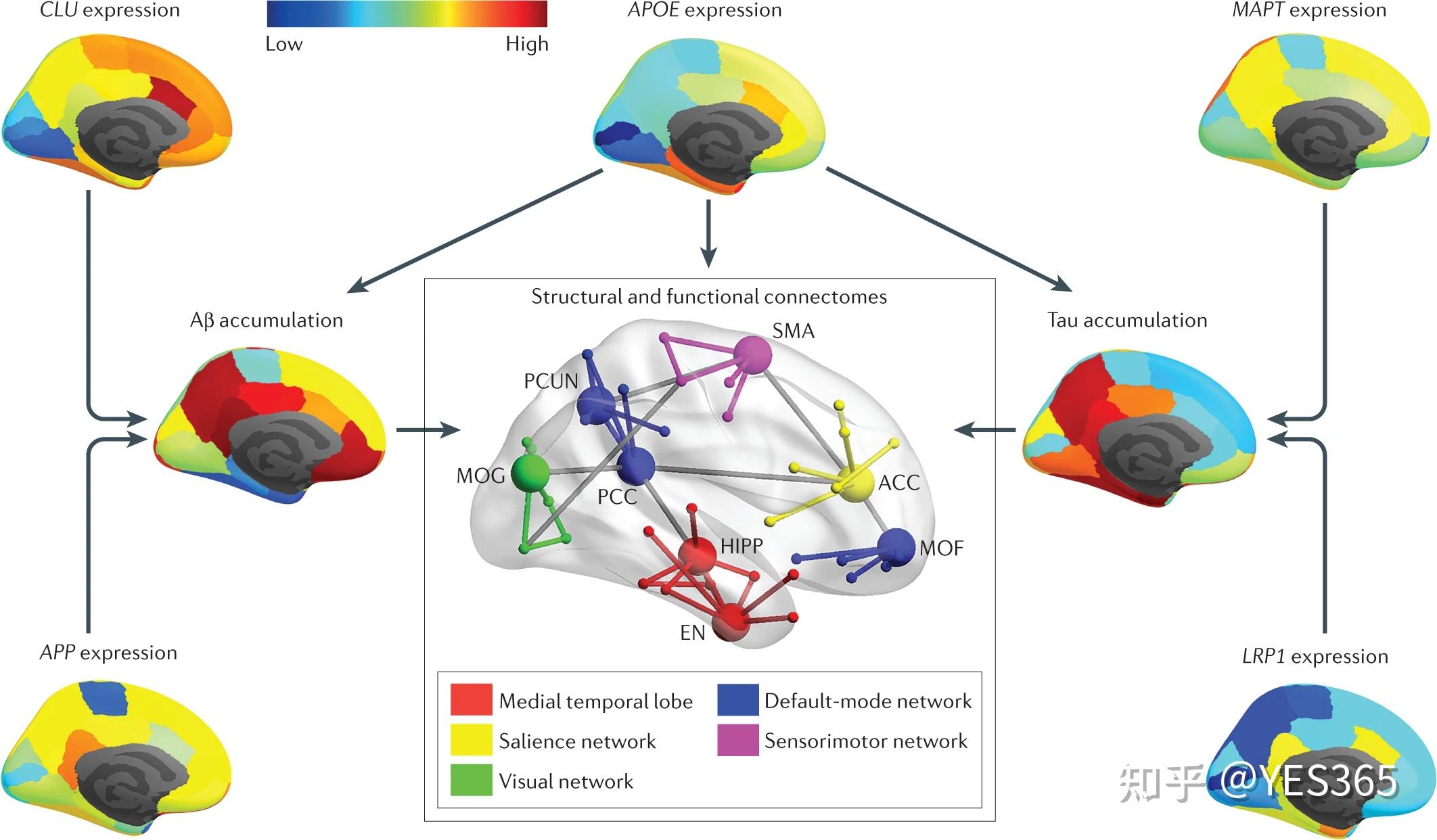 在大脑中,证据表明CLU和APP的区域表达水平可以调节淀粉样β(Aβ)的积累,而MAPT和LRP1的区域表达水平可以调节tau的积累和传播。此外,APOE的区域表达水平在调节Aβ和tau的积累模式中起着核心作用。人类连接组由五个子网络组成:内侧颞叶网络、显著性网络、视觉网络、默认模式网络和感觉运动网络。这些网络通过枢纽(anterior cingulated cortex(ACC)、entorhinal cortex(EN)、hippocampus(HIPP)、middle occipital gyrus(MOG)、medial orbitofrontal cortex(MOF)、posterior cingulate cortex(PCC)、precuneus(PCUN)和supplementary motor area(SMA))相互连接。阿尔茨海默病(AD)中人类连接组的特征是Aβ和tau病理以及APOE表达之间目前还不清楚的交互作用的结果。基因表达图是使用公共可用的基于微阵列的区域基因表达数据(来自Allen人类大脑图谱)创建的,如ref.211所述。暖色表示更高的基因表达水平;不同基因表达图中的相同颜色可能代表不同的基因表达值,因为表达值在不同基因之间没有进行标准化。Aβ和tau积累图是根据ref.4和ref.78的PET数据手工创建的。Aβ和tau大脑图中的暖色表示Aβ和tau积累的早期和更高水平。 在大脑中,证据表明CLU和APP的区域表达水平可以调节淀粉样β(Aβ)的积累,而MAPT和LRP1的区域表达水平可以调节tau的积累和传播。此外,APOE的区域表达水平在调节Aβ和tau的积累模式中起着核心作用。人类连接组由五个子网络组成:内侧颞叶网络、显著性网络、视觉网络、默认模式网络和感觉运动网络。这些网络通过枢纽(anterior cingulated cortex(ACC)、entorhinal cortex(EN)、hippocampus(HIPP)、middle occipital gyrus(MOG)、medial orbitofrontal cortex(MOF)、posterior cingulate cortex(PCC)、precuneus(PCUN)和supplementary motor area(SMA))相互连接。阿尔茨海默病(AD)中人类连接组的特征是Aβ和tau病理以及APOE表达之间目前还不清楚的交互作用的结果。基因表达图是使用公共可用的基于微阵列的区域基因表达数据(来自Allen人类大脑图谱)创建的,如ref.211所述。暖色表示更高的基因表达水平;不同基因表达图中的相同颜色可能代表不同的基因表达值,因为表达值在不同基因之间没有进行标准化。Aβ和tau积累图是根据ref.4和ref.78的PET数据手工创建的。Aβ和tau大脑图中的暖色表示Aβ和tau积累的早期和更高水平。本综述所讨论的研究发现存在一些限制,这些限制可能影响解释结果。首先,神经和血管因素随着年龄的增长变化不同,而这两个因素都对fMRI测量的血氧水平依赖信号产生影响。此外,脑血管血流动力学的功能失调与老龄化白质高信号有关。因此,神经-血管相互作用的年龄相关变化可能会影响对fMRI和扩散MRI结果的解释。已经开发了一系列旨在区分MRI测量中年龄相关的神经和血管效应的方法,并建议将其用于未来的研究(Separating vascular and neuronal effects of age on fMRI BOLD signals | Philosophical Transactions of the Royal Society B: Biological Sciences (royalsocietypublishing.org))。第二个限制是本综述中所讨论的大多数数据集都是针对欧洲人祖先的个体权重的。未来的研究应该包括更广泛和更多样化的全球人群样本,包括非洲人、亚洲人、西班牙裔和混血亚群体。 Conclusions and future directions在本文中,我们回顾了近期的数据,将人类连接组织的结构与不同类型和阶段的AD的分子和神经病理标记联系起来。现有的数据表明,选择性中枢脑区脆弱性是导致Aβ在DMN的内侧中枢聚集和tau在临床前AD的内侧颞叶中枢聚集的原因。数据还表明,病理扩散假说是解释tau从颞叶到DMN后部中枢的跨细胞传播的最有可能的解释。分子假说似乎是解释APOE ε4导致的脑连接组织和Aβ和tau病理变化的最有可能的解释。值得注意的是,这些假说需要使用多组学研究框架更直接地进行调查,该框架将经验多模态神经影像和基因表达数据与计算脑网络模型相结合。 Aβ和tau病理学、遗传变异、神经退行性标记物(包括网络水平上的标记物)以及沿着AD连续谱的认知障碍之间的高阶关系仍然大部分未知(Imaging the evolution and pathophysiology of Alzheimer disease | Nature Reviews Neuroscience This article provides a comprehensive review of neuroimaging studies in different types and stages of AD)。研究AD的特定亚型可以有助于解决病理、遗传结构和临床表型的异质性所带来的挑战。纵向研究(Longitudinal neuroimaging biomarkers differ across Alzheimer’s disease phenotypes | Brain | Oxford Academic (oup.com))、机器学习和多元数据分析(例如,规范相关分析(Structural brain measures linked to clinical phenotypes in major depression replicate across clinical centres | Molecular Psychiatry (nature.com)))可以阐明不同类别的AD生物标记物之间的关系,确定临床和生物亚型,从而有助于开发有效的治疗方案。此外,使用多个研究地点的神经影像和基因数据通常可以提高统计功效和结果的普适性;然而,多个研究地点的数据也包含相当多的非生物学变异,这是由于使用了不同制造商的扫描仪和不同的采集协议。因此,需要使用统计协调技术来消除地点效应,同时保留生物变异。需要新兴的研究设计和方法,能够解决AD的复杂性,例如,一个跨认知功能、连接组、基因网络和病理生理学的多层网络框架,以实现AD和相关疾病的精准医疗。 |
【本文地址】
今日新闻 |
推荐新闻 |