一种超折叠绿色荧光蛋白介导异源蛋白在大肠杆菌中分泌表达方法与流程 |
您所在的位置:网站首页 › 大肠杆菌表达方式 › 一种超折叠绿色荧光蛋白介导异源蛋白在大肠杆菌中分泌表达方法与流程 |
一种超折叠绿色荧光蛋白介导异源蛋白在大肠杆菌中分泌表达方法与流程
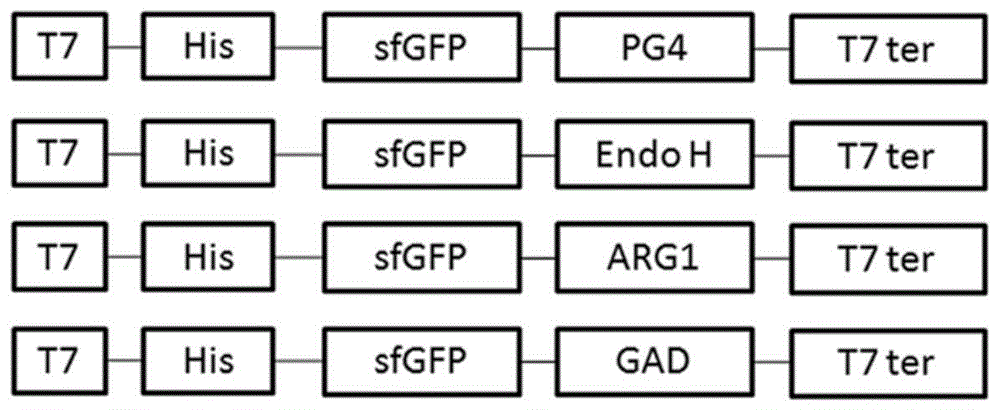 本发明涉及的是生物工程技术领域,特别是一种超折叠绿色荧光蛋白(sfgfp)介导异源蛋白在大肠杆菌中胞外分泌表达方法。 背景技术: 异源蛋白在大肠杆菌中分泌表达可分为周质分泌表达和胞外分泌表达两种。周质表达是指将重组蛋白通过信号肽介导由胞质转运到细胞周质空间的表达方式。常使用phoa、ompa、ompt、lamb、6-内酰胺酶、肠毒素st-ⅱ、lt-a、lt-b、金黄色葡萄球菌蛋白a、人生长激素信号肽等不同类型的信号肽,将表达的蛋白质从细胞质中转运到周质,由于周质空间是氧化性的间隙,可以模拟真核细胞的内质网环境,新生肽链能够有效折叠成天然结构,获得具有生物活性的重组蛋白。胞外表达是指将重组蛋白通过特殊分泌途径分泌到胞外的表达方式。革兰氏阴性菌主要存在着ⅰ型~ⅶ型七大类分泌系统,其中以ⅱ型和ⅴ型分泌系统应用最为广泛。重组蛋白胞外分泌的显著优点是,由于大肠杆菌内源分泌的蛋白并不多,便于重组蛋白纯化。这两大类系统具有共同的特点是,首先需要通过信号肽介导来实现目的蛋白质由胞质跨膜转运到细胞周质,其次目的蛋白需要经过在细胞周质空间中再折叠组装成具有功能的形态。由于周质空间大小有限,有时会发生二硫键的错配,导致正确折叠的目的蛋白含量少,加之细胞外膜的阻隔使得目的蛋白分泌到胞外的产量很少。 据文献报道,虽然通过增加外膜的通透性(超声波,添加mg2+、ca2+、edta、甘氨酸和tritonx-100等化学试剂,和溶菌酶处理等)、选择基因缺陷型菌株(l-型细菌)、共表达策略(kil蛋白)等可以提高目的蛋白胞外分泌的量,但同时也引入操作复杂、分泌条件苛刻、大肠杆菌生产缓慢等问题,并不适合规模化生产。 因此,需寻找新的分泌蛋白,用于异源蛋白在大肠杆菌中胞外分泌表达,以解决目前分泌表达技术中操作过程复杂,需要通过信号肽介导,目的蛋白得率低等不足之处,并能适合规模化生产。 超折叠绿色荧光蛋白(sfgfp)的属性。 1962年,下村修等首次从维多利亚多管水母属(aequoreavictoria)中分离纯化出在紫外光下发出强烈绿色的蛋白质,命名为绿色荧光蛋白(gfp)。gfp是11个β-折叠组成的β-桶状结构,在β-桶中央有一个α-螺旋。gfp以其结构稳定、检测简单、灵敏度高、无生物毒性、荧光反应不需要任何外源反应底物及细胞组织的专一性等优点,被作为报告蛋白,作为报告蛋白广泛用于基因表达调控,蛋白质的定位、转移及相互作用和细胞的分离与筛选等研究领域。 超折叠绿色荧光蛋白(sfgfp)是在折叠gfp作为报告基因的基础上进行了六轮突变而获得,突变位点为s30r、y39n、n105t、y145f、i171v和a206v。sfgfp在折叠性和稳定性方面有显著提高,sfgfp折叠速率是折叠gfp报告基因的3.5倍。sfgfp与许多蛋白融合后,融合蛋白具有更好的荧光强度,折叠速率和溶解度。 技术实现要素: 本发明的目的是提出一种超折叠绿色荧光蛋白(sfgfp)介导异源蛋白在大肠杆菌中胞外分泌表达方法。它是将超折叠绿色荧光蛋白(sfgfp)作为融合标签并介导异源蛋白在大肠杆菌中实现胞外分泌表达。利用了超折叠绿色荧光蛋白的分泌特点,无需通过信号肽介导,简化操作过程,提高了目的蛋白的得率,适合规模化生产。 本发明提出的一种超折叠绿色荧光蛋白(sfgfp)介导异源蛋白在大肠杆菌中胞外分泌表达方法。其步骤为, 1)构建含有超折叠绿色荧光蛋白基因sfgfp的重组表达载体pet23a/sfgfp-gfp。 ①设计pcr引物(引物编号:psfgfpf,psfgfpr)扩增sfgfp基因; ②设计pcr引物(引物编号:pgfpf和pgfpr)扩增gfp盒式结构; ③通过pcr(引物编号:psfgfpf和pgfpr)构建融合基因(sfgfp-gfp); ④将融合基因(sfgfp-gfp)克隆到表达载体pet23a-t上,构建重组表达载体pet23a/sfgfp-gfp; 所述超折叠绿色荧光蛋白(sfgfp)的氨基酸序列见序列表,引物名称及序列见表1,设计方案图1及质粒构建示意图见图2。 表1引物名称及引物序列 a引物方向为5’-3’;下划线为同源区域。 2)构建异源蛋白重组表达载体。 异源蛋白基因分别为a:毒性蛋白抗菌肽pg4,b:β-n-乙酰氨基葡萄糖苷酶h,endoh,c:同源三聚体蛋白人源精氨酸酶-1arg1,d:磷酸吡哆醛为配体同源六聚体蛋白谷氨酸脱羧酶,gad; ①设计pcr引物对(引物编号:ppg41~ppg44;pendohf,pendohr;parg1f,parg1r和pgadf,pgadr)分别扩增基因(pg4、endoh、arg1和gad); ②分别将基因(pg4、endoh、arg1和gad)克隆到表达载体pet23a/sfgfp-gfp,构建重组表达载体pet23a/sfgfp-pg4,pet23a/sfgfp-endoh,pet23a/sfgfp-arg1和pet23a/sfgfp-gad。所述引物名称及序列见表1,设计方案图1及质粒构建示意图见图3。 3)构建分批补料发酵重组表达载体pet30a/sfgfp-arg1。 ①设计pcr引物(引物编号:p30sfgfpf和p30arg1r),以表达载体pet23a/sfgfp-arg1为模板扩增融合基因(sfgfp-arg1); ②将融合基因(sfgfp-arg1)克隆到表达载体pet30a,构建重组表达载体pet30a/sfgfp-arg1。所述引物名称及序列见表1,设计方案图1及质粒构建示意图见图4。 4)获得基因工程表达菌株。 将构建好的重组表达载体分别转化大肠杆菌表达菌株rosettablue感受态细胞,涂布于lb(氨苄青霉素浓度为50μg/ml)平板,37℃静置培养过夜,获得多种基因工程菌株; 所述构建好的重组质粒为:pet23a/sfgfp-pg4、pet23a/sfgfp-endoh、pet23a/sfgfp-arg1、pet23a/sfgfp-gad和pet30a/sfgfp-arg1; 5)将基因工程菌株进行培养表达,将各种基因工程菌株,挑取单菌落接种于100mllb液体培养基(氨苄青霉素浓度为50μg/ml),37℃震荡培养,od值为0.5~0.6之间,加入iptg,终浓度为1mm,37℃震荡培养8小时。培养完成之后,12000rpm,4℃,10分钟离心分别收集菌体和培养基上清备用。 6)选取含有表达载体pet30a/sfgfp-arg1的重组菌株进行分批补料发酵,具体操作流程如下: ①挑取转化的单菌落于2mlsob(卡纳青霉素浓度为50μg/ml)培养液中37℃培养过夜,转接于装有200mlsob(卡纳青霉素浓度为50μg/ml)培养基于1000ml摇瓶中,培养5~8小时,制备种子液; ②将sob培养基原料在发酵罐中原位灭菌后,添加维生素及微量元素混合液,将种子液接种到发酵罐中,添加卡纳青霉素(终浓度为50μg/ml),罐中的起始sob培养基体积为1.5l; ③控制转速及通气量使发酵液溶氧量保持在30%,用2mol/lnaoh控制ph值约为6.5~7.0,控制温度在37℃培养; ④当菌体生长达到对数生长点的时候,开始控制流加补料(补料培养基:200g/l酵母抽提物,100g/l甘油,15g/lα-乳糖),发酵温控制到30℃。每隔一定时间取样测定菌体浓度,用sds-page检测培养基上清中纯化的目的蛋白的量,用荧光光度计测定培养基上清中的荧光强度,同时测定培养基上清中arg1的酶活; ⑤当纯化的培养基上清中的目的蛋白量达到最大时,停止发酵。 7)融合蛋白功能验证。 功能验证方法 1)融合蛋白sfgfp-endoh活性测定 通过分析天然的核糖核酸酶b(ribonucleaseb,rnaseb)的去糖基化程度来说明endoh的酶活。操作步骤如下:①将endoh配成0.5mg/ml酶液,取50μl1mg/ml天然rnaseb,分别加入不同稀释浓度的endoh酶液1~3μl,37℃反应1小时;②sds-page鉴定分析。 2)融合蛋白sfgfp-arg1活性测定 人源精氨酸酶1的酶活测定方法是利用chinard反应[12]。反应体系如下:100μll-精氨酸(0.2mol/l),880μl碳酸氢钠缓冲液(50mmol/l,ph10.0)和20μl已知蛋白浓度的人源精氨酸酶。操作步骤如下:①反应体系在40℃水浴中预热5分钟;②反应体系在相同的温度下震荡10分钟,使反应充分进行;③在100℃水浴中静置5分钟终止反应;④待反应体系冷却至室温,测定吸光度。一个单位酶活定义为,在反应温度40℃条件下,产生1μmol/l的l-鸟氨酸所需要的酶量。 3)融合蛋白sfgfp-gad活性测定 谷氨酸脱羧酶的测定方法是利用berthelot反应,参照文献[13-15]进行。吸取样液0.8ml,依次加入1mol/l的na2co3溶液0.2ml,0.2mol/lph10.0的硼酸盐缓冲液1ml,6%的重蒸苯酚2ml,混匀后加入naclo溶液2ml,混匀后放置4~8分钟,然后沸水浴10分钟,冰上静置20分钟,待溶液出现蓝绿色后,加入4ml60%的乙醇溶液,混匀后放置20分钟,酶标仪在640nm测定od值。 活性标准曲线的建立 采用底物l-glu与产物gaba混合配制标样。精确配制1g/lgaba和1g/ll-glu各100ml按下表混合制成标准液。按上述的方法反应后,用酶标仪在640nm处进行测定并绘制标准曲线。 标准溶液gaba和l-glu组成表 本发明具有的优势 1)自分泌无需信号肽介导。相对于常规大肠杆菌胞外分泌表达需要借助于信号肽的引导而言,本发明利用超折叠绿色荧光蛋白(sfgfp)作为融合标签,在无需信号肽介导下,借助于sfgfp自分泌实现异源蛋白在大肠杆菌中胞外分泌表达; 2)自分泌能力强。相对于常规大肠杆菌胞外分泌方法很难实现毒性蛋白、多聚体蛋白、含配体的复杂蛋白有效的胞外分泌表达而言,本发明能够实现毒性蛋白(抗菌肽,pg4)、酶(β-n-乙酰氨基葡萄糖苷酶h,endoh)、同源三聚体蛋白(人源精氨酸酶-1,arg1)和磷酸吡哆醛为配体同源六聚体蛋白(谷氨酸脱羧酶,gad)以融合蛋白的形式在大肠杆菌中胞外分泌表达,测得融合蛋白胞外分泌表达量依次为0.121mg/ml,0.471mg/ml,0.397mg/ml和0.198mg/ml; 3)对目的蛋白功能无影响。融合标签蛋白往往会影响到与其相连目的蛋白的功能,需要经过后续的酶切纯化步骤才能得到具有功能的目的蛋白,存在着操作过程复杂、目的蛋白得率低的问题。在本发明中sfgfp作为融合标签不影响异源蛋白功能,通过对融合蛋白进行功能验证,测得催化酶活分别为sfgfp-endoh(1.8×105u/ml),sfgfp-arg1(400u/mg)和sfgfp-gad(100u/mg); 4)快速优化表达条件。由于异源蛋白与sfgfp融合并不影响sfgfp发光,借助于sfgfp的这一特性,通过测量胞外分泌融合蛋白的荧光强度,快速判断融合蛋白是否表达并找到最适表达条件; 5)可实现高密度发酵。本发明采用分批补料发酵的方法,将融合蛋白sfgfp-arg1胞外分泌表达量提高到0.94mg/ml,为摇瓶培养的2.36倍,具有一定的规模化生产前景。 附图说明 图1----融合蛋白表达设计方案示意图; 图2----表达载体pet23a/sfgfp-gfp质粒构建示意图; 图3----异源蛋白重组表达载体构建示意图; 图4----表达载体pet30a/sfgfp-arg1质粒构建示意图。 图1----图4为实验设计方案及重组质粒构建方案。 其中,sfgfp--超折叠绿色荧光蛋白的英文缩写;pg4--抗菌肽pg4的英文缩写;endoh--β-n-乙酰氨基葡萄糖苷酶h的英文缩写;arg1--人源精氨酸酶-1的英文缩写;gad--谷氨酸脱羧酶的英文缩写。 图5为sds-page以及western-blot分析融合蛋白sfgfp-pg4的表达情况。 其中a:western-blot分析融合蛋白sfgfp-pg4的胞外分泌表达;b:sds-page分析融合蛋白sfgfp-pg4的在大肠杆菌细胞分布。1--融合蛋白sfgfp-pg4;2--空载质粒对照;t--全细胞蛋白质;s1--静置一天培养基上清;s2--静置两天培养基上清;s3--静置三天培养基上清;s4:静置四天培养基上清;s5--静置五天培养基上清;c-t--含有空载菌体总蛋白;c-s--含有空载菌体的培养基上清;c--大肠杆菌胞质蛋白;p--大肠杆菌周质蛋白;om--大肠杆菌外膜蛋白。 图6为sds-page分析融合蛋白sfgfp-endoh的表达情况及酶活。 其中a:sds-page分析融合蛋白sfgfp-endoh的表达情况;b:sds-page分析融合蛋白sfgfp-endoh的酶活。t--全细胞蛋白质;s--培养基上清;c--大肠杆菌胞质蛋白;p--大肠杆菌周质蛋白;om--大肠杆菌外膜蛋白;1--天然rnaseb蛋白;2--商品化endoh处理的天然rnaseb蛋白;3--稀释100倍的融合蛋白sfgfp-endoh处理的天然rnaseb蛋白;4--稀释1000倍的融合蛋白sfgfp-endoh处理的天然rnaseb蛋白;5--稀释10000倍的融合蛋白sfgfp-endoh处理的天然rnaseb蛋白;6--天然rnaseb蛋白;7--endoh处理后的天然rnaseb蛋白。 图7为融合蛋白sfgfp-arg1表达情况及多聚化分析。 其中a:sds-page分析融合蛋白sfgfp-arg1的表达情况;b:融合蛋白sfgfp-arg1多聚化分析。t--全细胞蛋白质;s--培养基上清;c--大肠杆菌胞质蛋白;p--大肠杆菌周质蛋白;om--大肠杆菌外膜蛋白。 图8为融合蛋白sfgfp-gad表达情况及活性分析。 其中a:sds-page分析融合蛋白sfgfp-gad的表达情况;b:tlc法分析融合蛋白sfgfp-gad水解产物。t--全细胞蛋白质;s--培养基上清;c--大肠杆菌胞质蛋白;p--大肠杆菌周质蛋白;om--大肠杆菌外膜蛋白;1--γ-氨基丁酸标准品;2--l-谷氨酸标准品;3--谷氨酸脱羧酶水解l-谷氨酸的产物。 图9为sds-page分析融合蛋白sfgfp-arg1发酵表达量。 1--发酵6小时纯化的培养基上清;2--发酵14小时纯化的培养基上清;3--发酵18小时纯化的培养基上清;4--发酵28小时纯化的培养基上清;5--发酵34小时纯化的培养基上清;6--发酵40小时纯化的培养基上清;7--发酵45小时纯化的培养基上清。 图10为融合蛋白sfgfp-gad发酵表征。 其中a:重组菌株菌体浓度;b:重组菌株发酵上清的荧光强度;c:重组菌株发酵上清的蛋白浓度;d:重组菌株发酵上清的酶活。 具体实施方式 下面以实例对本发明进一步说明: 实施例1: 超折叠绿色荧光蛋白(sfgfp)介导毒性蛋白(抗菌肽pg4)在大肠杆菌rosettablue中胞外分泌表达。首先,将构建好的重组质粒pet23a/sfgfp-pg4转化大肠杆菌感受态细胞rosettablue菌株,37℃静置培养过夜,获得重组菌株。其次,挑取单菌落,接种于100mllb液体培养基(氨苄青霉素的浓度为50μg/ml),37℃震荡培养,od值为0.5~0.6之间,加入iptg,终浓度为1mm,37℃震荡培养8小时。培养完成之后,12000rpm,4℃离心分别收集菌体和培养基上清。sds-page检测分析融合蛋白分泌表达情况。 实施例2: 超折叠绿色荧光蛋白(sfgfp)介导酶(β-n-乙酰氨基葡萄糖苷酶h,endoh)在大肠杆菌rosettablue中胞外分泌表达。首先,将构建好的重组质粒pet23a/sfgfp-endoh转化大肠杆菌感受态细胞rosettablue菌株,37℃静置培养过夜,获得重组菌株。其次,挑取单菌落,接种于100mllb液体培养基(氨苄青霉素的浓度为50μg/ml),37℃震荡培养,od值为0.5~0.6之间,加入iptg,终浓度为1mm,37℃震荡培养8小时。培养完成之后,12000rpm,4℃离心分别收集菌体和培养基上清。样品做如下处理:①sds-page检测分析融合蛋白分泌表达情况;②参照发明内容检测方法,测定融合蛋白sfgfp-endoh酶活。 实施例3: 超折叠绿色荧光蛋白(sfgfp)介导同源三聚体蛋白酶(人源精氨酸酶-1,arg1)在大肠杆菌rosettablue中胞外分泌表达。首先,将构建好的重组质粒pet23a/sfgfp-arg1转化大肠杆菌感受态细胞rosettablue菌株,37℃静置培养过夜,获得重组菌株。其次,挑取单菌落,接种于100mllb液体培养基(氨苄青霉素的浓度为50μg/ml),37℃震荡培养,od值为0.5~0.6之间,加入iptg,终浓度为1mm,37℃震荡培养8小时。培养完成之后,12000rpm,4℃离心分别收集菌体和培养基上清。样品做如下处理:①sds-page检测分析融合蛋白分泌表达情况;②参照发明内容检测方法,测定融合蛋白sfgfp-arg1酶活。 实施例4: 超折叠绿色荧光蛋白(sfgfp)介导含磷酸吡哆醛配体的同源六聚体蛋白酶(谷氨酸脱羧酶,gad)在大肠杆菌rosettablue中胞外分泌表达。首先,将构建好的重组质粒pet23a/sfgfp-gad转化大肠杆菌感受态细胞rosettablue菌株,37℃静置培养过夜,获得重组菌株。其次,挑取单菌落,接种于100mllb液体培养基(氨苄青霉素的浓度为50μg/ml),37℃震荡培养,od值为0.5~0.6之间,加入iptg,终浓度为1mm,37℃震荡培养8小时。培养完成之后,12000rpm,4℃离心分别收集菌体和培养基上清。样品做如下处理:①sds-page检测分析融合蛋白分泌表达情况;②参照发明内容检测方法,测定融合蛋白sfgfp-gad酶活。 实施例5: 采用分批补料发酵实现规模化生产融合蛋白sfgfp-arg1。参照发明内容步骤6的方法进行分批补料发酵。样品做如下处理:①sds-page检测分析融合蛋白胞外分泌表达情况;②用分光光度计测量菌体浓度;③用bradford法测定发酵上清中融合蛋白sfgfp-arg1的蛋白浓度;④参照发明内容检测方法,测定发酵上清中融合蛋白sfgfp-arg1的酶活;⑤荧光光度计测量发酵上清中融合蛋白sfgfp-arg1的荧光强度。 各种实例结果分析 实施案例1结果分析 如图5a所示,融合蛋白sfgfp-pg4在培养基上清中检测到胞外分泌条带(分子量大小为30.9kda),如泳道s1所示。随着在室温静置时间的延长,融合蛋白sfgfp-pg4分泌到培养基上清中的蛋白含量逐天增加,如泳道s1、s2、s3、s4和s5所示。通过bradford法测量,计算出融合蛋白sfgfp-pg4的含量最高达到0.121mg/ml(表2)。如图5b所示,融合蛋白sfgfp-pg4同时存在于大肠杆菌细胞胞质、细胞周质空间和细胞外膜,说明融合蛋白sfgfp-pg4经两次跨膜运输实现胞外分泌。 实施案例2结果分析 如图6a所示,融合蛋白sfgfp-endoh在培养基上清中检测到胞外分泌条带(分子量大小为56.79kda),如泳道s所示。通过bradford法测量,计算出融合蛋白sfgfp-endoh的含量为0.471mg/ml(表1)。融合蛋白sfgfp-endoh分布于细胞质、细胞周质、细胞外膜和培养基上清之中,说明其经两次跨膜运输分泌到培养基上清,如泳道s、泳道c、泳道p和泳道om所示。sds-page比较分析商品化的endoh和融合蛋白sfgfp-endoh的酶活,泳道2和泳道3的酶切效果相同(图6b),通过换算最终得到融合蛋白sfgfp-endoh的酶活为1.8×105u/ml。 实施案例3结果分析 如图7a所示,融合蛋白sfgfp-arg1在培养及上清中检测到胞外分泌条带(分子量大小为64.5kda),如泳道s所示。通过bradford法测量,计算出融合蛋白sfgfp-arg1的含量高达到0.397mg/ml(表2)。融合蛋白sfgfp-arg1分布于细胞质、细胞周质、细胞外膜和培养基上清之中,说明其经两次跨膜运输分泌到培养基上清,如泳道s、泳道c、泳道p和泳道om所示。通过chinard反应测定培养基上清中的融合蛋白sfgfp-arg1酶活为400u/mg(表1)。如图7b所示,培养基上清中的融合蛋白sfgfp-arg1经native-page分析显示可以形成同源三聚体(分子量大小193.5kda),与此同时分子筛检测结果同样证明了这个结论。综上所述,以单体形式表达的融合蛋白sfgfp-arg1在大肠杆菌中可以实现胞外分泌表达,分泌到胞外融合蛋白可以形成同源三聚体。 实施案例4结果分析 如图8a所示,融合蛋白sfgfp-gad在培养及上清中检测到胞外分泌条带(分子量大小为78.78kda),如泳道s所示。通过bradford法测量,计算出融合蛋白sfgfp-gad的含量高达到0.198mg/ml(表3)。融合蛋白sfgfp-endoh分布于细胞质、细胞周质、细胞外膜和培养基上清之中,说明其经两次跨膜运输分泌到培养基上清,如泳道s、泳道c、泳道p和泳道om所示。通过berthelot反应测定培养基上清中的融合蛋白sfgfp-gad酶活为100u/mg(表2)。如图8b所示,tlc结果显示融合蛋白sfgfp-gad具有催化活性,有效的将l-谷氨酸水解成γ-氨基丁酸。综上所述,以单体形式表达的融合蛋白sfgfp-gad在大肠杆菌中可以实现胞外分泌表达,分泌到胞外融合蛋白结合配体磷酸吡哆醛形成同源六聚体具有生物学功能。 实施案例5结果分析 如图9所示,融合蛋白sfgfp-arg1在发酵的过程中可以实现胞外分泌表达,随着发酵时间的延长,分泌的胞外的融合蛋白的表达量不断地增加,如泳道1、2、3、4、5、6和7所示。培养基上清中蛋白浓度随时间的变化也显示出同样结果,如图10和表3所示,培养基上清中目的融合蛋白sfgfp-arg1的含量由发酵初始的0.006mg/ml增加到0.94mg/ml,表达量提高156倍;发酵过程中菌体的浓度增加的不是很显著,由发酵初始的od600为4.95增加到od600为17.9,菌体浓度提高3.6倍;荧光强度由发酵初始12.2增加到2805.7,荧光强度提高230倍;发酵上清中的融合蛋白的酶活,由发酵初始的23.64u/mg,增加到299.25u/mg,酶活提高12.6倍。 综上所述,sfgfp介导异源蛋白在大肠杆菌rosettablue中胞外分泌分为三个步骤,首先,融合蛋白在细胞质中合成,跨过内膜异位到细胞周质;其次,细胞周质中的融合蛋白定位到细胞外膜;最后,融合蛋白从细胞外膜释放到培养基中。相对于大肠杆菌內源蛋白自分泌过程,需要信号肽的识别,需要特定的内膜转运途径的运输到细胞周质,需要特定的外膜定位途径,sfgfp介导的异源蛋白胞外分泌途径不需任何的信号肽,不需要借助任何分泌途径。相对于常规大肠杆菌胞外分泌方法很难实现毒性蛋白、多聚体蛋白、含配体的复杂蛋白有效的胞外分泌,本发明能够有效实现毒性蛋白(抗菌肽,pg4)、酶(β-n-乙酰氨基葡萄糖苷酶h,endoh)、同源三聚体蛋白(人源精氨酸酶-1,arg1)和含有磷酸吡哆醛配体同源六聚体蛋白(谷氨酸脱羧酶,gad)以融合蛋白的形式在大肠杆菌中胞外分泌表达,测得融合蛋白胞外分泌表达量依次分别为0.121mg/ml,0.471mg/ml,0.397mg/ml和0.198mg/ml。融合标签蛋白往往会影响到与其相连目的蛋白的功能,需要经过后续的酶切纯化步骤才能得到具有功能的目的蛋白,存在着操作过程复杂、目的蛋白得率低的问题。在本发明中sfgfp作为融合标签不影响异源蛋白功能,通过对融合蛋白进行功能验证,测得催化酶活分别为sfgfp-endoh(1.8×105u/ml),sfgfp-arg1(400u/mg)和sfgfp-gad(100u/mg)(见表2)。本发明采用分批补料发酵的方法,将融合蛋白sfgfp-arg1胞外分泌表达量提高到0.94mg/ml,为摇瓶培养的2.36倍(见表3),具有一定的规模化生产前景。 表2融合蛋白表达情况及酶活测定 表3融合蛋白sfgfp-arg1分批补料发酵数据 本发明中所用大肠杆菌菌株rosettablue购于美国novagen公司,dna限制性内切酶(bfuⅰ)购自fermentas公司,dna限制性内切酶(ndeⅰ和salⅰ)购自takara公司。所有引物均由上海捷瑞生物公司合成,不同的重组质粒均为本实验室构建,分析用的各种试剂为分析纯。 序列表 湖北大学一种超折叠绿色荧光蛋白介导异源蛋白在大肠杆菌中分泌表达方法 2 1239 dna 人工序列 (1)...(239) 1 mvskgeelftgvvpilveldgdvnghkfsvrgegegdatngkltlkfict50 tgklpvpwptlvttltygvqcfsrypdhmkqhdffksampegyvqertis100 fkddgtyktraevkfegdtlvnrielkgidfkedgnilghkleynfnshn150 vyitadkqkngikanfkirhnvedgsvqladhyqqntpigdgpvllpdnh200 ylstqsvlskdpnekrdhmvllefvtaagitlgmdelyk239 2 719 dna人工序列(1)...(719)2 atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggt50 cgagctggacggcgacgtaaacggccacaagttcagcgtgcgcggcgagg100 gcgagggcgatgccaccaacggcaagctgaccctgaagttcatctgcacc150 accggcaagctgcccgtgccctggcccaccctcgtgaccaccctgaccta200 cggcgtgcagtgcttcagccgctaccccgaccacatgaagcagcacgact250 tcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcagc300 ttcaaggacgacggcacctacaagacccgcgccgaggtgaagttcgaggg350 cgacaccctggtgaaccgcatcgagctgaagggcatcgacttcaaggagg400 acggcaacatcctggggcacaagctggagtacaacttcaacagccacaac450 gtctatatcaccgccgacaagcagaagaacggcatcaaggccaacttcaa500 gatccgccacaacgtggaggacggcagcgtgcagctcgccgaccactacc550 agcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccac600 tacctgagcacccagtccgtgctgagcaaagaccccaacgagaagcgcga650 tcacatggtcctgctggagttcgtgaccgccgccgggatcactctcggcat700 ggacgagctgtacaagtaa719 |
【本文地址】