经验分享:基因治疗载体的下游制造 |
您所在的位置:网站首页 › 基因捕获载体有哪些 › 经验分享:基因治疗载体的下游制造 |
经验分享:基因治疗载体的下游制造
|
AAV 纯化的另一个问题是去除没有转基因的“空”衣壳。 空衣壳的比例高达 95%,这让这一切变得更加困难。 2 目前,空衣壳在治疗中的作用尚不清楚:有报告表明,根据情况,AAV 治疗中的空衣壳可能对临床有益,也可能有害。尽管对 AAV 疗法中空衣壳的存在可能带来的好处一直存在争论,但它们仍被认为是与工艺相关的杂质,因此必须控制空衣壳的水平。 此外,部分填充的 AAV 衣壳是一个潜在的安全问题。 RV/LV 载体提出了自己独特的纯化挑战。 脂质包膜的存在使这些载体不太稳定并且对剪切更敏感。 这些颗粒的不稳定性会导致产量损失——可能高达 70%。 6 LV 的半衰期仅为 8-12 小时的情况并不少见。 因此,设计下游工艺以最大限度地减少时间,例如减少中间保持时间,是一个关键的考虑因素。 由于载体类型或上游平台和工艺的选择,可能会出现载体纯化的困难。 例如:1) 转染产生的载体上清液含有大量污染质粒 DNA ; 2) 使用悬浮细胞生物反应器会产生比固定床生物反应器更多的碎片或 ;3) 细胞内病毒产生的碎片比排泄的病毒多;4) 大型病毒,如疱疹,可能无法过滤除菌,可能需要无菌处理,以及随之而来的验证。使用补充血清的细胞培养基也会导致更大的纯化负担,并且血清粘度增加会影响下游工艺效率。 在这方面,使用无血清培养基的上游生产系统(搅拌罐生物反应器很常见)可以减轻下游的纯化负担。 另一个考虑因素是固定床生物反应器通常会产生浊度降低的输出。 这也可以减少下游负担,特别是在澄清时。 尽管载体之间的物理特性存在差异,但当前的下游方案通常具有相似的工作流程:澄清步骤(由于收获时细胞裂解,可能需要额外的深度过滤)、纯化(通常是离子交换或亲和层析),以及抛光步骤(额外的色谱步骤/尺寸排阻)(图 1)。 除上述之外,通常使用过滤、透析或 TFF 步骤来浓缩、交换缓冲液和制备最终制剂。
病毒载体的选择将对所需的纯化步骤产生影响。 例如,AAV 纯化通常涉及去除污染物的亲和层析步骤和用于分离空衣壳和完整衣壳的离子交换层析 (IEC) 步骤。 另一方面,LV 纯化主要采用一个色谱步骤,有时采用两个色谱步骤。 细胞裂解、澄清和过滤当细胞没有完全分泌载体(例如 AdV、AAV)时,通常需要细胞裂解来提高病毒产量。 裂解可以通过微流化或热休克处理通过物理破坏来进行。 或者,Triton™ X-100 等去污剂已被证明可有效裂解 AdV 和 AAV 的生产,并且也已用于昆虫细胞载体。但是,欧洲 REACH 禁用物质清单限制了烷基酚聚氧乙烯醚 (APE) 表面活性剂的使用,例如壬基酚聚氧乙烯醚 (NPE) 和辛基酚聚氧乙烯醚 (OPE),其中包括 Triton X-100,并且计划在 2021年严格限制使用。 通常可以使用 Tween™ 去污剂 开发替代去污剂裂解方法,并且有一些分析方法可用于检测载体制剂中的 Tween 20,从而提供一种方法来证明去污剂在下游加工过程中已被去除。 任何细胞裂解方法都需要优化,因为裂解高度依赖于细胞浓度、孵育时间、孵育温度、细胞类型和释放的病毒。 澄清包括最初去除细胞碎片和杂质,通常涉及深度过滤器和无菌过滤的组合。 这种方法也有助于整体生物负载控制策略。 为了提高回收率,使用 1 µm > 0.8 µm > 0.45 µm 过滤器的一些载体使用了用于澄清的直流解决方案。 15 请注意,某些病毒的无菌过滤可能具有挑战性,特别是对于大包膜病毒。 另一个关键考虑因素是,当下游收获流具有高浊度时,包含一个具有相对较大标称孔径的预过滤器,以去除较大的细胞碎片并保护后续过滤器免受堵塞和在后续纯化步骤中产生高压。 或者,切向流过滤 (TFF) 已被证明是一种有效的澄清和浓缩方法,有报告称回收率高达 90-100%,但可能需要调整流速。 由于稳定性丧失或功能丧失而导致浓缩和渗滤过程中病毒产量减少是最受关注的,尤其是对于包膜病毒,例如 RV/LV 载体。 可能需要制定策略以最大限度地减少整个纯化过程中的剪切,例如限制流速或使用单程 TFF,这是一个积极开发的领域,有可能提高产量。 该过程的持续时间始终是不稳定病毒的关注点 经典离心方法的局限性用于学术研究或小型临床研究的少量病毒的纯化传统上严重依赖于超速离心方法。 过去,CsCl 常用于 AAV 和 AdV 超速离心。 然而,碘克沙醇现在是首选,因为它更容易透析,导致更少的聚集,运行时间从 24 小时缩短到几个小时。 由于包膜病毒(如 RV/LV)的稳定性降低,因此通常使用蔗糖对这些病毒进行密度纯化。 由于体积限制、操作物流和成本,密度超速离心的限制是放大。 由于更大体积的超速离心机现已上市,因此至少可以考虑在某些规模上进行超速离心。 然而,任何好处都必须与劳动力、处理时间和资本支出的缺点以及与传染性病毒的大规模超速离心相关的健康和安全问题进行权衡。 可能需要多轮梯度超速离心以高度纯化颗粒。 超速离心已被许多公司和学术机构用于小规模生产临床材料,并且超速离心在某种程度上仍用于当前工艺中,以分离产品相关杂质(如空衣壳)和非产品杂质(如 HCP)。 超速离心可能在整个纯化方案的后期阶段有一些应用。 色谱法与经典离心相比,色谱分离是一种更通用、更强大的重组腺病毒或 AAV 大规模生产的方法 。 此外,色谱可以是去除潜在外来病毒的有效手段,因为它们可能具有与许多色谱材料上的载体不同的物理特性。 色谱法应用广泛,可应用于各种下游步骤,包括捕获、浓缩、纯化和精制步骤。 为单克隆抗体 (mAb) 和重组蛋白开发的方法已被改进用于病毒的纯化。 然而,作为 mAb 加工主链的树脂,由于介质中孔的扩散限制而在本质上处于不利地位。 孔通常非常小,以至于它们排除了病毒,限制了结合能力,并且通常需要更长的停留时间。 反过来,这意味着以较低的流速运行并增加处理时间。 此外,树脂通常需要包装和验证,这很费力。 这一弱点导致越来越多地采用不受扩散限制并且可以对流操作的色谱方法,这包括整体和膜。 整料和膜均以预包装形式提供,可能具有“即插即用”优势。 通常,整料的过程经济性更具挑战性,这促进了膜色谱的采用。 膜吸附器可轻松与其他单元操作集成,并提供高效的下游操作。 膜吸附器越来越多地用于新的灵活制造设施,其中操作速度和稳健的性能是必不可少的生产标准。 它们可以提高下游操作的生产力,在某些应用中,这可能比树脂高一个数量级。 此外,膜可以预先包装,例如 Mustang® Q Membrane(颇尔公司),并且由于它们的多层膜方法证明了可扩展性,该方法在每层深度保持恒定的厚度。 此外,约 0.8 µm 的较大孔径膜有利于病毒的纯化和 DNA 的去除。
亲和层析 (AC) 依赖于病毒颗粒与配体之间的相互作用,该配体对目标具有高亲和力,但对污染物不具有亲和力。 对于病毒载体,目前使用两种亲和方法。 肝素和亲和方法用于 AAV 纯化,主要依赖于骆驼科动物衍生的配体。 肝素亲和层析也已用于大规模纯化 LV 和其他病毒。 使用低离子强度溶液有助于保持载体完整性。 然而,可能存在非特异性结合的杂质,去除这些杂质需要额外的纯化步骤。 其他潜在的缺点是动物来源的配体和某些 AAV 血清型的首选选择性。 Cellufine™ 硫酸化纤维素 (AMSBIO) 是肝素的替代品,对各种病毒的纯化具有相似的特异性。 对于 AAV,AVB Sepharose™ 亲和树脂 (Cytiva) 利用重组蛋白配体,并且已被证明是制造商推荐的纯化 AAV 血清型 1、2、3 和 5 的有效策略。其他人已报告其成功用于其他血清型,但效率可能会有所不同。AVB 树脂已成功与 IEC 结合使用以纯化多种 AAV 血清型。 此外,POROS™ CaptureSelect™ AAVX 亲和树脂 (Thermofisher) 已开发用于广泛的血清型(AAVX 用于 1-8、AAVrh 10 和一些合成血清型)。 此外,还有专门为 AAV8 和 AAV9 开发的 Poros 树脂。 据报道,这些亲和矩阵还导致总产量 的增加 3 和商品成本的降低。 30 Genethon 报道了使用 CaptureSelect AAV9 树脂以 10L 和 50L 规模纯化 AAV9,回收率 >80%。 这些亲和树脂在易于开发 AAV 纯化方面向前迈进了一大步,但仍然存在一系列限制。 这些包括:1) 配体可能泄漏到载体制剂中,这可能需要额外的分析测试或额外的纯化步骤; 2) 空衣壳和完整衣壳之间缺乏特异性,为此需要额外的步骤,例如离子交换色谱法。 ; 3) 基于蛋白质的亲和配体不适合用 NaOH 清洗。 这限制了多次循环的色谱柱再生,并使树脂的循环成为一项挑战。 必须进行广泛的研究才能获得几个再生周期。 因此,目前基于 AAV 蛋白的亲和树脂缺乏再生,增加了它们的使用成本。 离子交换色谱离子交换色谱 (IEC) 是一种简单、通用且经济高效的技术,已成为许多载体纯化的关键步骤。 阴离子 (AEX) 或阳离子 (CEX) 交换剂可分别用于结合带正电或带负电的病毒。 IEC 可用于结合/洗脱模式(例如:病毒捕获或 HCP 去除)或流通模式(例如:DNA 去除),并且它已发现对 DNA 和 HCP 去除都具有重要作用。 IEC 还发现在单克隆工业中减少病毒方面的重要作用。 高容量、高分辨率和高耐盐性的特点使 IEC 特别适用于生物处理应用。 AEX 色谱适用于 AAV 和 LV 处理。 通常,LV 纯化依赖于单个 AEX 色谱步骤。 在这里,膜层析的一大优势是慢病毒是如此之大,以至于无法进入树脂孔。 这导致树脂的容量降低。 AEX 可以直接从澄清的粗收获物中纯化高纯度的 LV 载体,尽管在洗脱步骤中使用高离子强度溶液会降低 LV 产量。 IEC 还可用于从 AAV 制剂中分离辅助病毒,例如 AdV 和杆状病毒。IEC 也已应用于大规模生产 AAV 的捕获步骤。 该方法已用于生成 GMP AAV 载体。AEX 是少数可以将空衣壳与完整 AAV 和 AdV 衣壳分离的方法之一,因为与全长 DNA 的存在存在轻微的物理差异。一些报告显示,空衣壳的消除率超过 90%。 迄今为止,AEX 已被证明对许多 AAV 血清型有效,它可能允许分离所有 AAV 血清型的空衣壳。 AEX 也被证明是更大规模的有效方法。 然而,使用 AEX 分离空 AAV 衣壳的主要挑战是需要针对每个单独的血清型优化操作条件,有时甚至在同一血清型的不同载体之间。 可能需要大量的开发时间(长达数月)来优化实现分离所需的梯度。 任何影响载体电荷的因素,例如血清型、载体设计或转基因插入物的长度,通常都需要重新优化梯度条件。 因此,目前,基因治疗开发的主要挑战之一是优化 AAV 全衣壳富集所需的努力。 此外,对于 IEC 从具有高空衣壳负载量(即 90%)的制剂中完全去除空衣壳而言,通常存在技术挑战。 空/全 AAV 分离的最新进展包括使用 Mustang Q 膜分离空衣壳和全衣壳。 在他们正在申请专利的方法中,颇尔生物技术发现阶梯盐梯度比线性梯度提供了更大的空/全分离。 使用小型 XT Acrodisc 上的初始 ~ 1 mS 步骤来初步探测空/全衣壳的分离,并检查该过程的轮廓,如 280 nm(蛋白质)和 260 nm(核酸)吸附曲线的差异所示. 吸光度是通常用作测定空/全 AAV 衣壳相对量的少数方法之一。 然后将该过程扩展到 5 毫升胶囊,结果相同(图 2)。 此外,Pall 指出梯度可以减少到 2 步,以便在制造环境中更容易实施该过程。 因此,与 Mustang Q AEX 的合作表明,可以使用比树脂具有明显优势的格式来实现 AAV 空/全衣壳的分离。
尺寸排阻色谱 (SEC) 可用于根据尺寸和形状将病毒颗粒与污染物分离。SEC 的优点在于它对颗粒非常温和,因为它没有结合或洗脱,并且是等度进行的。 然而,SEC 可能不适合大规模加工,因为负载通常不可能大于树脂体积的 10%。 此外,生物加工中使用的 SEC 树脂是可压缩的,这限制了色谱柱尺寸和流速。 尽管如此,SEC 已发现用作许多病毒(包括 AAV 和 LV)的最终改进。 疏水相互作用色谱疏水相互作用色谱 (HIC) 多年来一直用于重组蛋白工业中的病毒捕获/清除。 在纯化方案中,HIC 已用于纯化 AdV 和 AAV2。然而,它对不同血清型 AAV 的使用尚未被广泛记录。 HIC 面临挑战。 在结合过程中使用所需的高离子强度溶液会影响某些病毒 的稳定性,因此 必须开发另一个步骤来去除高盐浓度。 通常,HIC 在当今矢量下游工艺中使用不多。 浓度/缓冲液交换通过超速离心浓缩病毒可以为某些病毒提供有效浓度和高产量。 然而,超速离心具有潜在的缺点,例如由于剪切应力 导致功能载体颗粒的损失和杂质的共浓缩 。 长时间使用低速离心是一种更温和的方法,这可能证明对稳定性较差的载体有价值,以提高感染性颗粒的回收率。如上所述,离心方法具有不切实际的可扩展性,替代方法通常用于工业生产。 切向流过滤 (TFF) 在浓缩或缓冲液交换方面具有优势,因为它通常是可扩展的,并且允许温和的处理条件,以用于不太稳定的载体。 根据截留分子量、膜的性质或过滤器表面,产品有多种配置。 虽然可达到的浓缩系数通常低于离心方法,但还有一个额外的好处,即在浓缩过程中可以去除一些杂质。 切向流过滤 (TFF)TFF 技术可用于整个下游过程的多个地方。 分离主要基于尺寸,尽管其他分子特性(如表面电荷和疏水性)也发挥了一些作用。 在某些应用(例如连续收获)中,过滤器的孔径允许产品通过并保留较大的杂质(例如完整的细胞、细胞碎片)。 在其他应用中(例如,在色谱上游浓缩池以限制加载时间,或将纯化池加工成最终配方),产品被保留在过滤器的上游侧,而较小的杂质和缓冲液成分则被过滤掉。 切向流过滤是一种从重组蛋白行业很好地转移过来的技术。 与离心等替代技术相比,它显示出良好的可扩展性、工艺经济性、工艺稳健性,并且在许多情况下可以提供接近或高于 90% 的产率。 数十年的先验知识也有助于有效的工艺开发、工艺表征、放大和技术转让。 一般来说,TFF 过滤器有两种主要形式:平板盒和中空纤维模块。 这两种格式都广泛用于基因治疗应用。 平板盒的一个优点是它们倾向于提供比中空纤维模块更高的通量。 平板 TFF 还提供了一种“模块化”方法,通过在过滤器支架中简单地“堆叠”更多的滤盒,可以增加更多的过滤面积。 中空纤维 TFF 被认为比平板盒具有更低的剪切力,这是脆弱生物分子下游加工的一个重要考虑因素。 慢病毒特别容易受到剪切损伤。 大多数 TFF 膜具有腐蚀性,可以在封闭、无菌的过程中运行——这是基因治疗制造的一个关键考虑因素。 市场上有几种较新的 TFF 产品,包括平板和中空纤维形式,提供无菌声明,在某些情况下可以通过无菌连接器连接到系统中。 这可以提供相同的封闭处理优势,同时减少所需的冲洗,从而减少操作员的时间和占地面积。 最后,由于与 mAb 和许多重组蛋白相比,基因治疗产品通常对剪切和时间等环境条件更敏感,因此该行业可能会继续研究单程 TFF 技术。 市场上有用于单程浓缩和渗滤的产品,例如 Cadence™ 在线浓缩器和在线渗滤模块(颇尔公司)。 这些技术可以通过限制泵程来降低剪切,并通过连续组合单元操作来减少处理时间。 生物负载控制整个制造过程中的生物负载控制是 GMP 合规性的关键部分,可最大限度地降低最终产品的微生物污染风险。 在大多数过程中,最终的载体制剂通过一个或多个 0.2 µm 灭菌级过滤器作为控制组件进行过滤,尽管其在下游协议中的位置可能会有所不同。由于病毒的大小,一些载体产品不能在 0.2 µm 过滤除菌。 如果该过程可以被证明是完全无菌的,则可以跳过无菌过滤; 然而,这需要封闭过程的操作,并且必须在洁净室中进行操作。TFF 系统可以提供更高的灭菌吞吐量,并在这方面具有优势。 然而,对于一些不稳定的病毒,无菌过滤目前可能是一个巨大的挑战,因为它们可能会失去功能。 对下游工艺问题的洞察将下游工艺转移到临床和商业制造 将载体从学术界的开发环境转移到临床使用的制造,为下游生产开发提出了几个考虑因素。 通常,学术界和临床生产的目标和因此选择的工具和技术是不同的。 包括操作一致性和生物负载控制在内的领域通常不集中在大多数研究生产中,但在临床制造中至关重要。 因此,有几个领域需要进一步检查和可能的替代解决方案。 可扩展性 从研究生产转移的主要考虑因素之一是如何实现生产规模的增加。 在更大规模的情况下,纯化方法需要以高效率和速度适应大体积。 实现更大规模的一种方法是从可扩展性差的基于离心的技术转向具有更高吞吐量的系统,例如过滤。 另一种方法是使用色谱方法,因为它们被认为是制造应用的最佳技术方法之一。 IEC 或 AC 方法的可扩展性可以提供许多载体的有效纯化。在考虑单独的色谱方法时,效率是一个重要方面,因为它可以带来更小、更简单的过程和更大的规模。 已经表明,VSG-g LV 载体可以使用 Mustang Q 膜(颇尔公司)纯化至 1,500 L/天的体积并产生高纯度的载体制剂; 相比之下,由于这些载体的脆弱性,LV 恢复可能不如超速离心有效。 GMP合规性 研究材料不需要符合 GMP,因此这是将产品转移到临床制造时的重大变化。 用于治疗的载体必须符合严格的纯度和安全标准,产品质量至关重要。 向 GMP 的过渡需要检查包括原材料和试剂在内的现有工艺。 合理设计下游流程以简化和提高效率,可以减少所需的GMP试剂和步骤数量,从而提高质量、安全性并显着降低成本。 外源剂控制是 GMP 制造的一个方面,一旦工艺进入临床生产,就重点关注。 由于产品也是病毒,因此外源病毒控制可能特别具有挑战性。 使用无菌过滤可能会引起关注,因为许多病毒不稳定或由于病毒大小而难以过滤。 过滤过程中的产量损失仍然是包括 LV 在内的许多载体的重大挑战。 开发替代的药剂控制方法,例如色谱方法,将使该行业受益。 工艺开发时间表 开发下游工艺的时间表取决于许多因素,例如载体类型、预期用途、规模、成本考虑和可用技术。 与所涉及的因素无关,缩短开发时间是一个理想的目标,因为它可以加快上市时间并降低成本。 请注意,下游过程的科学工作所需的时间可能很长,几个月,具体取决于可用资源,因为目前市场上很少有“类似平台”或“即插即用”的解决方案。 然而,已经取得了有益的进步,例如特定于矢量的交流解决方案的兴起。 对于 AAV 开发,空/全衣壳分离过程需要很长时间。 它也可能很昂贵,因为它可以大规模消耗大量原料。
成本考虑 成本是许多因素的组合,例如时间、劳动力、运营费用和资本费用。 下游加工中使用的技术会影响工艺开发的时间表、产品质量、工艺放大的难易程度和商品成本 (COG)。用更具成本效益的方法(例如色谱法)取代耗时、复杂且效率低下的传统学术方法,可以通过权衡所需的重新开发时间来降低成本。 实施具有更大吞吐量和放大潜力的更新策略,例如 IEC 或 AC,可以显着简化流程策略并提高效率。 这些纯化方案显着缩短了工艺开发时间并减少了 COG。 在这方面,更新的亲和层析方法,如果适用于特定载体,可以潜在地将过程架构简化为单个层析捕获步骤,仅伴随一个澄清步骤和一个精制步骤(AAV 需要额外的空/全分离步骤) . 使用纯化和精制色谱系统可以获得高纯度和许多载体。 开发和使用(半)连续工艺等技术可以减少占地面积、提高生产力、自动化、减少库存和存储以及减少单元操作——所有这些都可以降低成本。其他降低成本的策略包括通过使用多柱系统或一次性系统 使用色谱柱来减少色谱单元操作以及使用昂贵树脂循环 。 另一个考虑是为下游实施可扩展的解决方案,例如深度过滤、色谱等。 使用可在制造中扩大规模的切向流过滤 (TFF) 可以节省成本。 在这方面,自动化 TFF 系统可用于控制跨膜压力和浓度水平。 此外,TFF 的自动化可以为操作员提供符合人体工程学的安全环境,并促进过程的速度和规模化。 使用这些系统通常可以轻松实现 20-80 倍的浓度系数。 风险评估 另一个重要的考虑因素是对载体风险的整体评估(风险评估)和上游和下游过程的后续设计,以利用可用技术将风险降至最低。 例如,基因毒性和免疫毒性是两个理论上的风险,这取决于用于产生载体的细胞是人源还是非人源。 对于 AAV,空衣壳、衣壳化宿主细胞 DNA、衣壳化辅助成分 DNA、有复制能力的病毒、非传染性载体以及聚集、降解或氧化载体都被认为是潜在风险。 因此,应根据临床制造所需的监管标准和患者安全考虑进行总体风险评估,然后进行缓解设计。 下游工艺挑战产能 产量是下游的一个重要问题,因为病毒产量的损失给上游工艺增加了增加产量和规模的压力。 对于某些载体(如 LV 和其他包膜病毒)来说,病毒的不稳定性和功能丧失可能是一个巨大的问题。 减少步骤数和处理时间以及减少剪切力可以提高不稳定载体的总产量。 过程中间体的储存以及感染性如何受保持条件(温度、pH 值等)的影响也会影响产量。 因此,开发不稳定病毒的快速工艺的需要是工艺设计中的一个关键考虑因素。 纯度 下游的另一个主要挑战是在不损失功能的情况下获得足够的纯度。 例如,在 AAV 载体的典型生产中,需要考虑许多杂质,包括宿主 DNA/RNA、宿主细胞蛋白 (HCP)、质粒 DNA、辅助病毒、培养基成分、纯化过程中引入的物品(缓冲液、配体、盐等)、空的和部分完整的衣壳、有复制能力的 AAV、非感染性 AAV 和其他 AAV 形式,如聚集体。更复杂的是,残留的 DNA 或宿主细胞蛋白可以粘附在某些载体上并与它们共同纯化。 因此,去除杂质至关重要,因为纯度不足会影响产品质量和安全性,并最终会导致监管机构的负面结果。 特别是,人们担心可能的免疫原性和毒性。 此外,该过程必须满足支原体、外来病原体、微生物稳定性等方面的监管规范。 整体工艺设计和效率是控制杂质的关键。 除非必要,否则必须努力避免在下游过程中引入污染物。 任何污染物的引入都需要额外的分析和处理步骤来去除它们。 Benzonase 处理可用于去除残留的 DNA,但是,它的使用会增加成本。 如果载体病毒是无包膜的,则可以使用去污剂来控制包膜病毒。 同样,任何添加到过程中的东西都必须从最终配方中删除。 对于 AAV,空/全衣壳分离的工艺开发时间可能长达数月。 空/全分离没有“平台”,IEC 的空/全分离参数必须为每个载体仔细开发。 此外,一些 AAV 载体制剂可以进入下游,其中含有多达 90% 的空衣壳,而开发去除大量空衣壳的工艺可能需要大量的时间和资源。 从上游优化原料是有帮助的,以便它包含尽可能多的完整衣壳。 了解和定义空衣壳和部分满衣壳所需的排除水平有助于开发符合监管要求的工艺。 进步领域亲和层析 AC 显示出巨大的前景,因为它是有效的,并且它的使用可能会通过切换 AC 列在下游部分实现类似平台的方法。 AC 介质在其他病毒和血清型上的进步将是该行业的进步。 树脂可能很昂贵,并且当前基于蛋白质的 AAV 树脂无法通过多次循环再生而无需更换。 或许,在未来,可以开发出树脂来克服再生问题,并以更低的价格提供。 自动化和封闭系统 多个领域需要自动化以减少劳动力和成本。 较大的载体需要封闭系统,其中过滤灭菌是一个问题。 封闭系统还可以保护产品和操作员,并且可以通过多种措施获得很大好处。 在这方面,需要更多地开发类似于那些使重组蛋白行业受益的工艺,例如一次性技术和连续加工方法。 转向更有效的方法 继续从超速离心等旧方法转向色谱等更有效的工艺将使该行业受益。 尽管如此,该行业仍在进行大量超速离心,这表明该领域仍需取得进展。 传统层析树脂的替代品显示出提高效率和规模的巨大希望。 此外,某些特定树脂和过滤器的成本非常昂贵,尤其是在规模较大的情况下。 当色谱材料装入高效、一次性使用的色谱柱时,可以进一步提高处理量,并可以实现基础设施、操作和质量程序的大量节省。 分析 在分析方面,为病毒浓度较低的中间原油开发更好或更快的在线或在线分析将通过提高流程效率和降低成本使行业受益。 由于分析可能非常不精确并且可能需要很长时间才能执行,因此下游处理通常是“盲目的”。 高吞吐量分析可以通过更全面地了解流程并确定需要改进的领域来缩短流程开发时间。 例如,AAV 的分析超速离心虽然效果好,但成本高昂且耗时,但与毛细管电泳一起,它是少数可以分离空衣壳和完整衣壳并具有良好分辨率的方法之一。 有时可以在线使用替代分析,例如 HPLC 或透射电子显微镜 (TEM),以降低成本或提高吞吐量。 病毒专用工具的开发 目前在下游生产中使用的许多工具和技术已开发用于小分子和抗体,而不是病毒。 例如,一些树脂被开发用于从含有 5 g/L 抗体的原料中纯化单克隆抗体。 病毒载体更大、更复杂,并且在原料中的浓度比抗体低 1000 倍。 对于病毒,色谱柱功能、捕获能力和恢复能力比使用单克隆抗体更为重要。 需求不一样。 与抗体相比,其他大规模使用的项目,例如浓度和膜过滤器的使用,对于病毒来说可能完全不同。 例如,2000L 病毒与 2000L 抗体的浓度非常不同,可用系统的物理重新设计可能会有所帮助。 还需要缩小规模的工具,因为许多一次性平台被设计用于 100 克抗体,而小规模的病毒小于 1 g。 因此,小规模和大规模处理都需要增加病毒特异性工具。 概括总之,处理和获得高滴度和高质量批次病毒载体的选择范围越来越广。 我们期待持续进步,未来会出现新的创新和功能,这些创新和功能应该会降低复杂性、减少挑战并降低成本。 在许多方面,该行业正在采取与几年前单克隆抗体行业类似的道路,并具有广泛的增长和制造能力。 参考出处: https://downstreamcolumn.com/返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |
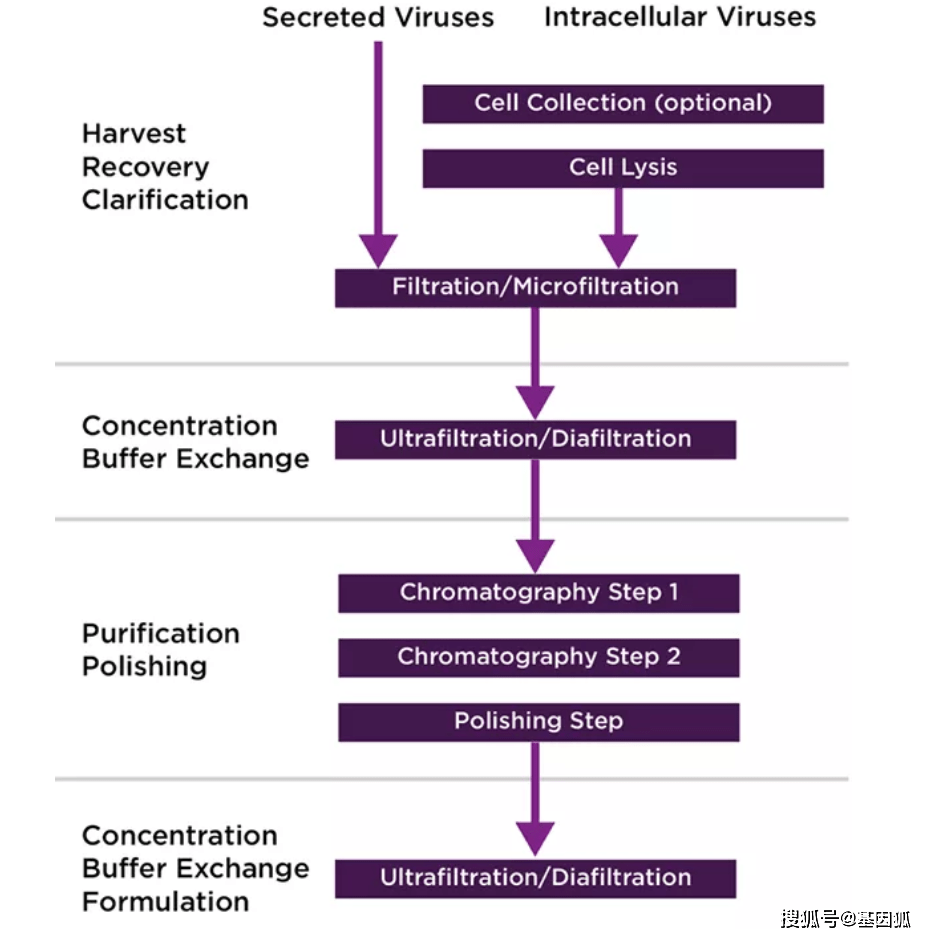 图 1. 分泌型病毒(逆转录病毒/慢病毒)和细胞裂解释放的病毒(AAV/腺病毒)的下游过程示例。
图 1. 分泌型病毒(逆转录病毒/慢病毒)和细胞裂解释放的病毒(AAV/腺病毒)的下游过程示例。 Mustang® XT
Mustang® XT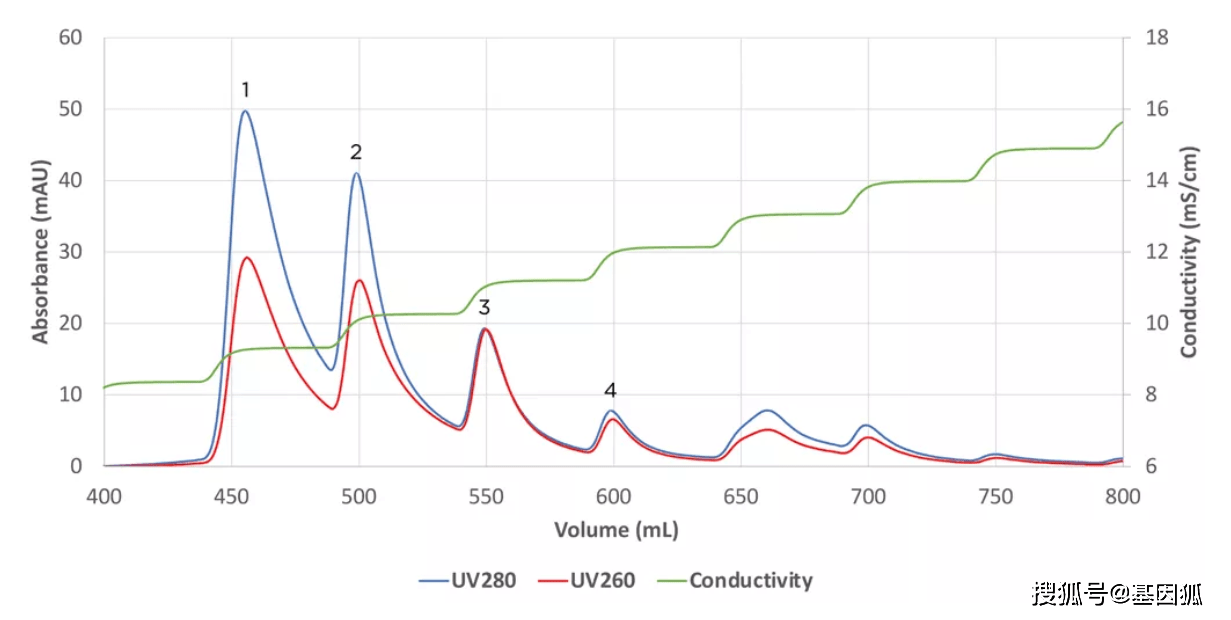 图 2.Mustang Q XT5 上 AAV5 的分离
图 2.Mustang Q XT5 上 AAV5 的分离