计算模拟揭示酶催化选择性的动态学起源 |
您所在的位置:网站首页 › 反应选择性计算 › 计算模拟揭示酶催化选择性的动态学起源 |
计算模拟揭示酶催化选择性的动态学起源
|
计算模拟揭示酶催化选择性的动态学起源
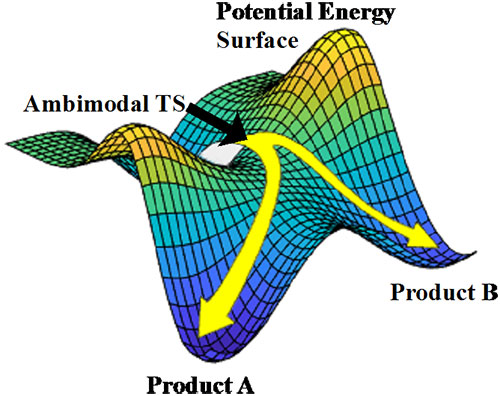
酶不仅在自然界的各种生命过程中都扮演着重要的角色,作为已知最高效的催化剂,酶在精细化工、新药研发、能源石油和环境催化等领域也发挥着至关重要的作用。酶促反应的机制研究一直是化学与生物学中的核心问题。基于经典力学和量子理论的计算模拟可以极大弥补实验手段的限制,为从原子层面理解酶促反应机理提供结构和能量等关键信息。 酶促反应机理的复杂性之一来源于酶本身的多尺度特性。酶折叠发生于微秒到毫秒之间(10-6-10-3秒),局域的alpha-螺旋或beta-折叠等结构单元的运动存在于纳秒级(10-9 秒),而氨基酸残基的运动以及化学键的振动则发生于飞秒到皮秒(10-15-10-12 秒)层面。如果把蛋白比喻成一个人,那么蛋白折叠可以理解为人的坐卧,局域结构单元运动可以理解为抬胳膊踢腿,而氨基酸残基运动更像是抖动。在酶促反应中,纳秒尺度及以上的构象变化一直被认为对化学反应性和选择性有极大的干扰。而酶的氨基酸在亚皮秒层面的运动(以下称“超快运动”)是否左右化学反应,却一直是学界争论的焦点。值得一提的是,在分子反应动态学领域,超快运动对化学反应的影响早已被广泛研究,并被定义为“非统计效应”(non-statistical effects)或“动态学效应”(dynamical effects)。 来自加州大学洛杉矶分校的Kendall N. Houk(点击查看介绍)团队,近年来一直致力于研究有机化学反应在单分子层面与飞秒尺度上的动态学机理。在前期工作中,Houk团队与Singleton团队(TAMU)以及Hung-wen Liu团队(UT Austin)合作,发表了第一个单功能Diels-Alder酶SpnF在气相条件下的催化反应机理(J. Am. Chem. Soc., 2016, 138, 3631-3634)。这项研究意外发现反应中存在一个分叉过渡态(ambimodal transition state),即通过同一个过渡态可以生成不同的[4+2]产物和[6+4]产物,分布比例为2.5:1。这种现象虽然听上去复杂,但如果我们用山来比喻反应的话则不难理解。大多数反应都是由过渡态连接一个反应物与一个产物,如同上下山都是一条路。而分叉反应更像是一条路上山,而下山的时候却一条分成两股,导向不同的产物。有趣的是,这样得到的两种产物虽然经过了同一个能垒,但依然会有选择性。这种选择性来源于分叉口附近反应分子的碰撞,与分叉后两条路坡度的差异。不同于经典化学理论中的热力学(thermodynamics)控制与动力学(kinetics)控制,这种选择性发生于亚皮秒的时间尺度上,被称为动态学(dynamics)控制。
图1. 分叉过渡态与势能面。两种产物A与B的分布比例由动态学控制决定。 为了研究SpnF酶和水溶液对分叉反应的影响,Houk团队发展了新的凝聚相反应动力学方案,一种基于环境微扰的过渡态采样方法(Environment-Perturbed Transition State Sampling method, EPTSS)。这套方案准确的重复出了实验上跨环Diels-Alder反应在水溶液与SpnF酶中的自由能垒和动力学同位素效应。研究人员发现底物的过渡态在水和酶介质中采取了不同的优势构象,并分别将其命名为DA过渡态和分叉过渡态。研究结果表明水溶液中反应采取DA过渡态,而酶SpnF中采取分叉过渡态。这些差异主要取决于环境的差别导致的分子内氢键的成断。为了回答“酶是否能在亚皮秒时间尺度上影响催化反应选择性”这一问题,研究人员针对分叉过渡态(TS-B)对比了水与酶环境对 [4+2]/[6+4]产物比率的影响。发现了在水中的比率为1.6:1.0,而在SpnF酶中为11:1。这项研究揭示了酶在亚皮秒时间尺度上对反应选择性产生的巨大影响。
图2. 反应在水溶液与SpnF酶中模拟得到的特征轨线。其中(a)与(b)为反应在水溶液相中经过同一个过渡态得到[4+2]与[6+4]产物,而(c)与(d)分别为反应在SpnF酶中经过同一个过渡态得到[4+2]与[6+4]产物。 该研究的共同第一作者为加州大学洛杉矶分校的杨中悦博士、杨松、余沛源博士以及山东大学访问学者李延伟博士。 该论文作者为:Zhongyue Yang, Song Yang, Peiyuan Yu, Yanwei Li, Charles Doubleday, Jiyong Park, Ashay Patel, Byung-sun Jeon, William K. Russell, Hung-wen Liu, David H. Russell, Kendall N. Houk 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Influence of water and enzyme SpnF on the dynamics and energetics of the ambimodal [6+4]/[4+2] cycloaddition PNAS, 2018, DOI: 10.1073/pnas.1719368115 导师介绍 Kendall N. Houk http://www.x-mol.com/university/faculty/843 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】