基因过表达构建实验 |
您所在的位置:网站首页 › 南京中山陵有缆车上山吗多少钱 › 基因过表达构建实验 |
基因过表达构建实验
|
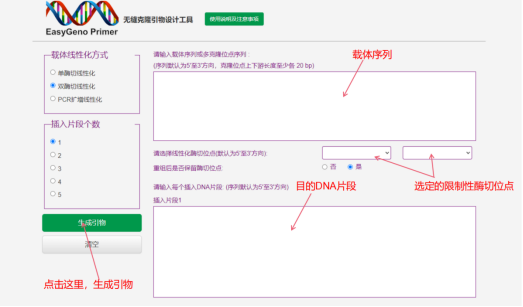
简介 过表达载体是将目的基因 CDS 编码区构建到相应的质粒或者病毒载体中,从而在宿主细胞中高效表达大量目的蛋白的质粒载体。过表达载体有多种构建方法,这里介绍一种常见方法——同源重组法。 原理 使用两端带限制性内切酶位点的 PCR 引物扩增目标 DNA 片段,同时用对应限制性内切酶切割质粒载体,再使用同源重组酶连接载体与扩增后的 DNA 片段。 用途 基因功能研究、大量目的蛋白制备。 材料与仪器 目的 DNA 片段、引物、高保真酶 限制性核酸内切酶、过表达载体 胶回收试剂盒、同源重组酶、感受态细胞 LB 培养基、质粒提取试剂盒、移液枪 PCR 仪器等 步骤 1、双酶切质粒载体:在过表达载体上选择两个限制性酶切位点,使用对应的限制性内切酶双酶切质粒载体;例如酶切反应均使用 Fermantas 公司生产的 EcoRI 内切酶(快切酶)和 XbaI 内切酶(快切酶),buffer 采用的是 FD Green Buffer(绿色)。 PCR 回收产物的酶切采用 20 ul 体系,具体反应如下: PCR 回收产物 16 ulXbaI 1 ulEcoRI 1 ulFD Green Buffer 2 ul 37 ℃ 烘箱反应 30 min。 2、琼脂糖凝胶电泳法回收切割后的线性载体,胶回收方法请参照试剂盒说明书严格操作。 3、目的 DNA 片段两端加上限制性内切酶位点:根据目的 DNA 序列以及选定的两个限制性内切酶位点设计引物,以目的 DNA 片段为模板,使用设计好的引物及高保真酶进行 PCR 扩增反应。对 PCR 反应产物进行琼脂糖凝胶电泳法回收。引物设计方法见下图,引物设计网址(http://123.56.75.195/)。
4、目的 DNA 片段连接到载体的两个酶切位点之间: 将上述线性化载体与 PCR 扩增后的目的片段按照一定比例混合,在一定的温度以及同源重组酶的催化下,即可将目的片段插入至载体中(具体混合比例,以及反应温度和时间可参考所使用的同源重组酶使用说明书)。 以下例子可做参考(ClonExpress Ultra One Step Cloning Kit): 对于单片段同源重组反应: 最适克隆载体使用量 = [0.02 × 克隆载体碱基对数] ng(0.03 pmol) 最适插入片段使用量 = [0.04 × 插入片段碱基对数] ng(0.06 pmol) 例如,将长度为 2 kb 的插入片段克隆至长度为 5 kb 的克隆载体时,克隆载体的最适使用量为:0.02 × 5,000 = 100 ng;插入片段最适使用量为:0.04 × 2,000 = 80 ng。 5、大肠杆菌 DH5α 感受态细胞的转化:(1) 取 50 µl 冰浴上融化的大肠杆菌 DH5α 感受态细胞,加入克隆载体连接反应后的混合液体,轻柔混匀,在冰浴中放置 30 min。 (2) 42 ℃ 水浴热激 80 s,然后快速将大肠杆菌转移到冰浴中 2 min,该过程切忌晃动离心管。 (3) 向每个离心管中加入 250 µl 无菌不含抗生素的 LB 液体培养基,混匀后置于 37 ℃,200 rpm 培养 1 小时,使大肠杆菌复苏。 (4) 吸取 150 µl 的已转化的感受态细胞涂布于含卡那霉素的 LB 固体琼脂培养基上,将细胞均匀涂开。 (5) 将平板置于 37 ℃ 至液体被吸收,倒置平板,37 ℃ 过夜培养。 (6) 挑取单克隆,在 1.5 ml 离心管中加入卡那抗生素的 LB 液体培养基 800 µl,置于 37 ℃,200 rpm 培养 6 小时。然后进行菌液 PCR 检测。 (7) 菌液 PCR 检测阳性的菌液可送至测序公司进行双向测序,若测序结果可与所构建的载体序列比对一致,说明过表达载体构建成功。 (8) 可将载体构建成功的菌液继续培养,然后使用质粒提取试剂盒进行质粒提取。提取的质粒载体可用于下游实验。 注意事项 1. 选取的两个限制性酶切位点不能也存在于目的基因的 CDS 序列中。 2. 设计带有内切酶位点的引物时,输入的载体序列、插入片段序列以及选择的两个酶切位点先后顺序,一定都是按照 DNA 正义链的 5』至 3』方向。 3. 同源重组是一种高效的无缝克隆技术,使用同源重组反应体系时,应严格按照载体长度和插入片段长度去计算两者用量,以提高同源重组效率。 4. 感受态细胞转化的整个操作均需在冰上进行,但当加入的外源 DNA 的量过多或体积过大时,DNA 溶液的体积不应超过感受态细胞体积的 10%,并且使用的试剂和试剂管均需灭菌。 常见问题 1. 如何判断是否双酶切成功?取少量酶切后的质粒载体,跑琼脂糖凝胶电泳。观察条带,若酶切后的质粒载体两条条带,且符合酶切后线性载体大小,则表示酶切成功。 2. 菌液 PCR 检测无条带?有可能是菌液浓度过低,建议菌液摇至明显浑浊再进行菌液 PCR 检测。也有可能引物使用错误,建议排查引物。另外也存在假阳性的可能,建议多挑几个菌落进行培养检测。 3. 胶回收的线性载体浓度低?建议多做几个反应体系,并且多管反应液混合至一孔跑胶、回收。 来源:丁香实验 |
【本文地址】
今日新闻 |
推荐新闻 |