罗氏148条管线全解析!数个产品接力“三驾马车”,超30亿美元加注细胞疗法,5年前已布局m... 2020年、2021年,连续两年,罗氏位居 全球制药 企业50强榜首。根据Evaluate 数据显示,过去5年,罗氏推出... |
您所在的位置:网站首页 › 单抗cd25 › 罗氏148条管线全解析!数个产品接力“三驾马车”,超30亿美元加注细胞疗法,5年前已布局m... 2020年、2021年,连续两年,罗氏位居 全球制药 企业50强榜首。根据Evaluate 数据显示,过去5年,罗氏推出... |
罗氏148条管线全解析!数个产品接力“三驾马车”,超30亿美元加注细胞疗法,5年前已布局m... 2020年、2021年,连续两年,罗氏位居 全球制药 企业50强榜首。根据Evaluate 数据显示,过去5年,罗氏推出...
|
来源:雪球App,作者: E药经理人,(https://xueqiu.com/3483303916/198292584)
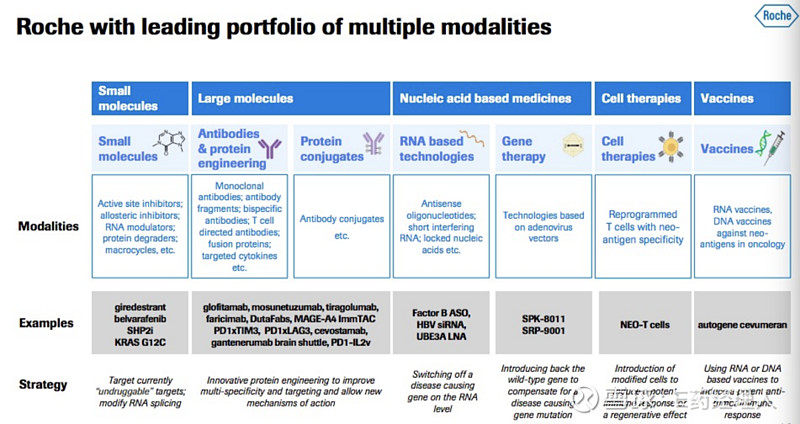
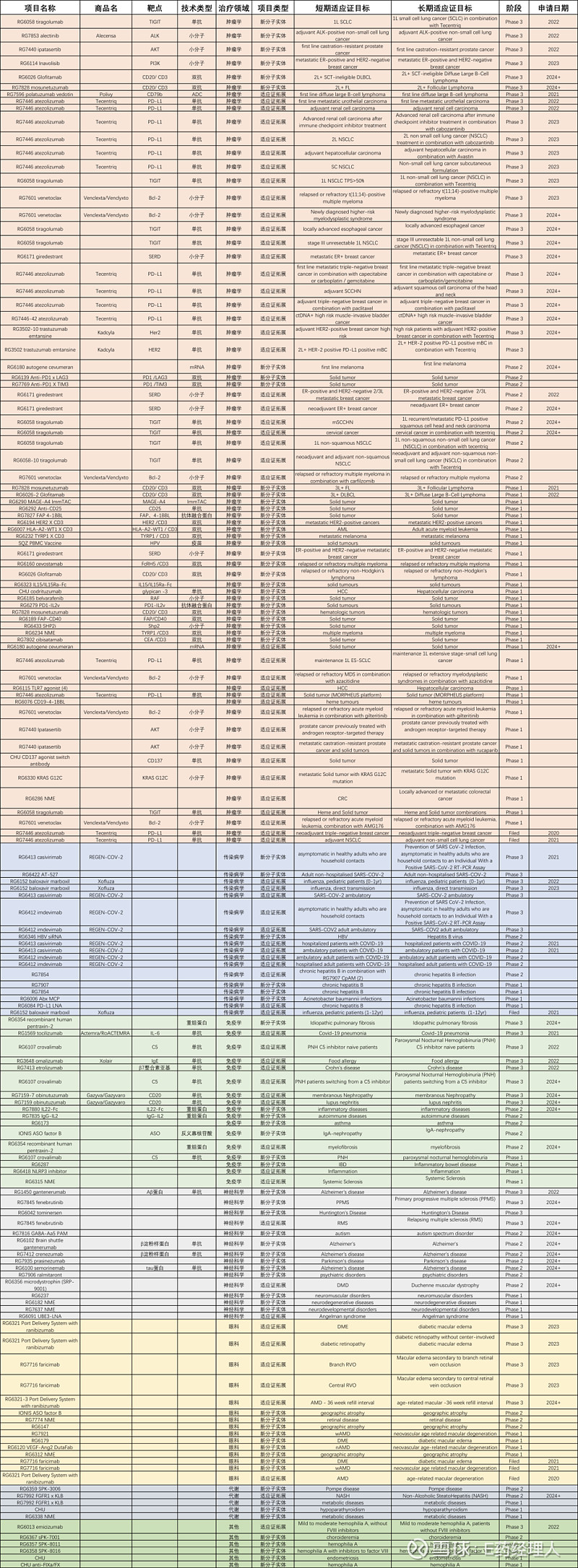
2020年、2021年,连续两年,罗氏位居全球制药企业50强榜首。根据Evaluate 数据显示,过去5年,罗氏推出了8 款新药,销售额高达997.8亿美元,同样是全球药企中的第一名。 而未来,罗氏又将如何延续辉煌?哪些领域、哪些技术是罗氏的布局重点?哪些产品又将展露锋芒,接替成为“重磅炸弹”?答案或许就在罗氏的管线中。 从罗氏官网公布的148条管线来看,肿瘤学、传染病学、免疫学、神经科学、眼科和代谢是其布局的6大领域。 01 肿瘤领域:半壁江山 肿瘤学领域是罗氏布局的重中之重,有72条管线,占据着其管线的半壁江山。而创新也是罗氏的关键词,在其72条管线中,有30条是新分子实体,剩下42条为适应证拓展。其中,进入III期、II期和I期临床阶段的新分子实体管线分别有6条、3条和21条。也就是说,罗氏在肿瘤领域有70%的新产品管线处于I期临床阶段。 对于肿瘤治疗,罗氏也使用了多种技术平台,包括小分子、单抗、双抗、融合蛋白、ADC、RNA、细胞与基因疗法、疫苗等。
罗氏在肿瘤领域的小分子管线有18条,涉及8款产品。其中,上市产品2款,在研产品6款。 上市产品分别为Venclexta/Venclyxto和Alecensa®。 Venclexta®/Venclyxto®(RG7601,维奈妥拉 /维奈托克)是一款首创、口服、选择性小分子B细胞淋巴瘤因子-2(BCL-2)抑制剂,由罗氏与艾伯维合作开发。Bcl-2家族蛋白在许多肿瘤中都有高水平表达,在调节细胞凋亡中发挥核心作用,而阻断Bcl-2家族蛋白的功能可以恢复肿瘤细胞凋亡。因此,Bcl-2家族蛋白被认为会影响肿瘤的形成、生长和耐药性。2016年4月,FDA批准Venclexta®用于治疗复发或难治性淋巴细胞白血病 (CLL) 患者。目前,罗氏针对Venclexta®开展了6条新管线,其中一项评估治疗复发或难治性阳性多发性骨髓瘤疗效临床试验已进入III期临床试验。 Alecensa® (Alectinib,RG7853,艾乐替尼)是一款选择性靶向ALK(间变性淋巴瘤激酶)的小分子抑制剂,可抑制肿瘤的生长和疾病进程。该药由罗氏和日本中外制药共同研发,罗氏为日本中外制药大股东。2017年11月,FDA批准Alecensa®上市,用于治疗间变性淋巴瘤激酶 (ALK) 阳性转移性非小细胞肺癌 (NSCLC)患者。目前,罗氏正在进行评估Alecensa对辅助治疗ALK阳性非小细胞肺癌疗效的III期临床试验。 而6款在研产品中,Giredestrant、Belvarafenib、SHP2i、KRAS G12C这4款产品是罗氏的“主打产品”。 Giredestrant(RG6171)是一款可口服的选择性雌激素受体(SERD)降解剂,具有潜在的抗肿瘤活性。口服给药后,Giredestrant特异性靶向并结合雌激素受体 (ER) 并诱导构象变化,促进雌激素受体降解,从而阻止雌激素受体介导的信号传导并抑制表达雌激素受体的癌细胞的生长和存活。该产品由基因泰克开发,目前开展的管线有4条,其中针对ER阳性和HER2阴性的转移性乳腺癌治疗I期临床试验正在进行,预计2020年将进入II期临床试验阶段。 Belvarafenib (RG6185) 是一款选择性口服小分子泛RAF激酶抑制剂,由Hanmi Pharmaceuticals 和基因泰克共同开发,用于治疗实体瘤和恶性黑色素瘤。目前正在进行针对恶性黑色素瘤治疗的I期临床试验。 SHP2i(RG6433)是罗氏进入KRAS靶点药物赛道的“号角”。研究表明,致癌的KRAS基因突变除了直接促进肿瘤细胞的增殖和生存以外,还能够对肿瘤微环境产生影响,促进肿瘤恶性发展。 由于KRAS靶点的“不可成药”性,通过靶向调节KRAS活性的蛋白成为间接靶向KRAS的一个研究方向。而SHP2酶被认为在KRAS靶点的“开”和“关”之间具有重要作用,抑制SHP2活性可以增强对携带KRAS基因突变肿瘤细胞的杀伤效果。 2015年5月,FDA批准罗氏公司的KRAS突变检测方法可以用于转移的结肠癌的诊断。目前,诺华和Revolution Medicines公司都有SHP2抑制剂处于临床开发阶段,默沙东、BMS等跨国药企同样参与到了这场战争中。罗氏也在2020年年初将SHP2i(RG6433)推进了I期临床阶段,预计2022年完成该试验。 针对KRAS G12C靶点的RG6330是罗氏针对KRAS靶点药物赛道的另一步棋。同时也可以看出,罗氏对于该赛道的关注。RG6330是一款KRAS G12C抑制剂,同样是针对KRAS靶点“不可成药”性找到的“桥梁”。目前,罗氏正在进行针对KRAS G12C突变的转移性实体瘤治疗的I期临床试验。 单抗技术平台目前依然是罗氏研发抗癌药物的主要工具。在罗氏管线中,单抗药物管线以28条数量“一骑绝尘”,远超过其他技术平台研发数量。单抗药物中涉及到PD-L1、TIGIT、HER2、CD25、glypican -3、CD137等靶点。其中,涉及PD-L1 靶点的管线有14条,涉及TIGIT靶点的有9条。 罗氏针对PD-L1 靶点的布局主要围绕已上市的Tecentriq®(atezolizumab,阿替利珠单抗)适应证的拓展。而TIGIT 靶点主要围绕在研药物Tiragolumab(RG6058)的新药上市和适应证拓展。 TIGIT靶点作为全球目前还没有新药上市且具有广泛治疗潜力的靶点,一直是全球生物制药公司布局的重点。今年1月,罗氏宣布Tiragolumab获得了FDA授予的突破性疗法称号,与 Tecentriq®联合用于一线治疗转移性非小细胞肺癌(NSCLC)患者。这也是全球第一个获得FDA授予突破性疗法称号的抗TIGIT单抗。目前同处于III期临床阶段的还有默沙东的Vibostolimab(MK-7684; MK-7684A)和百济神州的Ociperlimab(BGB-A1217)等同类产品。 CD25是罗氏布局的另一重点靶点。RG6292一款靶向CD25 (IL-2Rα)的选择性Treg(调节性T细胞)耗竭剂,通过选择性消耗抗癌免疫反应中的主要抑制因子Treg,同时保留正常免疫细胞IL-2 信号传导和 CTL活性以控制肿瘤生长。目前,罗氏正在进行评估RG6292作为单药治疗和联合atezolizumab治疗实体瘤效果的I期临床试验。 双抗相较于单抗虽然在技术上还有很多挑战需要面对,但这丝毫不影响罗氏在双抗上的信心。目前,罗氏针对肿瘤领域在双抗上已经布局了14条管线,涉及靶点有PD-1/TIM3、PD-1/LAG3、CD20/CD3、HER2/CD3、HLA-A2-WT1/ CD3、TYRP1/CD3、FcRH5/CD3、CEA/CD3、FAP/CD40。 可以看出,罗氏在双抗设计中十分钟爱CD3靶点。而目前已上市的三款双抗中,除了罗氏上市的一款靶向FIX/FX的Hemlibra ( Emicizumab)外,另外两款双抗设计均含有CD3靶点,分别是Trion Pharma 靶向CD3/EpCAM的Removab(Catumaxomab)和安进靶向CD3/CD19的Blincyto (Blinatumomab)。两款涉及CD3靶点双抗的上市,或许也加强了罗氏对CD3靶点的信心。 而在众多涉及CD3靶点的双抗中,罗氏最看重的双抗依次是靶向CD20/ CD3、FcRH5 /CD3、PD1 /TIM3、PD1 /LAG3和HLA-A2-WT1 / CD3的产品。其中,靶向CD20/ CD3的产品有两个,分别是mosunetuzumab (RG7828)和Glofitamab (RG6026)。 mosunetuzumab (RG7828)是一款由基因泰克研发,尝试用于各种类型的血液瘤治疗的双抗。这类抗体可通过同时结合两个靶点,激活T细胞来攻击和消除B细胞,从而治疗B细胞癌症,如非霍奇金淋巴瘤。目前正在进行与来那度胺 (Revlimid) 等药物联用在至少接受1线全身治疗后的滤泡性淋巴瘤患者的III期临床试验。 Glofitamab (RG6026)是一款新型T细胞结合双抗,其“2:1的”形式结构除了能拥有一个CD3 结合剂外还可以拥有两个CD20结合剂,使得肿瘤抗原亲和力、T细胞快速活化和杀伤肿瘤细胞的能力大大增加。目前正在进行针对复发或难治性非霍奇金淋巴瘤治疗的I期临床试验。 此外,靶向FcRH5 /CD3的RG6160 (cevostamab)、靶向PD-1 /TIM3的RG7769、靶向PD-1 /LAG3的RG6139、靶向HLA-A2-WT1 / CD3的RG6007均是罗氏双抗管线中布局的重点。 而针对前沿技术ADC、mRNA疫苗及细胞疗法在肿瘤领域的运用,罗氏自然也不会错过。 目前,罗氏针对ADC的管线主要集中在2019年获FDA批准上市的ADC药物Polivy(通用名:polatuzumab vedotin-piiq)的适应证拓展上。除了获批治疗晚期和复发性弥漫性大B细胞淋巴瘤(DLBCL)适应证外,Polivy还被FDA指定为加速批准、突破性新药 (BT) 和罕见病药物。 mRNA疫苗因新冠疫情而名声大噪,而罗氏将这种技术用在了肿瘤治疗领域。autogene cevumeran(RG6180)是一种基于 mRNA 的个体化治疗性癌症疫苗,这也是罗氏与BioNTech在2016年合作的首个项目。目前,该疫苗真正进行评估治疗实体肿瘤效果的I期临床试验。 与细胞疗法赛道火热情景形成鲜明对比的是,罗氏在细胞疗法方面的布局甚为低调。2015年12月,罗氏与生物技术公司SQZ合作,希望通过SQZ公司的CellSqueeze技术具有更强效免疫反应、更优治疗效果的细胞治疗产品。而在罗氏的管线中几乎难寻细胞疗法的详细身影。 本月初,罗氏子公司基因泰克与“通用型”细胞疗法公司Adaptimmune Therapeutics达成研发合作和许可协议,将共同开发“通用型”T 细胞疗法以治疗多种肿瘤适应症,交易总额高达30 多亿美元。 从已公布的肿瘤领域管线可以看出,罗氏对于肿瘤治疗领域十分重视,但对于前沿技术的布局却极为低调。对于业内已有的成功经验,罗氏也并不刻意回避,而是结合自身的特点进行创新。正确认识创新和临床需求的关系对于新药研发十分重要。 02 传染病、免疫、神经科学、眼科:平分秋色 相比肿瘤领域的72条管线,罗氏在传染病领域布局的18条管线、免疫学领域的17条管线、神经科学领域的15条管线和眼科领域的15条管线则是“一碗水端平”,没有太大差别。
2020年的新冠疫情让大多数公司损失惨重,却让有诊断业务的罗氏大丰收。罗氏也顺势加大了在传染病领域中的布局,其18条管线中有9条管线与新冠肺炎相关。其与再生元合作开发的casivirimab(RG6413)和imdevimab(RG6412)是两种单抗混合物,也就是抗体鸡尾酒疗法,用于预防新冠病毒的感染。2020年11月,FDA授予了REGEN-COV ™(casirivimab 和 imdevimab)紧急使用授权。 除了布局新冠肺炎管线外,罗氏对流感和乙肝也很感兴趣。其管线中,Xofluza(baloxavir marboxil,RG6152)是近20年来获批的第一种具有新作用机制的流感药物。2018年10月,FDA批准Xofluza上市,用于12岁及以上患者急性、无并发症流感的治疗。而其RG6346、RG7854、RG7907等五款在研药物均用于乙肝的治疗。RG6346、RG7854已进入II期临床阶段。
对于免疫疾病的治疗,罗氏的布局相对分散,涉及的疾病也相对较多,包括:特发性肺纤维化、新冠肺炎、食物过敏、狼疮肾炎、哮喘等。对于疾病的治疗,罗氏主要还是用单抗和重组蛋白技术进行药物研发。 随着反义寡核苷酸技术的进步,罗氏也开始尝试利用该技术进行研发。2018年10月,罗氏与生物制药公司Ionis达成价值7.6 亿美元的合作。双方将利用Ionis 的RNA靶向疗法,共同开发针对多种疾病的IONIS-FB-L Rx靶向因子 B (FB)。IONIS ASO factor B是其中一项在研产品,主要用于治疗Iga肾病,正在进行II期临床试验。
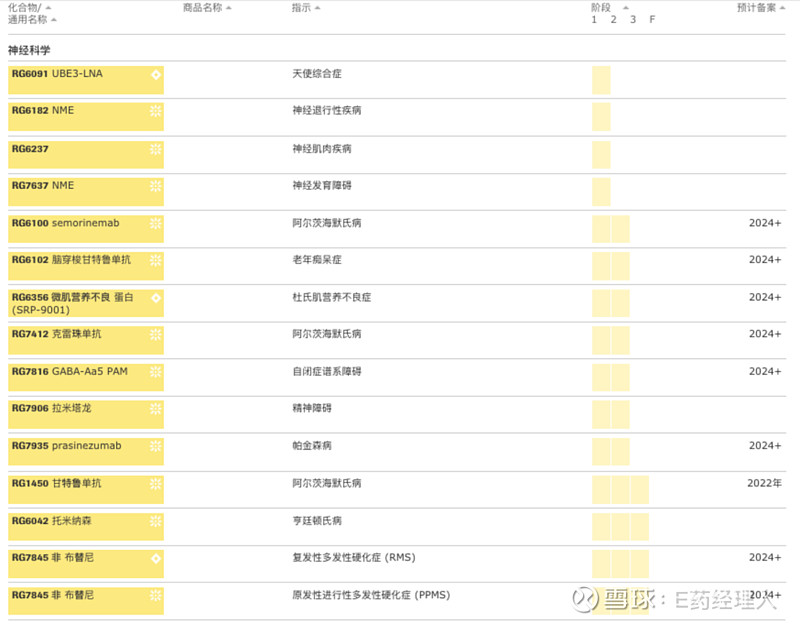
神经科学领域对于大多数跨国药企来说,是一块难啃却又不得不啃的骨头。对于罗氏来说,也是如此。而在神经科学领域中,罗氏对阿尔茨海默病有着难解的情结,其15条管线中,有4条是针对阿尔茨海默病的。对于其他神经科学领域疾病,罗氏布局则相对平均,原发性进行性多发性硬化(PPMS)、亨廷顿氏舞蹈症、复发性多发性硬化(RMS)、帕金森病、杜氏肌萎缩症等均有1条管线。 针对阿尔茨海默病药物的研发,罗氏有着自己的执著和变化。执著的是,药物设计中罗氏一直偏好单抗设计,4条管线均是单抗;变化的是靶点和更精密的技术。 Gantenerumab (RG1450)是一款全人源 IgG1 抗体,靶向患者脑内的Aβ沉积物。其原理是通过募集小胶质细胞和激活吞噬作用来集中分解和降解淀粉样蛋白斑块。这也是罗氏治疗阿尔茨海默病药物管线中进展速度最快的单抗,正在进行评估其治疗阿尔茨海默病的效果的III期临床试验,预计2022年下半年完成。目前,罗氏也正在与FDA就Gantenerumab的上市进行谈判。与渤健的aducanumab一样,该药也经历过失败又重新拾起的过程。 而RG6102(Brain shuttle gantenerumab)则是Gantenerumab的加强版,使用了罗氏的“大脑穿梭”技术,可以更好地让单抗药物穿过大脑屏障进入大脑,而不会触发免疫反应。目前该药物已经进入II期临床阶段。 RG6100(semorinemab)是一款靶向tau蛋白的单抗,由罗氏和AC Immune共同开发。由于阿尔茨海默病的病因至今未明,其治疗的难度非常大。针对阿尔茨海默病的病因有很多假说,tau蛋白假说是其中一种。2020年9月,罗氏宣布RG6100的II期临床试验失败,试验结果未达到主要和次要终点。这也使得针对tau蛋白假说的阿尔茨海默病药物研发愈发艰难,不过罗氏还未放弃这款药物。 相较于传染病、免疫学、神经科学这些大领域,眼科似乎没有那么大,但却与其他三个领域在罗氏的管线中平分秋色,可见罗氏对于眼科的重视。
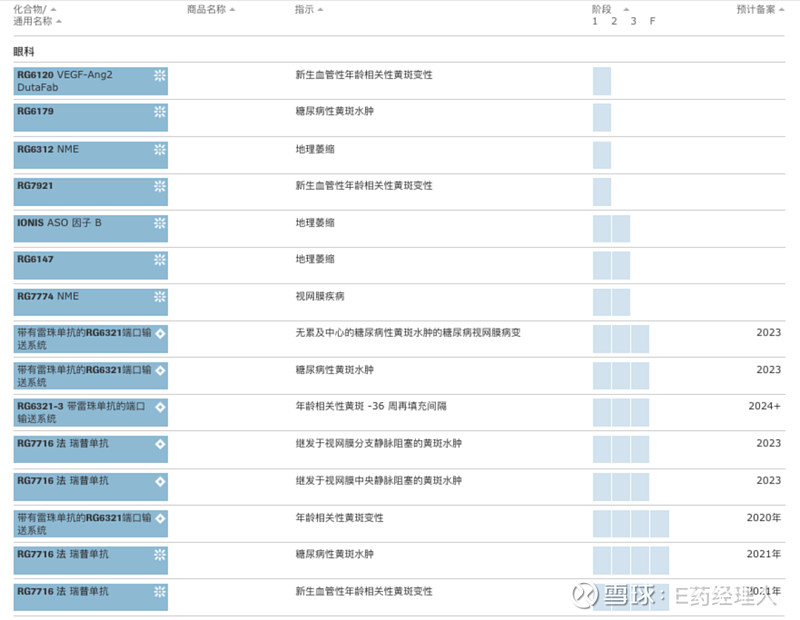
眼科疾病中,黄斑变性及黄斑水肿是罗氏选择的主要攻克方向。 虽然在2019年罗氏以48亿美元的价格收购了Spark Therapeutics,获得了全球首个获批上市的眼科基因疗法Luxturna,但基因疗法并没有直接出现在罗氏的管线中。反而单抗和双抗却一直“霸屏”,其眼科疾病管线中50%以上为单抗和双抗药物,30%左右处于早期研发阶段,技术未公布。 Lucentis(雷珠单抗)是由基因泰克研发的全球首个获批的抗血管内皮生长因子(anti-VEGF)治疗眼病药物。该药物彻底改变了湿性年龄相关性黄斑变性 (nAMD) 的治疗方法,有助于将 nAMD 引起的全球失明率降低约 50%。目前该药物正在进行一项III期临床试验。 Faricimab (RG7716) 是一款采用罗氏专有CrossMab 技术开发的双抗,可紧密结合VEGF-A和血管生成素 (Ang)-2。目前,该药物正在进行两项评估 Faricimab 治疗糖尿病性黄斑水肿效果的III期临床试验。 03 代谢、血友病:少而精 在罗氏的管线中还有5条关于代谢领域疾病的管线,以及6条其他管线。
代谢领域中,罗氏关注的是非酒精性脂肪性肝炎 (NASH)、庞贝病和甲减,其技术依然是双抗、单抗和小分子。 RG7992(抗 FGFR1/KLB)是一款双抗,旨在模拟代谢激素 FGF21。这也是罗氏在非酒精性脂肪性肝炎 (NASH)抢滩大战中的“参赛代表”,目前正在进行II 期临床试验。 PCO371 是一款可口服的小分子甲状旁腺激素 (PTH1) 受体激动剂,用于治疗甲状旁腺功能减退症。目前该药物正在进行I 期临床试验。 而在罗氏“其他”管线中,治疗血友病的管线占67%。 Emicizumab (RG6013) 是其血友病管线总目前进展最快的一款,预计明年进行III期临床试验。这是一款双抗,可模拟凝血因子 VIII(一种必需的凝血蛋白),目前正在研究对轻度或中度 A 型血友病患者的治疗。 纵观罗氏的管线,肿瘤药依旧是其核心,传染病、免疫学、神经科学、眼科、代谢,面面俱到。可以说,在疾病领域方面罗氏没有什么短板。而技术方面,罗氏并没有将ADC、mRNA、基因与细胞疗法等前沿技术直接体现在管线上,而是以收购、合作的方式直接获得。 2009年,罗氏以468亿美元收购基因泰克,从此有了强悍的“创新研发引擎”,除了拥有源源不断的DNA相关技术,还拥有了两款ADC药物; 2016年,基因泰克与BioNTech达成合作,共同开发特异性新表位的个体化mRNA肿瘤疫苗; 2019年,通过收购Spark Therapeutics,罗氏又拥有了基因疗法“大额筹码”; 本月初,又斥资超30亿美元与Adaptimmune达成合作,共同开发通用型T细胞疗法,细胞疗法“升级入场券”也不缺了。 而罗氏对单抗、双抗的钟爱,也很好地完成了“三驾马车”Rituxan(利妥昔单抗)、Avastin(贝伐珠单抗)和Herceptin(曲妥珠单抗)接力产品的布局。 由于持续受到生物类似药冲击,“三驾马车”销量持续下滑,对此,罗氏也已经做好了产品接力。例如,Rituxan可由同为CD20单抗Gazyva和Ocrevus接替,也可由CD20/CD3双抗Mosunetuzumab和RG-6026接替;Avastin可由靶向ANG2/VEGF-A的双抗Faricimab接替;Herceptin可由靶向HER-2 ADC的Kadcyla接替,也可由Perjeta(HER dimerization inhibitor)、RG-6194(HER-2 /CD3双抗)接替。 单抗、双抗、小分子等产品的创新由罗氏完成,ADC、mRNA、细胞与基因疗法等前沿技术由基因泰克、Spark Therapeutics及外部公司合作完成。这样的布局也给罗氏卫冕冠军的底气。不过,在技术快速迭代的当下,乾坤犹未定,谁都有可能是黑马。 附件:罗氏管线梳理图
|
【本文地址】
今日新闻 |
推荐新闻 |