药品注册现场核查确认前申请人的准备(资料篇) 青青子衿 药通社 2022 |
您所在的位置:网站首页 › 化学仿制药 › 药品注册现场核查确认前申请人的准备(资料篇) 青青子衿 药通社 2022 |
药品注册现场核查确认前申请人的准备(资料篇) 青青子衿 药通社 2022
|
来源:雪球App,作者: 静静-菜鸟一枚,(https://xueqiu.com/1221664365/220119140) 青青子衿 药通社 2022-05-16 21:01
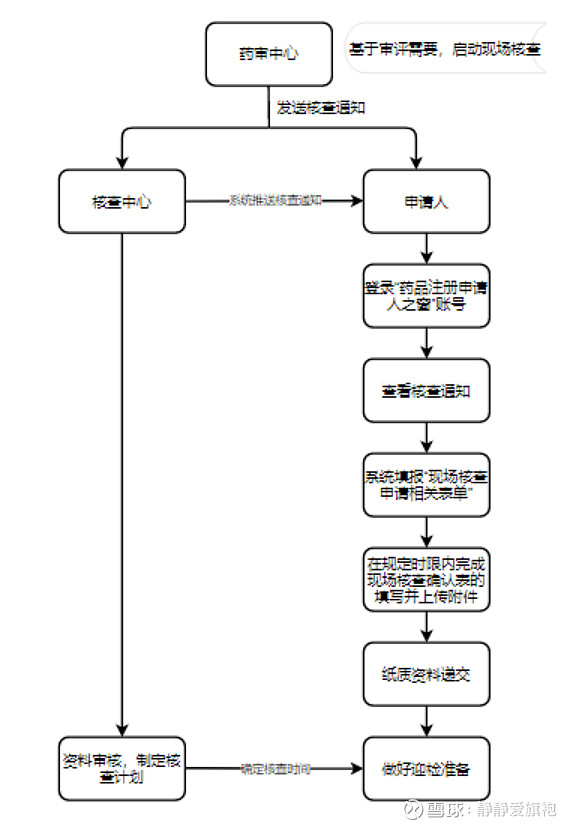
药通社 药通社:政策、资讯、产业、技术 182篇原创内容 公众号 《药品注册管理办法》第四十五条规定,“药品注册核查,是指为核实申报资料的真实性、一致性以及药品上市商业化生产条件,检查药品研制的合规性、数据可靠性等,对研制现场和生产现场开展的核查活动,以及必要时对药品注册申请所涉及的化学原料药、辅料及直接接触药品的包装材料和容器生产企业、供应商或者其他受托机构开展的延伸检查活动。” 《药品注册核查工作程序(试行)》规定,国家药品监督管理局药品审评中心(以下简称“药审中心”)在对申报资料进行审核时,会因为技术审评的需要,启动药品注册现场核查,并将任务和相关资料转送至国家药品监督管理局食品药品审核查验中心(以下简称“核查中心”)。同时,申请人会在药审中心申请人之窗中收到《注册现场核查通知》,被告知将接受现场检查的品种。药品注册现场核查确认前申请人的工作流程图如下:
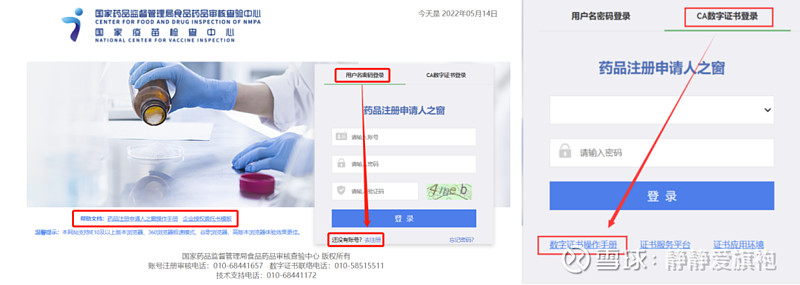
核查中心接收药审中心转交的任务及资料后,会对任务相关资料进行审核,满足开展条件后正式启动注册现场核查。申请人在接收到药审中心发出的《注册现场核查通知》后,需登录核查中心药品注册申请人之窗,填报相关资料。2021年1月1日起,药品注册核查任务相关服务统一由“药品注册申请人之窗”栏目提供,如果申请人在核查中心没有“药品注册申请人之窗”账号,则须提前注册,提交相关证明性文件,待审核通过后,账号会被激活,即可正常登录使用。 申请人注册账号时需要准备的证明性资料:企业营业执照副本扫描件,统一社会信用代码证副本扫描件(如有必须提供),法人、联系人身份证证明材料,盖章版企业委托授权书扫描件,药品生产许可证副本及变更记录扫描件(如有必须提供)。 2022年1月14日,核查中心发布了《关于“药品注册申请人之窗”增加数字证书登录方式的通知》,据此,申请人可根据自身需要选择账号密码登录或数字证书登录,两种登录方式操作权限相同。有关数字证书申请、登录、绑定、解绑等操作方式详见《数字证书操作手册》。
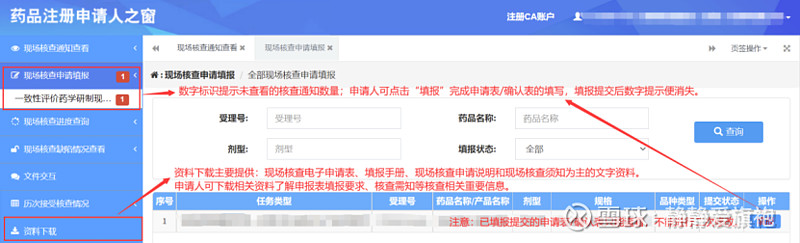
核查中心对核查任务及相关资料审核通过后,申请人即可在药品注册申请人之窗中同步查看本企业的现场核查通知。并且核查中心接收任务后即对申请人开放了填报权限,申请人即可在药品注册申请人之窗中填报现场核查的申请。值得注意的是,已填报提交的申请表只能查看,不能进行二次修改。
目前药品注册申请人之窗已整合了药品注册生产现场核查、化学仿制药注射剂注册生产现场核查和一致性评价研制/生产现场核查三个类型的检查,下面笔者将针对这三种现场核查类型的资料准备及提交方式进行介绍。 1、药品注册生产现场核查 按照核查中心《关于药品注册申请人“确认”接受生产现场核查有关事宜的通告》(2021年 第31号)相关规定,2020年6月30日之前受理的品种,填报《药品注册生产现场核查电子申请表》(以下简称《申请表》),2020年7月1日之后受理的品种,填报 《药品注册生产现场核查电子确认表》(以下简称《确认表》),申请人可根据系统显示的表单填写即可,无须自行判断。 (1)2020年6月30日之前受理的品种 线上填报:系统填报《申请表》时,除品种基本信息、批次信息和关键原辅包情况的填写外,还须点击“自查报告”进行相关信息的填写。 其他附件:需上传药品GMP证书、药品生产许可证复印件、品种核查的准备情况、生产计划安排及其他有关说明。 特别提醒:a.《申请表》的格式和内容不得擅自更改。 b.接受现场核查的药品批量生产的处方及工艺等信息应与药审中心核准的一致,期间变化情况均以报药审中心核准为主。 申报时限:自被告知之日起6个月内向核查中心提出申请。 (2)2020年7月1日之后受理的品种 线上填报:系统填报《确认表》时,除品种基本信息的填写外,还须确认是否能接受现场核查,明确可接受核查的时间或者填写不能接受核查的原因。
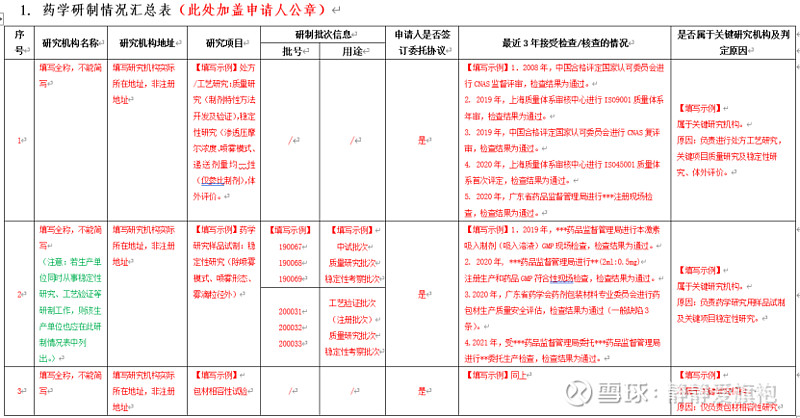
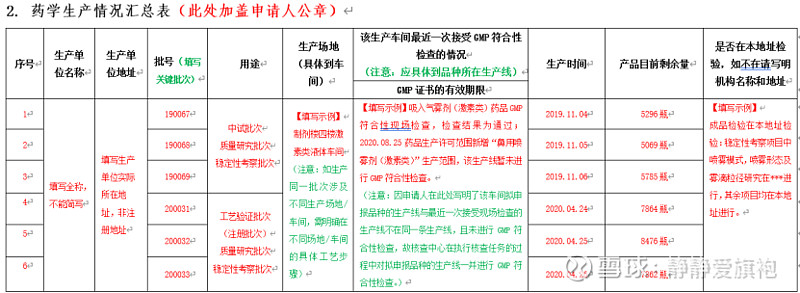
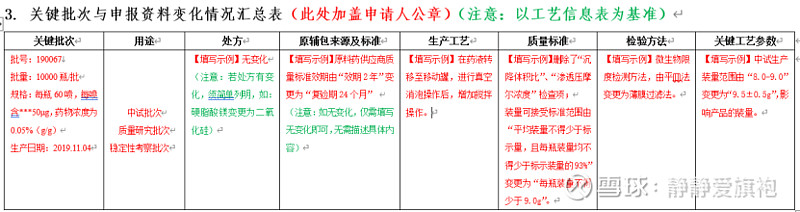
下载填写:《药品注册现场(药学研制生产)核查信息汇总表》(以下简称《信息汇总表》),填写完成盖章后扫描上传,盖章纸质版随《确认表》一并提交。 为方便“注册人”完成相关表格的填写,笔者参考2022年2月25日药审中心联合核查中心举办的“药品注册核查配套制度解读网络培训班”相关案例分享,整理编辑了《信息汇总表》填写示例,以便“注册人”参考完成相关资料的填报。详细内容可参考各表单的“填报说明”。
填写存在问题:a.《药学研制情况汇总表》研制单位研究项目填写内容不完整,部分关键研究项目(如分析方法开发及验证工作等)没有填写; b.《药学研制情况汇总表》研制单位信息与申报资料不一致,包括数量不一致,研制内容不一致等; c.《药学生产情况汇总表》填写GMP证书及符合性检查情况时,尽可能把涉及的品种或剂型写清楚。 其他附件:需上传药品生产许可证等证明文件及其他注册核查相关说明文件(如:不能接受现场核查的证明性文件等)。 特别提醒:a.不得擅自更改《确认表》和《信息汇总表》的格式和体例。 b.《信息汇总表》内容务必同申报资料一致。 “确认”时限:2020年7月1日后受理的品种,申请人最迟可以在2022年6月30日向核查中心确认(至2022年6月30日不足20/15日的,时限为20/15日)。2022年7月1日后受理的品种,自被告知之日起20日内完成确认,纳入优先审评审批品种,在15日内。 2、化学仿制药注射剂注册生产现场核查(针对2020年6月30日前受理的原6类的注册品种) 法规要求:关于开展化学仿制药注射剂注册生产现场检查有关事宜的通告(2018年第1号) 线上填报:《化学仿制药注射剂注册生产现场检查申请表》(以下简称《申请表》)、《化学仿制药注射剂自查报告》 其他附件:具体包括药品GMP证书、药品生产许可证复印件、生产计划安排及其他企业需额外说明的文件。 申报时限:在国家局规定的时限内向核查中心提出申请。 3、 一致性评价研制/生产现场核查 法规要求:关于化药仿制药质量和疗效一致性评价注册申请开展药学研制和生产现场检查有关事项的通告(2020年第4号) 线上填报:《仿制药质量和疗效一致性评价品种研制生产情况申请表》(以下简称《申请表》) 其他附件:需上传药品GMP证书、药品生产许可证复印件、品种检查的准备情况、生产计划安排、主文件清单及其他有关说明。 申报时限:自被告知之日起6个月内向核查中心提出申请。 4.提交方式:《确认表》或《申请表》及其附件均须加盖申请人公章,同时进行电子提交和纸质邮寄。 注意:在正式提交前打印的申请书,均为测试打印版,没有条码信息,不可作为正式纸质提交版本使用(正式提交版本应在首页左上角显示条码)。 5. 递交纸质资料: 纸质资料:《确认表》或《申请表》(带条码信息)及其附件3份,加盖申请人公章。 邮寄地址:生物制品和中药收件人为检查三处、化学药品收件人为检查四处。(地址:北京市西城区文兴街一号院3号楼北矿金融大厦;邮编:100044)。 现场递交:递交人须携带申请人委托书及受托人身份证件的复印件。 |
【本文地址】
今日新闻 |
推荐新闻 |