新初三丨我们周围的空气(3)氧气的制取!中考必考! |
您所在的位置:网站首页 › 初中高锰酸钾化学式 › 新初三丨我们周围的空气(3)氧气的制取!中考必考! |
新初三丨我们周围的空气(3)氧气的制取!中考必考!
|
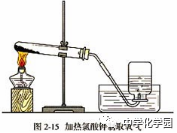
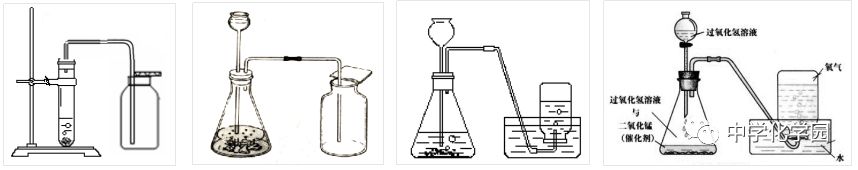
(4)操作步骤: ①检验装置气密性:连接装置把导管的一端浸没水里,双手紧贴容器外壁,若导管口有气泡冒出,松开手,导管口有一段水柱上升,则装置不漏气。 ②检查过气密性之后,在试管中装入少量高锰酸钾,并在试管口放入一团棉花;用带有导管的塞子塞紧管口,把试管口略向下固定在铁架台上。 ③定:连接并固定装置 ④点:点燃酒精灯开始加热 ⑤收:用排水法收集 ⑥离:把导管移出水面 ⑦熄:停止加热 ★可简单归纳为:查庄定点收利息!
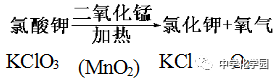
【注意事项】 ①试管口应略向下倾斜,防止加热时产生的冷凝水倒流,使试管受热不均匀而炸裂。 ②药品要平铺在试管底部,使其均匀受热后在局部加热。 ③试管内的导管稍伸出胶塞即可,便于气体导出。 ④试管口要放一团棉花,防止加热时高锰酸钾粉末进入导管堵塞导管。 ⑤用排水法收集气体时,当导管口产生连续均匀气泡时再开始收集,因开始排出的气体含有装置内的空气。 ⑥收集完毕,先将导管移出水面,然后再熄灭酒精灯,防止水沿导管倒流入热的试管中而使试管炸裂。 ⑦盛氧气的集气瓶应盖上玻璃片,正放,因为氧气的密度大于空气的密度,正放可减少气体的逸散。 (5)气体的检验与验满 ①检验方法 将带火星的小木条伸入集气瓶内,如果木条复燃,说明该瓶内气体是氧气。 ②验满方法 a排水集气法:当有气泡从集气瓶口冒出来,说明氧气已收集满。 b向上排空气集气法:把带火星的木条靠近集气瓶口,如果木条复燃,说明氧气已收集满。 方法二:实验室加热氯酸钾法制取氧气 (1)操作步骤: ①查:检查装置气密性:连接装置把导管的一端浸没水里,双手紧贴容器外壁,若导管口有气泡冒出,松开手,导管口有一段水柱上升,则装置不漏气。 ②装:装入氯酸钾和二氧化锰 ③定:连接并固定装置 ④点:点燃酒精灯开始加热 ⑤收:用排水法收集 ⑥离:把导管移出水面 ⑦熄:停止加热 (2)实验装置:固体+固体 加热型 仪器:酒精灯、试管、铁架台、导管、集气瓶、水槽
(3)结论
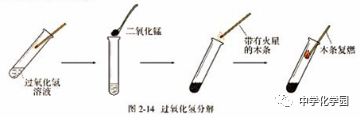
方法三:实验室分解过氧化氢法制取氧气 (1)探究: ①在试管中加入5mL5%过氧化氢溶液,把带火星的木条伸入试管,观察木条是否复燃? ②向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察现象。 ③反应停止后,重新加入过氧化氢溶液,并把带火星的木条伸入试管。观察现象。待试管中又没有现象发生时,再重复上述操作,观察现象。
结论:①过氧化氢溶液在常温下能缓慢分解成水和氧气,但放出的氧气较少。 ②加入少量二氧化锰能加速过氧化氢溶液的分解。 ③二氧化锰(MnO2)仍然起作用,产生氧气。
(2)催化剂(触媒): ①概念:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变。 ②催化作用:催化剂在化学反应里所起的作用叫催化作用。 ③注意:a.改变包括加快或减慢;b.催化剂不影响生成物的质量;c.催化剂也可能参加化学反应;d.催化剂的物理性质可能改变;e.某反应的催化剂可能不唯一;f.二氧化锰只是在特定的反应里作催化剂,在其他反应里可能不是催化剂。 ④应用:催化剂在化工成产中具有重要而广泛的应用,生产化肥、农药、多种化工原料等都使用催化剂。 (3)装置(固液不加热型)
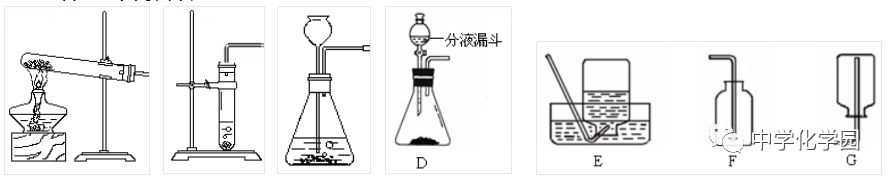
1)发生装置(根据反应物的状态和反应条件选择发生装置) 分解过氧化氢制取氧气的发生装置用如图B、C,也可以使用D所示装置。 B装置为简易装置,不便于添加液体; C装置使用长颈漏斗时,长颈漏斗的末端必须插入液体中,防止生成的气体从长颈漏斗口逸出,所以必须液封; 使用长颈漏斗优点:便于添加液体 D装置可以通过调节分液漏斗的活塞来控制液体的滴加速度,从而可以控制反应速率,得到比较稳定的氧气流。 使用分液漏斗优点:便于添加液体,还可以利用活塞控制滴液的快慢,便于控制反应速率。 2)收集装置(根据气体的密度和溶解性选择收集装置) a排水集气法:如图E(因为氧气不易溶于水) b向上排空气集气法:如图F(因为氧气密度比空气大) 3)实验步骤:
①检查装置的气密性②装固体 ③把反应装置固定好④从长颈漏斗加入过氧化氢溶液至浸没长颈漏斗⑤收集气体 ⑥检验气体是否集满 口诀:茶庄定价收盐!
ps:网络上流行的大象牙膏的实验原理就是这个~ 配方:双氧水(过氧化氢溶液)、催化剂、色素、洗洁精
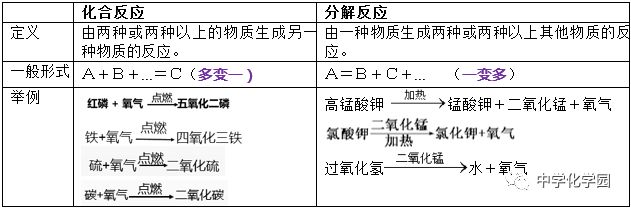
方法四:工业制取氧气 原理:利用液氧和液氮的沸点不同进行分离,属于物理变化。 做法:在低温条件下加压,使空气转变为液态,然后蒸发。由于液态氮的沸点(-196℃)比液态氧的沸点(-183℃)低,因此氮气首先从液态空气中蒸发出来,剩下的主要就是液态氧了。 知识点二:分解反应 分解反应:由一种物质生成两种或两种以上其他物质的反应(A=B+C+... )。
声明:综合整理by中学化学园,转载请先联系并注明出处,违者必究~返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |