T细胞老化路上的那些事(看到了对生命的珍惜) |
您所在的位置:网站首页 › 免疫学细胞因子记忆口诀 › T细胞老化路上的那些事(看到了对生命的珍惜) |
T细胞老化路上的那些事(看到了对生命的珍惜)
|
记忆T细胞稳态
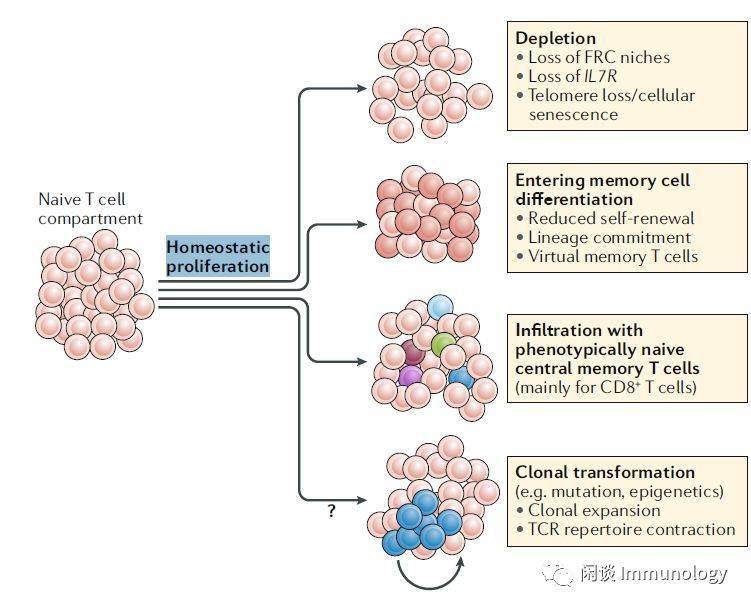
在没有再次接受抗原的情况下,记忆细胞可以存活40-60年,甚至是一生。 小痘疫苗接种后抗原特异性记忆T细胞的频率每8-15年下降50%。然而,单个记忆T细胞的寿命要短得多;在人类中,按照氘标记研究的结果,一般是6个月。因此,免疫记忆的维持是一个动态的过程,它不仅取决于单个记忆T细胞的存活,而且还取决于这些细胞的稳态增殖。最近对黄热病疫苗后抗原特异性CD8+T细胞动力学的研究表明,到30天,这些细胞已进入静息状态,其特点是间歇期长,每485天分裂一次。 这种抗原特异性的CD8T细胞群的分裂率,比以前估计unfractionated CD4或CD8记忆T细胞的分裂率要低(都在180天左右);但是,应该注意的是,黄热病特异性CD8T细胞不再表达经典的记忆细胞标记,而是包含在表达初始T细胞表型标记的细胞室中,因此类似于最近被认为是干细胞样记忆T细胞的细胞亚群。最近对干细胞样记忆CD4和CD8T细胞群的研究,得出了大约430天的自我更新估计值,这与黄热病特异性CD8 T细胞自我更新的估计相似。 总之,T细胞记忆似乎不是由单个T细胞的寿命维持的,而是由稳态增殖维持的,这种增殖速度缓慢,但仍比初始T细胞的自我更新更快。 克隆扩增的T细胞具强的生长优势挑战多态性最近估计每一个细胞分裂就有三个突变。因此,与HSCs无关的T细胞很可能积累突变,从而产生具有生长优势,快速收缩的T细胞多态性。事实上,类风湿关节炎患者的CD8+T细胞克隆扩增中发现了体细胞突变。 记忆性T细胞中寡克隆是很普遍。克隆扩展的记忆性T细胞在骨髓富集,和初始T细胞不竞争淋巴结,比较来自于血液,淋巴结,肺脏,骨髓,脾脏的记忆性T细胞,来自淋巴结的和其他组织的没什么差别,因此克隆扩展的记忆性T淋巴细胞的多态性基本丧失。
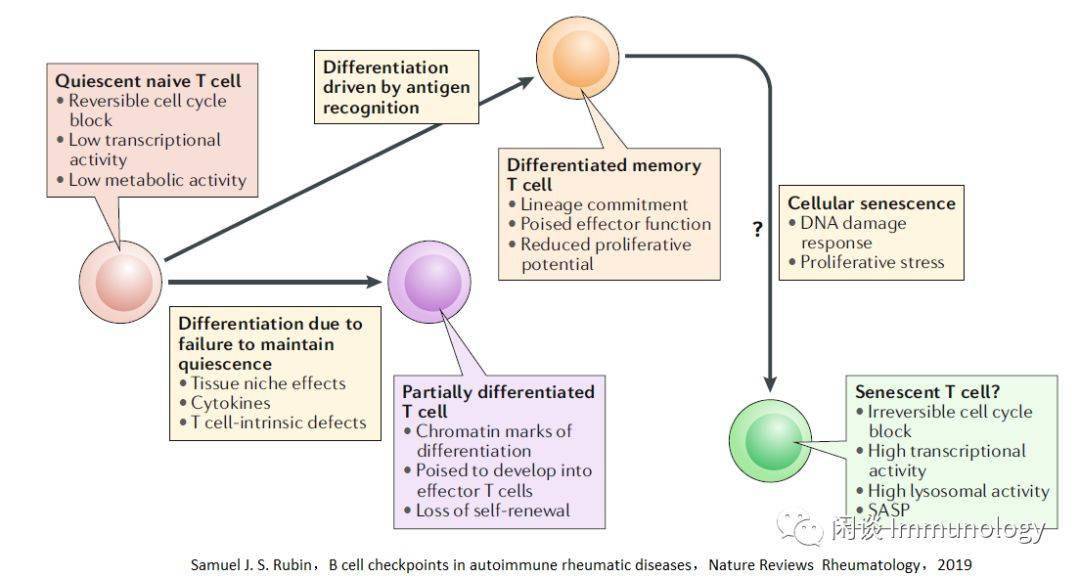
老化过程中静息破坏 T细胞静息初始T细胞和记忆T细胞处于静息状态,在受到抗原刺激之后,出现平稳的增殖和分化。 维持静息状态是维持自我更新潜能和分化可塑性的关键。 静息状态下,细胞分裂生长下调,细胞周期停滞,代谢下降,核糖体生物发生和蛋白质合成降低 干细胞老化过程中,静息被破坏。例如,激活转录因子网络,包括碱性亮氨酸拉链转录因子ATF样(Batf),导致淋巴前体克隆化和对髓系分化的偏好。 然而,老化的淋巴结生态位也会变得更刺激,使细胞脱离静止状态。环境刺激持续挑战有利于T细胞静息状态,包括那些驱动稳态增殖的因素,尤其是淋巴细胞减少症。 老化的T细胞分化破坏静息人类T细胞衰老和分化有一些共同的特征就是失去静息状态。在缺少抗原刺激的情况下, 细胞出现了细胞因子分泌等活化迹象。 虚拟记忆T细胞的产生被认为是有益的,因为这些细胞表现出天然免疫的特性,并分泌的细胞因子提供旁观者保护性免疫。 然而,作为更加分化的记忆T细胞,它们已经失去了增殖潜力,因此可能解释随着年龄增长的主要CD8+T细胞应答的下降。 老化T细胞失去干系特性表观遗传学证据也表明,老化的T细胞静息状态没有维持。T细胞老化相关的染色体表现和激活分化的T细胞类似,这些变化在CD8比CD4T细胞更显著。 在单细胞水平上,较老的T细胞在组蛋白乙酰化中具有增加的群体异质性,表明激活和分化状态的多样性. 幼稚T细胞的分化和/或记忆T细胞的表型转换可以解释这些发现。 老化初始T细胞分化的功能证据基因表达研究显示,初始T细胞的衰老过程中,至少部分和激活和分化T细胞相同。microRNA网络和分化状态类似。研究发现miR-146a在老化和分化时增加,miR-181a随老化及分化降低,呈高斯分布,不是因为部分细胞污染引起。 向更分化的状态转变足以改变细胞行为而不引起典型的衰老。 随后这些信号通路的持续激活,有利于炎症效应T细胞的产生,而不是T滤泡辅助细胞和记忆前体细胞的产生。此外,老化记忆CD4T细胞中的转录因子网络将有利于效应状态和外显子酶CD 39的表达,这与疫苗反应缺陷和效应状态有关,包括T细胞衰竭。 进入更分化的状态也可能意味着谱系保持的偏差,从而导致可塑性的丧失。例如,观察到在幼稚CD4T细胞中CD38表达的变化随年龄的变化,并且提出了在年轻T细胞中增加的异质性赋予了更多的可塑性。同样,我们观察到在转录因子如BATF和干扰素调节因子4的存在下转化生长因子-1的反应性增加,这有利于在老年人中产生T辅助细胞9细胞。
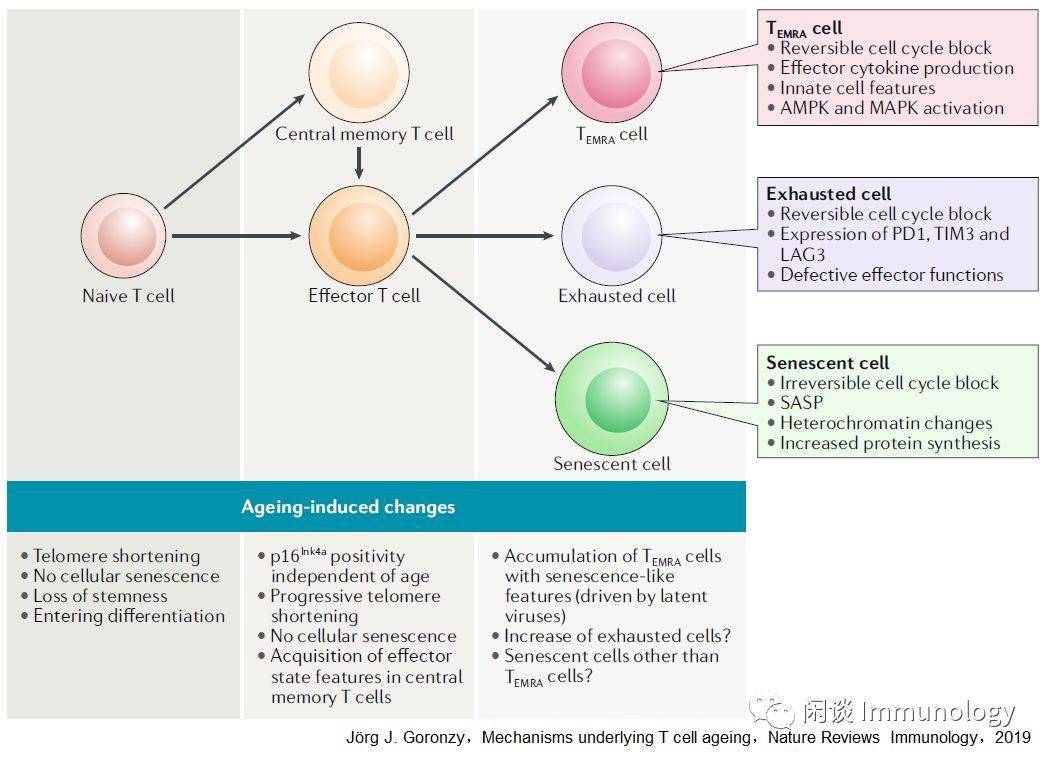
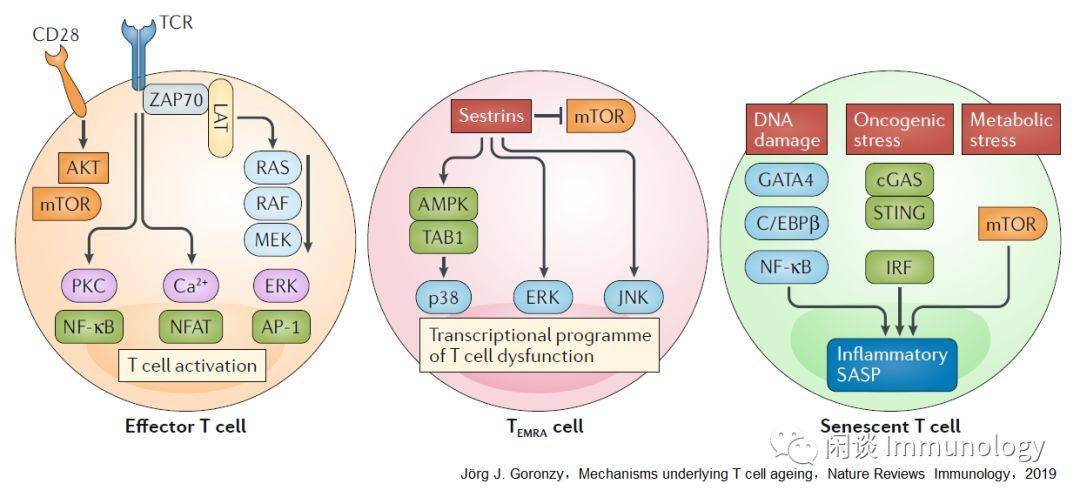
T细胞老龄化的细胞衰老 细胞衰老的机制细胞衰老通常被认为是老年相关功能障碍的主要机制之一。它是一种不可逆转的生长停滞,是对端粒缩短或多种应激反应的反应,主要涉及DNA损伤。为了避免染色体不稳定和维护基因组的稳定性,DNA损伤反应被触发,导致细胞周期永久停止。 老龄化的初始细胞和记忆细胞缺少细胞衰老的典型特征细胞衰老与人体免疫衰老有关吗?DNA损伤反应元件p16INK4a(又称CDKN2A)在人外周血T细胞中的表达已被描述为老化的生物标志物。然而,p16INK4a在正常分化为效应T细胞时也表达,因此其本身不足以表示衰老。 染色质可达性图谱显示,与CD8初始T细胞相比,INK4A-ARF位点在记忆和效应T细胞上的可达性有所提高,但在老年个体中仅略有增加。此外,与衰老相关的异染色质可达性变化是微妙的,发生在CD8+T细胞中,而不是在CD4+T细胞中。 此外,大多数老化的初始和记忆T细胞没有表现出衰老细胞的表型特征,如分泌型、增大的大小、溶酶体的含量和功能增加、空泡和颗粒形态等。最重要的是,当适当激活时,绝大多数老化的幼稚和中央记忆T细胞能够增殖。 事实上,来自类风湿关节炎患者的幼稚的CD4T细胞分裂速度更快,尽管与年龄匹配的健康对照者相比,年龄相仿的健康对照者有加速衰老的迹象(基于端粒损耗和DNA损伤程度的增加)。 TEMRA效应T细胞还是衰老T细胞大多数细胞衰老并不引起免疫缺陷,但还是有少数的衰老T细胞引起缺陷。在非免疫衰老组织中,衰老细胞仅占细胞的一小部分.这些罕见的细胞是否和如何影响组织功能一直是争论的基础。现在人们普遍认为,由DNA损伤引起的衰老细胞会分泌一系列的介质,如促炎细胞因子,这些细胞因子具有很强的旁分泌和内分泌效应,这种特性被称为衰老分泌表型(SASP)。 TEMRA细胞符合细胞衰老的几个标准,包括短端粒,细胞周期阻滞,DNA损伤灶和分泌体使人联想到SASP。 与耗竭的T细胞一样,TEMRA细胞在慢性病毒感染的背景下发育,并表现出细胞周期阻滞;然而,与耗竭的T细胞不同,TEMRA细胞保持高效的功能,实际上增加了炎症介质的产生。这些T细胞在慢性感染情况下的积聚机制还不是很清楚,可能时存活因子的表达降低了效应细胞的损耗,降低了天然免疫细胞的清除。 与衰老细胞对系统产生有害影响的概念一致,TEMRA细胞与几种慢性疾病状态以及疫苗反应不良有关。然而,扩大的TEMRA细胞已被证明对预期寿命有积极和消极的影响。 TEMRA细胞与真正的衰老细胞有明显的差异。最重要的是,他们的细胞周期阻滞是可逆的。为了支持他们是一种终末分化形式的观点,他们不仅具有分泌特征,而且还获得了调节细胞表面受体,如白细胞免疫球蛋白样受体和杀伤细胞免疫球蛋白样受体的表达。 抑制p38MAPK可恢复TEMRA细胞的端粒酶活性和增殖潜能。最近的研究表明,在衰老的TEMRA细胞中,JUN端激酶和细胞外信号调节激酶在Sestrins下游被激活,这种激活与上游MAPK级联的调控无关。
senolytics(Unity Biotechnology)已经被开发出来,通过靶向凋亡、伴侣和组蛋白修饰,在诱导衰老细胞死亡方面表现出不同程度的选择性。最好senolytics是dasatinib 和quercetin,它在心血管疾病和骨关节炎的模型系统中显示出了好处,并且延长了寿命。 但是senolytics还没有被发现提高免疫力,不清楚它是否会清除TEMRA细胞,如果是,是有害还是有利呢? 由于TEMRA细胞具有效应功能,并且对潜伏病毒具有特异性,它们的耗竭可能使病毒重新激活。事实上,TEMRA细胞的记忆膨胀可能是老年人成功控制潜伏巨细胞病毒感染的原因之一。 另一种干扰衰老细胞有害功能的方法是抑制促炎症介质的产生或活动。用PAN-Janus激酶(JAK)抑制剂处理衰老的前脂肪细胞,可能干扰分泌细胞因子正反馈环,减少体内促炎介质的产生。事实上,使用JAK 1/JAK 3抑制剂tofacitinib治疗类风湿关节炎患者,VZV再激活导致带状疱疹的风险增加。在使用JAK 1/JAK 2抑制剂baricitinib治疗的患者中,带状疱疹的发生率也有类似的增加。 SASP抑制剂主要针对在衰老细胞中具有活性的NF-κB、mTORC和p38MAPK通路。在体外研究中,mTOR特异性ATP模拟分子AZD 8055,小剂量对mTORC 1和mTORC 2抑制,逆转了近衰老成纤维细胞衰老的主要表型。此外,mTORC抑制剂,抵消由于抑制负调节磷酸酶,张力素同源物,Sprouty1,而引起的老年人CD4 T细胞反应中的持续信号,从而有利于参与T滤泡辅助细胞和记忆T细胞分化的转录因子网络。然而,在随后的一年中,接受治疗的个人感染人数也显著减少;短时间治疗后的这种长期受益令人吃惊,表明有持续的效果,可能是通过消除衰老细胞来实现的。 AMPK依赖的MPK的活化是TEMRA衰老的核心途径,这意味抑制mTORC1多方面对AMPK具有拮抗性是有害的;更合适的治疗方法是抑制sestrins或抑制p38MAPK的下游p38激活。以通过诱导端粒酶活性部分地恢复TEMRA细胞中的增殖能力。
参考文献返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |