高考化学选3简答题总结(核外电子排布式)! |
您所在的位置:网站首页 › 元素周期表中第一电离能最大的元素是什么 › 高考化学选3简答题总结(核外电子排布式)! |
高考化学选3简答题总结(核外电子排布式)!
|
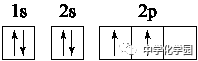
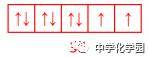
(2)排布规律 ①能量最低原理: 基态原子核外电子先占有能量最低的原子轨道,如Ge:1s22s22p63s23p63d104s24p2。 ②泡利原理: 每个原子轨道上最多只容纳2个自旋状态不同的电子。 ③洪特规则: 原子核外电子在能量相同的各轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同。 注意:洪特通过分析光谱实验得出:能量相同的原子轨道在全充满(如d10)、半充满(如d5)和全空(如d0)时体系能量较低,原子较稳定。如Cr原子的电子排布式为[Ar]3d54s1;Cu原子的电子排布式为[Ar]3d104s1。 (3)表示形式 ①电子排布式: 用数字在能级符号右上角标明该能级上排布的电子数。如K:1s22s22p63s23p64s1或[Ar]4s1。 ②电子排布图: 每个小方框代表一个原子轨道,每个箭头代表一个电子,如碳原子
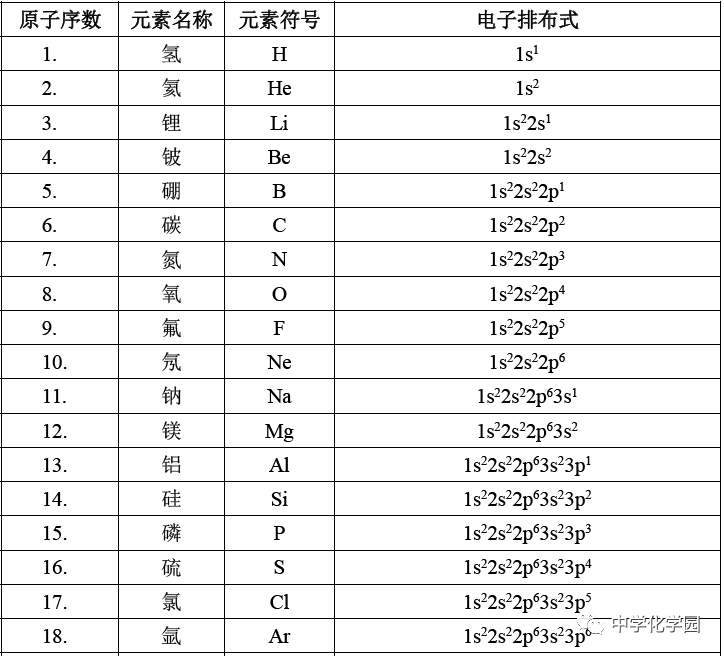
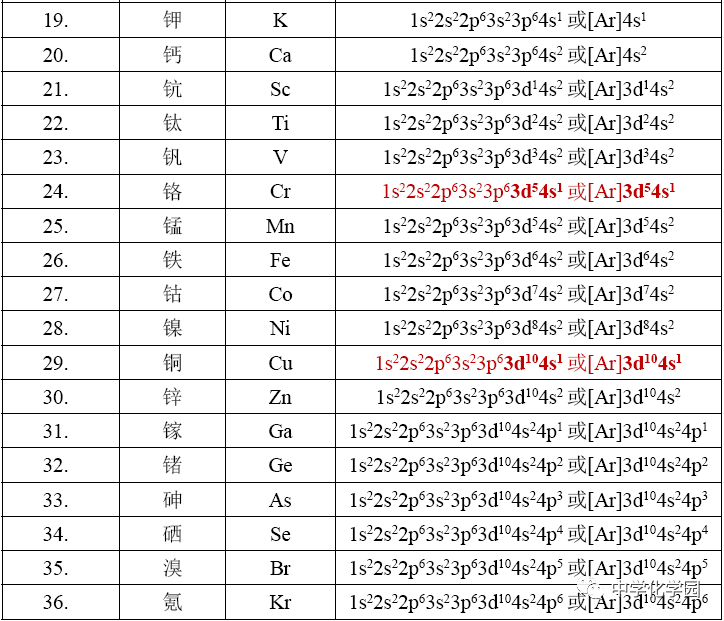
。 (4)一些元素原子的电子排布式(1~36号元素)
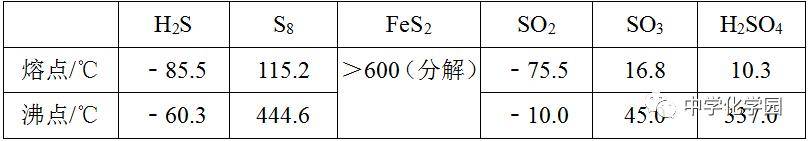
简答题 1.(2019 •新课标Ⅱ)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe﹣Sm﹣As﹣F﹣O组成的化合物。回答下列问题: (2 )Fe成为阳离子时首先失去轨道电子,Sm 的价层电子排布式4f66s2,Sm 3+价层电子排布式为。 【答案】4s ;4f5 【解析】(2 )Fe失去电子生成阳离子时电子从外到内依次失去,Fe原子最外层电子属于4s轨道,所以成为阳离子时首先失去4s轨道电子,Sm的价层电子排布式4f66s2,该原子失去电子生成阳离子时应该先失去6s 电子,后失去4f电子,Sm3+价层电子排布式为4f 5,故答案为:4s ;4f5。 2.(2018 •新课标Ⅱ)硫及其化合物有许多用途。相关物质的物理常数如表所示:
回答下列问题: (1 )基态Fe原子价层电子的电子排布图(轨道表达式)为,基态S 原子电子占据最高能级的电子云轮廓图为形。
3. (2017·新课标Ⅱ)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题: (1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
4. (2016·新课标Ⅱ)东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题: (1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。 【答案】(1)1s 22s22p63s23p63d84s2或[Ar]3d 84s2 2 【解析】(1)镍是28号元素,位于第四周期,第Ⅷ族,根据核外电子排布规则,其基态原子的电子排布式为 1s22s2 2p63s23p63d84s2,3d能级有5个轨道,先占满5个自旋方向相同的电子,剩余3个电子再分别占据三个轨道,电子自旋方向相反,所以未成对的电子数为2。
5. (2015·新课标Ⅱ)A、B、C、D为原子序数依次增大的四种元索,A2-和B +具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题: (1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。 【答案】(1)O;1s 22s22p63s23p3(或[Ne]3s 23p3) 【解析】A、B、C、D为原子序数依次增大的四种元索,A2-和B +具有相同的电子构型,则A是O,B是Na;C、D为同周期元索,C核外电子总数是最外层电子数的3倍,则C是P;D元素最外层有一个未成对电子,所以D是氯元素。 (1)非金属性越强,电负性越大,则四种元素中电负性最大的是O。P的原子序数是15,则根据核外电子排布可知C原子的核外电子排布布式为1s 22s22p63s23p3(或[Ne]3s 23p3)。 6. (2014·新课标Ⅱ)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题: (1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
7.(2019 •江苏,12分)Cu 2O 广泛应用于太阳能电池领域。以CuSO4、NaOH 和抗坏血酸为原料,可制备Cu2O 。 (1 )Cu2+基态核外电子排布式为。 【答案】(1) 1s22s22p63s23p63d9或[Ar]3d 9 【解析】(1 )Cu原子失去4s能级上1个电子、3d能级上1个电子生成铜离子,该基态离子核外电子排布式为1s22s22p63s23p63d9或[Ar]3d 9,故答案为:1s 22s22p63s23p63d9或[Ar]3d 9。 8.(2019 •海南)锰单质及其化合物应用十分广泛。回答下列问题:
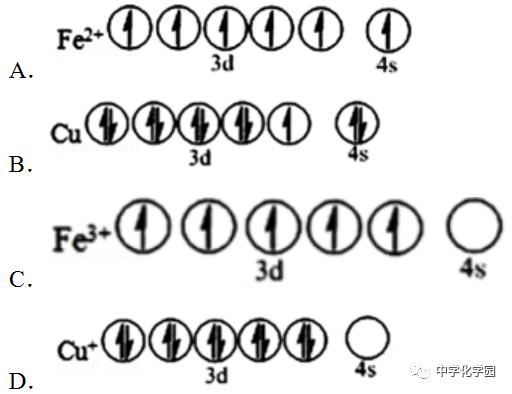
(1 )Mn位于元素周期表中第四周期族,基态Mn 原子核外未成对电子有个。 【答案】(1) ⅦB ;5 【解析】(1 )Mn为25号元素,在第四周期ⅤⅡB族;其原子核外有25个电子,其核外电子排布为[Ar]3d54s2,基态Mn 原子核外未成对电子数为其3d能级上的5个电子,所以其未成对电子数是5; 故答案为:ⅦB ;5。 9.(2018 •新课标Ⅲ)锌在工业中有重要作用,也是人体必需的微量元素,回答下列问题: (1 )Zn原子核外电子排布式为。 【答案】(1) 1s22s22p63s23p63d104s2或[Ar]3d 104s2 【解析】(1 )Zn原子核外有30个电子,分别分布在1s、2s、2p、3s、3p、3d、4s能级上,其核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d 104s2。 10.(2018 •江苏)臭氧(O3)在[Fe (H2O )6]2+催化下能将烟气中的SO 2、NO x分别氧化为SO 42 ﹣和NO 3﹣,NO x也可在其他条件下被还原为N 2。 (1 )SO42 ﹣中心原子轨道的杂化类型为;NO 3﹣的空间构型为(用文字描述)。 (2 )Fe2+基态核外电子排布式为。 【答案】(2)[Ar]3d6或1s 22s22p63s23p63d6 【解析】(2 )Fe位于周期表中第4周期第ⅤⅢ族,Fe2+为Fe 失去4s2电子所得,所以Fe 2+基态核外电子排布式为:[Ar]3d 6或1s 22s22p63s23p63d6。 11.(2018 •海南)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题: (1 )CuFeS2中存在的化学键类型是。 下列基态原子或离子的价层电子排布图正确的。
【答案】(1)离子键;CD 【解析】(1 )CuFeS2中硫为非金属元素,铁和铜为金属元素,之间形成的化学键为离子键,铁原子价电子为3d 64s2,铜原子价电子为3d 104s1。 A .二价铁离子是铁原子失去最外层2个电子形成的阳离子,3d轨道有一个成对电子,4s轨道为空轨道,故A错误;B.铜原子价电子为3d104s1 ,轨道表示式不符合,故B 错误;C.三价铁离子是铁原子失去4s两个电子和3d一个电子,3d轨道上各有一个电子为稳定结构,故C正确;D.亚铜离子是失去4s轨道一个电子形成的阳离子,轨道表示式正确,故D正确;故答案为:离子键;CD。 12. (2017·新课标Ⅲ)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题: (1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_______。 【答案】 (1)1s22s22p63s23p63d74s2或[Ar]3d74s2O Mn 【解析】(1)Co 是27号元素,位于元素周期表第4周期第Ⅷ族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d 74s2。元素Mn 与O中,由于O 元素是非金属元素而Mn是金属元素,所以第一电离能较大的是O。O元素的基态原子价电子排布式为2s22p4,所以其核外未成对电子数是2 。而Mn 元素的基态原子价电子排布式为3d54s2,所以其核外未成对电子数是5 ,因此核外未成对电子数较多的是Mn 。 13.(2017 ·江苏)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。 (1)Fe3+基态核外电子排布式为____________________。 【答案】(1)[Ar]3d5或1s22s22p63s23p63d5 【解析】(1)铁是26 号,Fe的基态核外电子排布式为1s22s22p63s23p63d64s2,Fe 3+核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |