壹生资讯 |
您所在的位置:网站首页 › 儿童癌症发病率逐年上升 › 壹生资讯 |
壹生资讯
|
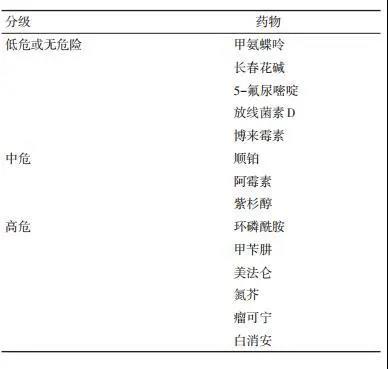
摘要 目前我国肿瘤发病率呈上升趋势,女性肿瘤患者的生育力保护与保存也逐渐受到重视,患者的需求亦逐年增多。在我国女性肿瘤患者的生育力保存处于起步阶段,缺乏相应的规范及指南指导医生开展相应的诊疗活动。本文为指导血液、乳腺及妇科肿瘤相关专科的临床工作及提高患者的生存质量,联合生殖、妇产科及肿瘤专科的临床专家对临床诊疗策略及流程规范提出专家建议,提高对女性肿瘤患者的生育力保护与保存的共识。 概述 在全球, 近10多年来癌症发病率持续增长, 根据2018年国家癌症中心发布的数据, 我国癌症发病近10多年来呈上升趋势, 并且低龄人群癌症患病率有明显上升, 女性发病上升幅度更快[1]。虽然肿瘤的临床治愈率显著升高, 但化疗、放疗及生殖器官的手术治疗均会造成生育能力不可逆转的损伤及衰竭。育龄女性或青春期以及儿童肿瘤患者的生育力保护及保存日显重要。临床上已建立有效的生育力保存技术, 推荐任何有生育要求或未完成生育的女性肿瘤患者尽早进行生育力保护及保存的咨询。本文旨在通过对女性肿瘤患者的生育力保护及保存的共识, 建立相关的临床诊疗规范, 提高相应肿瘤专科医生对女性肿瘤患者的生育力保护及保存意识, 提升患者的生存质量。 01放、化疗对女性患者生育力的损伤 放疗对卵子的毒性是直接的, 无论卵泡的径线。剂量2 Gy会导致约50%卵泡丢失[2], 累积达24 Gy导致卵巢衰竭[3], 颅脑照射达50 Gy导致中枢性闭经[4]。 化疗对各级卵泡的损伤程度不同, 主要损伤分裂活跃的细胞, 如成熟期卵泡以及颗粒细胞。而对于始基卵泡的化疗损伤机制是不同的, 包括直接诱导卵子凋亡、导致卵巢皮质的纤维化而影响供血。通过损伤颗粒细胞影响始基卵泡募集, 导致卵泡闭锁或者对化疗损伤更敏感[5]。不同的化疗药物对卵巢的损伤程度不一, 因为细胞周期的非特异性, 烷化剂类化疗药物对卵巢功能损伤明显。不同化疗药物对生育力的损伤危险分级见表 1[6]。
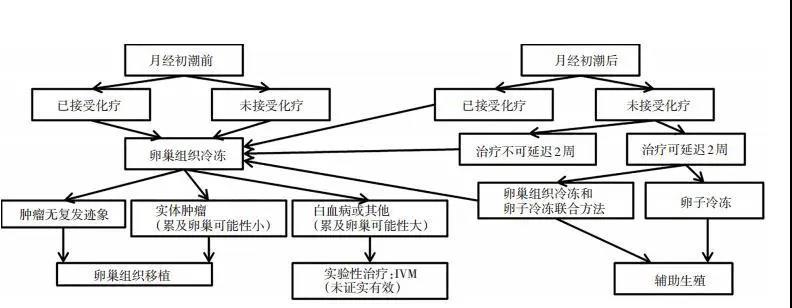
表 1 性腺毒性化疗药物危险分级 02 生育力保护及保存方案 2.1 卵巢降调节 长效促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist, GnRH-a)注射后2周左右会出现垂体降调节状态, 卵巢无卵泡募集、生长与排卵, 但对卵巢功能的保护作用非常有限, 是否具有实际效果仍存在争议。 2.2 胚胎冷冻/卵子冷冻及其适应证 我国已建立成熟的胚胎冷冻及移植技术[7]。推荐对无体外受精(in vitro fertilization, IVF)禁忌证的已婚女性, 可推迟行肿瘤治疗的患者行胚胎冷冻保存生育力, 但对已行化疗或盆腔放疗的肿瘤患者不推荐再行胚胎冷冻保存。推荐年龄 < 40岁、卵巢功能正常的单身肿瘤患者, 可行促排卵联合成熟卵子玻璃化冷冻保存。短期内行化疗或盆腔放疗会导致生殖细胞丢失, 并更易影响生长中的卵泡, 甚至有可能导致染色体损伤或畸变, 因此不推荐行胚胎/卵子冷冻保存[8-11]。但对已完成或正在化疗或盆腔放疗的患者建议行卵巢组织冷冻。 肿瘤患者胚胎冷冻适应证:1)已婚女性; 2)年龄 < 40岁; 3)卵巢储备正常:抗苗勒管激素(anti mullerian- hormone, AMH)水平>1.1 ng/mL, 窦卵泡数(antral follicle count, AFC)>6个; 4)放疗或化疗前, 保存IVF/卵胞浆内单精子注射(intracytoplasmic sperm injection, ICSI)周期中的可用胚胎(卵裂期或囊胚期); 5)距离盆腔放疗或化疗前至少1周。 肿瘤患者卵子冷冻适应证:1)年龄 < 40岁; 2)卵巢储备正常:AMH水平>1.1 ng/mL, AFC>6个; 3)未婚或已婚女性化疗前、盆腔放疗前; 4)距离盆腔放疗或化疗前至少1周。具有上述适应证的女性肿瘤患者可行促排卵联合成熟卵子玻璃化冷冻保存。 2.3 控制性促排卵 控制性卵巢刺激(controlled ovarian hyperstimula- tion, COH)的目的, 是获得一定数目可用于胚胎冷冻或卵子冷冻的成熟卵子, 临床中可使用的促排卵方案众多。选择合理有效的促排卵方案需要考虑以下因素:1)应避免卵巢过度刺激综合征; 2)避免促排时间过长; 3)灵活选择促排卵方案。月经周期任意时间尽快获得可冷冻或可受精的成熟卵子。如选择拮抗剂方案、黄体期促排方案、高孕激素状态下卵巢刺激(progestin primed ovarian stimulation, PPOS)方案等, 缩短获得卵子需要的时间[12-13]。 2.4 卵子体外成熟 卵子体外成熟(in vitro maturation, IVM)技术无需促排卵或仅需短暂促排卵, 可避免促排卵导致的卵巢过度刺激综合征。卵子获取时间不限制在卵泡期, 在不同的月经周期获取卵子行IVM, 其获卵率、受精率及妊娠率均无差别[14-16]。IVM技术适用于肿瘤治疗急迫、无时间进行促排卵的患者。 2.5 卵巢组织冷冻与移植 卵巢组织冷冻(ovarian tissue cryopreservation, OTC)与移植适应证:1)年龄 < 37岁; 2)卵巢储备正常:AMH水平>1.1 ng/mL, AFC>6个; 3)放化疗前(非卵巢恶性肿瘤); 4)放化疗后要求维持正常的性激素水平和月经, 无激素替代治疗(hormone replacement therapy, HRT)禁忌证患者; 5)距离盆腔放疗或化疗前至少3天。OTC是青春期前生育力保护的唯一方法, 也是针对患者无足够时间行卵子/胚胎冷冻时的保存方法。手术获取一侧卵巢组织, 可配合IVM技术, 同时保存患者的卵巢组织和卵子/胚胎。 肿瘤患者临床治愈后, 卵巢组织可移植回原位或髂窝内。如不需生育者, 卵巢组织可埋藏于皮下, 恢复患者生殖内分泌功能。卵巢组织移植后, 恢复正常月经周期为3.5~6.5个月, 也有报道延迟至9个月[17-18], 卵巢组织移植后可维持的时间最长为10年。在肿瘤患者的卵巢组织冷冻与移植的应用中, 需注意肿瘤细胞的污染问题, 如白血病、神经母细胞瘤、伯基特淋巴瘤和恶性卵巢肿瘤的卵巢转移风险可能增加。在卵巢组织冷冻与移植前, 需判断原发肿瘤卵巢转移的风险, 常用检测方法包括常规病理检查和肿瘤特异性免疫组织化学法检测, 卵巢皮片移植至联合免疫缺陷模型鼠的成瘤实验, 肿瘤特异性分子流式细胞术及聚合酶链反应(PCR)技术。生育力保存的诊疗流程建议见图1[19]。
图 1 生育力保存的诊疗流程建议 03特殊人群的生育力保存建议 3.1 血液肿瘤患者生育力保存的建议 血液系统肿瘤女性患者行生育力保存具有特殊性:1)育龄期患者比例高, 有生育要求的患者比例高; 2)部分血液系统肿瘤治愈率高(如霍奇金淋巴瘤、急性淋巴细胞白血病); 3)部分血液系统肿瘤急性起病, 生育力保存治疗时间有限, 无法进行常规的促排卵操作; 4)患者可能伴有贫血、白细胞降低、出血倾向、心肺功能异常等影响常规生育力治疗的禁忌证; 5)如行卵巢组织冷冻需明确告知患者, 卵巢组织移植可能发生肿瘤细胞转移。常规血液系统肿瘤治疗方案对导致女性绝经危险程度分级见表 2[20]。造血干细胞移植前的放化疗导致卵巢衰竭的比率高达70%~100%[21]。因此, 在血液系统肿瘤患者的诊疗中, 建议行生育力评估与生育力保存。
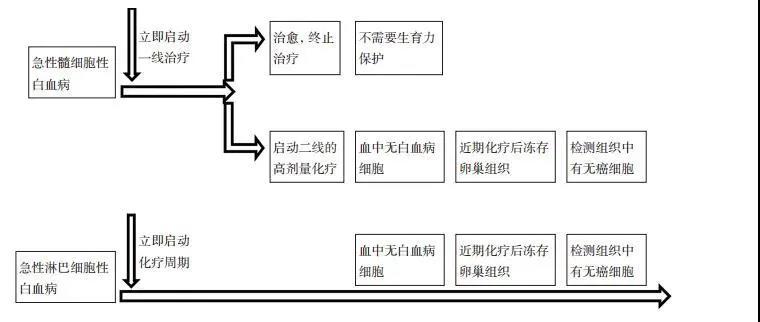
表 2 血液系统肿瘤与乳腺癌常规治疗导致绝经的危险分级 对于急性白血病患者推荐立即开始化疗, 化疗至完全缓解后由生殖专科医生评估患者的卵巢功能, 如卵巢功能尚在正常范围内, 建议再行卵巢组织冷冻。对于年轻霍奇金淋巴瘤患者, 吡柔比星+博来霉素+长春新碱+氮烯咪胺(ABVD)方案对卵巢损伤较小, 生育率不低于正常人群。因此推荐25岁以下采用ABVD方案的早期淋巴瘤患者, 如经评估卵巢功能正常可无需行生育力保存; 超过25岁的早期患者行生育力保存咨询及治疗[22-23]。对采用烷化剂(如BEACOPP)治疗方案的患者, 建议进行生育力保存。急性白血病患者生育力保存的临床建议见图2[24]。
图 1 急性白血病患者的生育力保存临床诊疗流程建议 3.2 乳腺癌患者生育力保存的建议 乳腺癌在女性恶性肿瘤中发病率高, 育龄女性的乳腺癌患者约占40%。早期诊断和新辅助放化疗使乳腺癌患者5年生存率达85%~90%[25]。常规乳腺癌治疗方案对女性绝经危险程度分级见表 2[20]。 对经评估可推迟化疗7~14天的患者, 立刻行生育力保存咨询。对乳腺癌患者的胚胎和(或)卵子冷冻保存, 降低雌激素, 缩短促排卵时间, 是促排卵治疗必须遵循的原则。在促排卵过程中建议添加来曲唑, 可明显降低循环中雌激素水平。卵子体外成熟、卵巢组织冷冻和垂体降调节是患者无法接受促排卵治疗时的选择。垂体降调节建议开始于化疗前1周, 作用时间维持到化疗后1~2周。 3.3 妇科肿瘤患者生育力保存的建议 目前, 妇科肿瘤患者的生育力保存主要限于育龄期有生育要求的早期肿瘤患者。妇科恶性肿瘤保存生育功能临床指南建议:宫颈癌患者保留子宫的指征为ⅠB1期前, 大小 < 2 cm肿瘤; 子宫内膜癌保留子宫的指征为I A期高分化的子宫内膜样腺癌, 孕激素受体阳性患者; 卵巢上皮肿瘤为ⅠA期高分化, 对侧卵巢外观及病理活检阴性, 腹腔细胞学及高危区域探查和多点活检阴性者有机会行保存生育力手术; 而卵巢生殖细胞肿瘤较特殊, 无论期别早晚, 均可行生育力保存手术。早期妇科肿瘤患者保存生育力需要关注以下问题:1)促排卵中, 关注是否为激素敏感性肿瘤, 促排卵是否导致肿瘤恶化; 2)取卵手术, 需要考虑穿刺轨迹是否会经过肿瘤组织从而导致肿瘤播散; 3)卵巢组织冷冻前需确定是否有肿瘤细胞侵犯卵巢的可能。 对于良性肿瘤, 需评估卵巢功能、治疗方式及婚育情况, 在治疗前和手术中充分考虑患者生育力保护及保存的问题。有卵巢功能不全倾向的患者(如二次手术的卵巢子宫内膜异位症、双侧子宫内膜异位囊肿、卵巢低储备的畸胎瘤等)亦有生育力保存指征。 专家共识委员会 专家组组长: 梁晓燕 中山大学附属第六医院 执笔人: 李晶洁 中山大学附属第六医院 共识专家组成员(按姓氏汉语拼音排序): 方丛 中山大学附属第六医院 李晶洁 中山大学附属第六医院 李婷婷 中山大学附属第六医院 李志铭 中山大学肿瘤防治中心 谢小明 中山大学肿瘤防治中心 王曦 中山大学肿瘤防治中心 刘学奎 中山大学肿瘤防治中心 姚和瑞 中山大学附属孙逸仙医院 学术秘书: 李晶洁 中山大学附属第六医院 参考文献: [1] 郑荣寿, 顾秀瑛, 李雪婷, 等. 2000-2014年中国肿瘤登记地区癌症发病趋势及年龄变化分析[J]. 中华预防医学杂志, 2018, 52(6): 593-600. [2] Wallace WH, Thomson AB, Kelsey TW. The radiosensitivity of the human oocyte[J]. Hum Reprod, 2003, 18(1): 117-121. [3] Anderson RA, Mitchell RT, Kelsey TW, et al. Cancer treatment and gonadal function:experimental and established strategies for fertility preservation in children and young adults[J]. Lancet Diabetes Endocrinol, 2015, 3(7): 556-567. [4] Gleeson HK, Shalet SM. The impact of cancer therapy on the endocrine system in survivors of childhood brain tumours[J]. Endocr Relat Cancer, 2004, 11(4): 589-602. [5] Meirow D, Biederman H, Anderson RA, et al. Toxicity of chemotherapy and radiation on female reproduction[J]. Clin Obstet Gynecol, 2010, 53(4): 727-739. [6] Sonmezer M, Oktay K. Fertility preservation in young women undergoing breast cancer therapy[J]. Oncologist, 2006, 11(5): 422-434. [7] 徐蓓, 靳镭. 现阶段中国实行选择性单胚胎移植的时机是否成熟[J]. 生殖医学杂志, 2018, 27(9): 879-883. [8] Asadi Azarbaijani B, Sheikhi M, Oskam IC, et al. Effect of previous chemotherapy on the quality of cryopreserved human ovarian tissue in vitro[J]. PLoS One, 2015, 10(7): e133985. [9] Lawrenz B, Jauckus J, Kupka M, et al. Efficacy and safety of ovarian stimulation before chemotherapy in 205 cases[J]. Fertil Steril, 2010, 94(7): 2871-2873. [10] Lawrenz B, Jauckus J, Kupka MS, et al. Fertility preservation in >1, 000 patients:patient's characteristics, spectrum, efficacy and risks of applied preservation techniques[J]. Arch Gynecol Obstet, 2011, 283(3): 651-656. [11] Meirow D, Epstein M, Lewis H, et al. Administration of cyclophosphamide at different stages of follicular maturation in mice:effects on reproductive performance and fetal malformations[J]. Hum Reprod, 2001, 16(4): 632-637. [12] von Wolff M, Thaler CJ, Frambach T, et al. Ovarian stimulation to cryopreserve fertilized oocytes in cancer patients can be started in the luteal phase[J]. Fertil Steril, 2009, 92(4): 1360-1365. [13] Nayak SR, Wakim AN. Random-start gonadotropin-releasing hormone (GnRH) antagonist-treated cycles with GnRH agonist trigger for fertility preservation[J]. Fertil Steril, 2011, 96(1): e51-54. [14] Bedoschi GM, de Albuquerque FO, Ferriani RA, et al. Ovarian stimulation during the luteal phase for fertility preservation of cancer patients:case reports and review of the literature[J]. J Assist Reprod Genet, 2010, 27(8): 491-494. [15] Demirtas E, Elizur SE, Holzer H, et al. Immature oocyte retrieval in the luteal phase to preserve fertility in cancer patients[J]. Reprod Biomed Online, 2008, 17(4): 520-523. [16] Maman E, Meirow D, Brengauz M, et al. Luteal phase oocyte retrieval and in vitro maturation is an optional procedure for urgent fertility preservation[J]. Fertil Steril, 2011, 95(1): 64-67. [17] Kim S, Lee Y, Lee S, et al. Ovarian tissue cryopreservation and transplantation in patients with cancer[J]. Obstet Gynecol Sci, 2018, 61(4): 431-442. [18] Meirow D, Roness H, Kristensen SG, et al. Optimizing outcomes from ovarian tissue cryopreservation and transplantation; activation versus preservation[J]. Hum Reprod, 2015, 30(11): 2453-2456. [19] Balduzzi A, Dalle JH, Jahnukainen K, et al. Fertility preservation issues in pediatric hematopoietic stem cell transplantation:practical approaches from the consensus of the pediatric diseases working party of the EBMT and the international BFM study group[J]. Bone Marrow Transplant, 2017, 52(10): 1406-1415. [20] Lee SJ, Schover LR, Partridge AH, et al. American society of clinical oncology recommendations on fertility preservation in cancer patients[J]. J Clin Oncol, 2006, 24(18): 2917-2931. [21] Martinez F. Update on fertility preservation from the Barcelona international society for fertility preservation-ESHRE-ASRM 2015 expert meeting:indications, results and future perspectives[J]. Hum Reprod, 2017, 32(9): 1802-1811. [22] Brusamolino E, Baio A, Orlandi E, et al. Long-term events in adult patients with clinical stage IA-IIA nonbulky Hodgkin's lymphoma treated with four cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine and adjuvant radiotherapy:a single-institution 15- year follow-up[J]. Clin Cancer Res, 2006, 12(21): 6487-6493. [23] Hodgson DC, Pintilie M, Gitterman L, et al. Fertility among female Hodgkin lymphoma survivors attempting pregnancy following ABVD chemotherapy[J]. Hematol Oncol, 2007, 25(1): 11-15. [24] Shapira M, Raanani H, Cohen Y, et al. Fertility preservation in young females with hematological malignancies[J]. Acta Haematol, 2014, 132(3-4): 400-413. [25] Haddadi M, Muhammadnejda S, Sddeghi-Fazel F, et al. Systematic review of available guidelines on fertility preservation of young patients with breast cancer[J]. Asian Pac J Cancer Prev, 2015, 16(3): 1057-1062.
来源:中国肿瘤临床 |
【本文地址】
今日新闻 |
推荐新闻 |