氮杂环卡宾催化:“中产”是怎样炼成的 |
您所在的位置:网站首页 › 催化作用机理是什么意思 › 氮杂环卡宾催化:“中产”是怎样炼成的 |
氮杂环卡宾催化:“中产”是怎样炼成的
|
氮杂环卡宾催化:“中产”是怎样炼成的
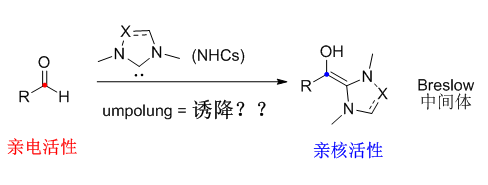
【氮杂环卡宾是什么?】 有机小分子催化模拟了生物酶的催化活性,且廉价易得,温和无毒,因此一直是不对称催化领域的前沿热点之一。其中,氮杂环卡宾(NHCs, N-Heterocyclic Carbenes)是一类非常独特的催化剂,可以“诱降”醛类等化合物,使其“变节”,生成Breslow中间体,由亲电性转变为亲核性,从而实现羰基官能团的极性反转 [1]。
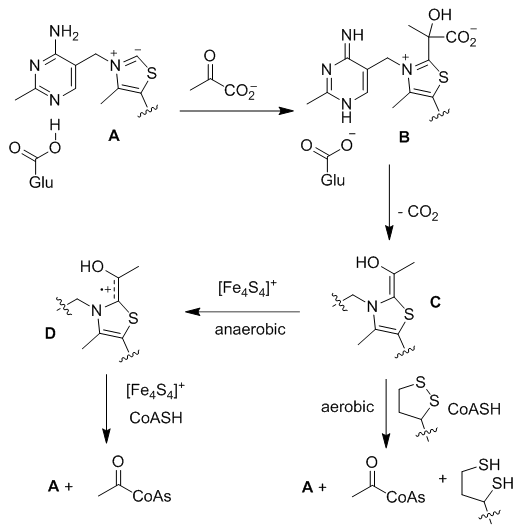
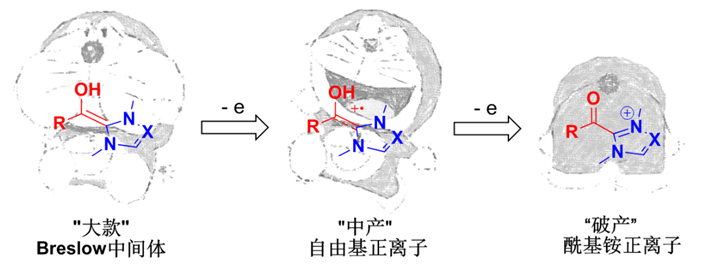
Scheme 1. 氮杂环卡宾催化的极性反转 【Breslow中间体不得不说的秘密】 Breslow中间体的结构本质为烯醇-烯胺。如果把可以参与反应的电子视为分子的财富的话,那么Breslow中间体就是一位名副其实的“大款”,其“身家”(氧化还原电势)约为-1.0 V [2],常常穿梭于各类氧化还原反应,“慷慨解囊”提供电子。在生物体内,这位“大款”一直默默“资助”一种重要物质-乙酰辅酶A的合成。如Scheme 2所示,维生素B1衍生物A可以与丙酮酸生成加合物B,脱除一分子CO2之后即生成Breslow中间体C。C在铁硫蛋白(pyruvate ferredoxin oxidoreductase)的氧化作用下,“财富”逐渐缩水,先是失去第一个电子变为“中产”(即自由基正离子)D,“身家”仅剩-0.4V左右[2],紧接着再失去一个电子,沦为“破产”,幸得辅酶A(CoA)施以援手,最终生成乙酰辅酶A(acetyl-CoA)[3]。
Scheme 2. 生物体内乙酰辅酶A的生成(图片来源:Chem. Rev., 2003, 103, 2333-2346) 人类一直以大自然为最好的老师。化学工作者也在乙酰辅酶A的生物合成过程中得到启发,在氮杂环卡宾催化中尝试加入不同的氧化剂(如蒽醌,MnO2等),实现了对Breslow中间体“财富”的攫取[4]。然而,目前所揭示的氧化方法可控性较差,多数只能维持“大款”和“破产”两个极端,而维持Breslow中间体的“中产”状态(自由基正离子)难度很大。
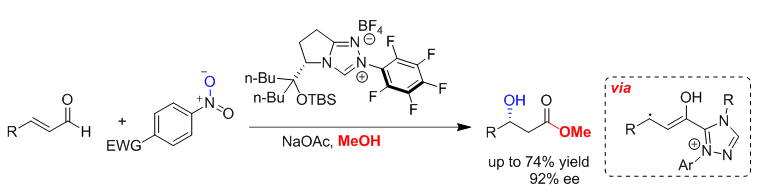
【Breslow中间体的“中产”之路】 美国科罗拉多州立大学的Tomislav Rovis教授一直致力于新颖氮杂环卡宾催化剂的设计与应用。2014年,该课题组首次成功的捕捉到了“中产”状态的Breslow中间体(Scheme 3)[5]。研究人员选用温和的硝基化物为单电子氧化剂,在10 mol%的手性卡宾催化作用下,实现了α,β-不饱和醛的不对称β-羟基化反应,ee值高达92%。该反应条件温和,对空气不敏感。(Enantioselective N-Heterocyclic Carbene-Catalyzed β-Hydroxylation of Enals Using Nitroarenes: An Atom Transfer Reaction That Proceeds via Single Electron Transfer. J. Am. Chem. Soc., 2014, 136, 14674-14677)
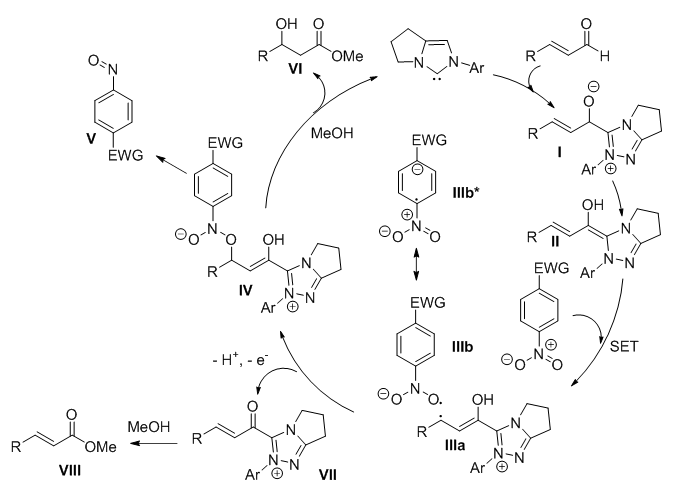
Scheme 3.氮杂环卡宾催化的不对称β-羟基化反应(一)(图片来源:J. Am. Chem. Soc., 2014, 136, 14674-14677) Rovis教授等随后提出了可能的历程:在“出身贫寒”的硝基化合物作用下,Breslow中间体II为其提供一个电子,于是二者同时步入“自由”的“中产阶级”(IIIa和IIIb)。正所谓“物以类聚”,IIIa和IIIb迅速找到“共同话题”,展开深度合作,经历了IV的生成及其N-O键的断裂,最终在甲醇的作用下得到产物VI(Scheme 4)。
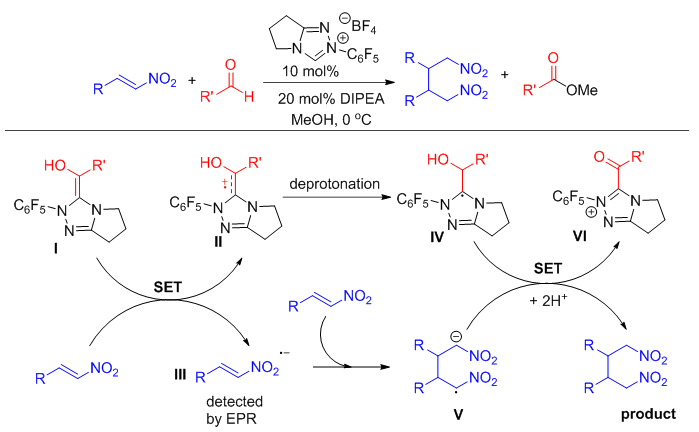
Scheme 4. Breslow中间体的“中产化”历程:β-羟基化反应(一)(图片来源:J. Am. Chem. Soc., 2014, 136, 14674-14677) 几乎同时,新加坡南洋理工大学的Robin Chi教授课题组也发现了“中产”Breslow中间体的身影,藉此实现了硝基烯烃的自身还原偶联反应(Scheme 5)[6]。作者同样假设了两种“自由”的“中产”II和III的存在,并通过EPR(Electron Paramagnetic Resonance,电子顺磁共振)予以确认。然而,II和III之间并没有直接“合作”:II发生去质子化生成自由基中间体IV,而III与另外一分子硝基烯烃发生亲核加成反应,生成新的中间体V。IV与V倒是“一见钟情”,再次发生单电子转移,得到偶联产物。(N-Heterocyclic Carbene Organocatalytic Reductive β,β-Coupling Reactions of Nitroalkenes via Radical Intermediates. Org. Lett., 2014, 16, 5678-5681)
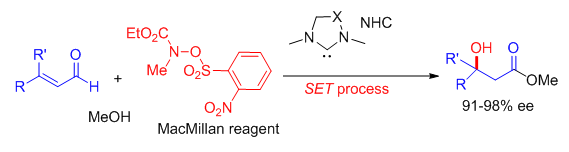
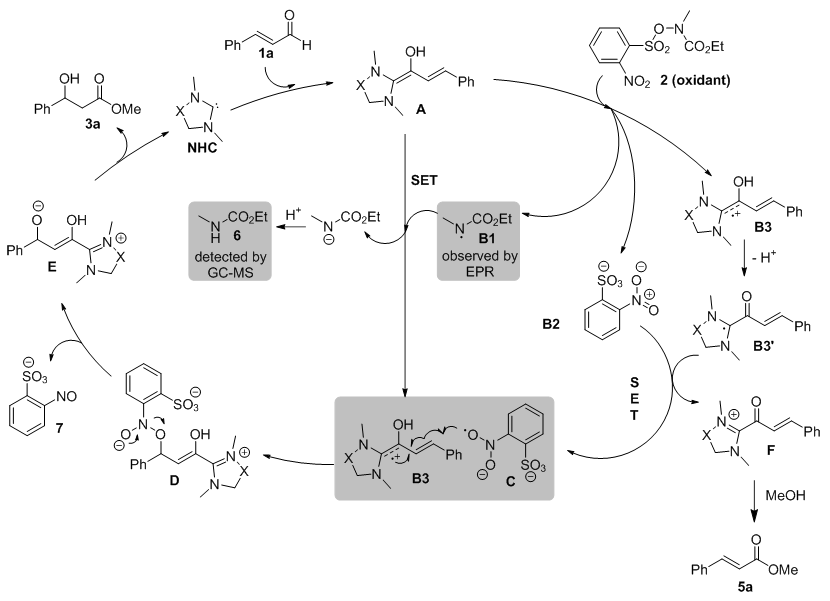
Scheme 5. Breslow中间体的“中产化”历程:硝基烯烃的还原偶联反应(图片来源:Org. Lett., 2014, 16, 5678-5681) 随后,Chi课题组又设想以MacMillan试剂(一种单电子氧化剂和氮自由基前体)将Breslow中间体“中产化”,实现β-氨基化反应。然而“理想很丰满,现实很骨感”,作者在实验中却只能得到β-羟基化产物。相比Rovis课题组先前的报道[5],Chi的反应收率和ee值分别高达98%和97%,缺点是对水和空气极度敏感(Scheme 6)[7]。研究发现,该反应存在两种Breslow中间体的“中产化”途径,即MacMillan试剂非硝基N-O的断裂和氮自由基B1的还原(Scheme 7)。(N Heterocyclic Carbene-Catalyzed Radical Reactions for Highly Enantioselective β Hydroxylation of Enals. J. Am. Chem. Soc., 2015, 137, 2416-2419)
Scheme 6. 氮杂环卡宾催化的不对称β-羟基化反应(二)(图片来源:J. Am. Chem. Soc., 2015, 137, 2416-2419)
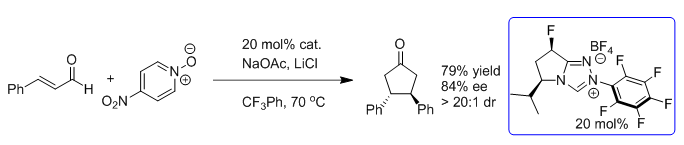
Scheme 7. Breslow中间体的“中产化”历程:β-羟基化反应(二)(图片来源:J. Am. Chem. Soc., 2015, 137, 2416-2419) 2015年,Rovis课题组又将“中产”Breslow中间体应用于3,4-二取代手性环戊酮的合成[8]。在先前报道的β-羟基化反应中[5],作者曾观察到微量的3,4-二苯基环戊酮,通过优化反应条件,可以得到79%的收率和84%的ee值(Scheme 8)。(Oxidatively Initiated NHC-Catalyzed Enantioselective Synthesis of 3,4-Disubstituted Cyclopentanones from Enals. J. Am. Chem. Soc., 2015, 137, 10112-10115)
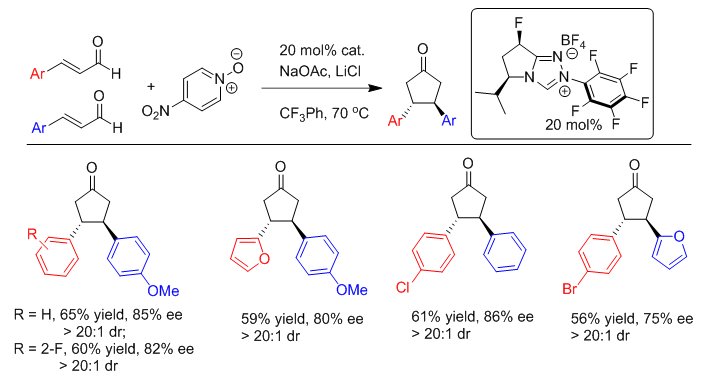
Scheme 8. 3,4-二苯基环戊酮的不对称合成(图片来源:J. Am. Chem. Soc., 2015, 137, 10112-10115) 该反应的底物范围拓展研究表明,β-芳基取代的α,β-不饱和醛都可以很好的参与反应,ee值最高为91%;通过调控不同取代醛的比例,可以得到不同取代基的手性环戊酮(Scheme 9);β-烷基取代的α, β-不饱和醛尚不能参与反应。
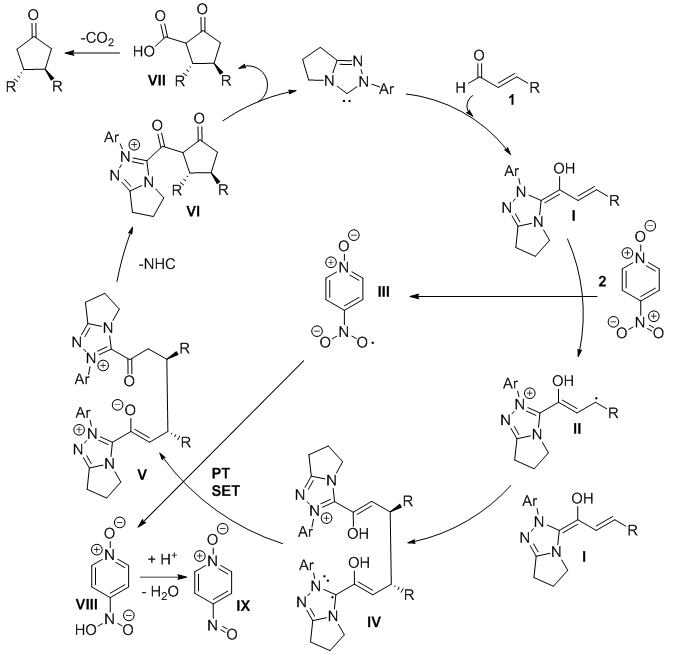
Scheme 9. 3,4-不同芳基取代环戊酮的不对称合成(图片来源: J. Am. Chem. Soc., 2015, 137, 10112-10115) Rovis教授等在β-羟基化反应的基础上,提出Breslow中间体I可以与“中产化”的II发生亲核加成,新晋“中产”IV却继续“遭遇不幸”,再失去一个电子,濒临“破产”的边缘(得到烯醇-酰基铵中间体V)。拥有适当链长的V可以发生分子内的aldol反应得到中间体VI,在水分子的参与下生成乙酰乙酸衍生物VII,最后发生脱羧反应,得到手性环戊酮产物(Scheme 10)。
Scheme 10. 3,4-环戊酮的不对称合成的自由基历程(图片来源:J. Am. Chem. Soc., 2015, 137, 10112-10115) 【小结】 中产阶级应该是社会中最活跃的一个阶层,然而在氮杂环卡宾催化的世界里,一直是“大款”Breslow烯醇-烯胺中间体和“破产阶级”酰基铵正离子的舞台,作为“中产阶级”的自由基正离子却“低调寡言”。直至最近,这个“中产”的身影才被发现,行为独特,难以捉摸,愈发激起了化学家的研究欲望,这或许也正是Chem Is Try的魅力所在吧~ 参考文献: [1] Organocatalytic Reactions Enabled by N-Heterocyclic Carbenes. Chem. Rev.,2015, 115, 9307-9387. http://pubs.acs.org/doi/abs/10.1021/acs.chemrev.5b00060 [2] Electron-Transfer Properties of Active Aldehydes of Thiamin Coenzyme Models, and Mechanism of Formation of the Reactive Intermediates. Chem. Eur. J., 1999, 5, 2810-2818. http://onlinelibrary.wiley.com/doi/10.1002/(SICI)1521-3765(19991001)5:10%3C2810::AID-CHEM2810%3E3.0.CO;2-F/abstract [3] Pyruvate Ferredoxin Oxidoreductase and Its Radical Intermediate. Chem. Rev.,2003, 103, 2333-2346. http://pubs.acs.org/doi/abs/10.1021/cr020423e?journalCode=chreay&quickLinkVolume=103&quickLinkPage=2333&selectedTab=citation&volume=103 [4] Catalysis with N-Heterocyclic Carbenes under Oxidative Conditions. Chem. Eur. J.,2013, 19, 4664-4678. http://onlinelibrary.wiley.com/doi/10.1002/chem.201203707/abstract [5] Enantioselective N-Heterocyclic Carbene-Catalyzed β-Hydroxylation of Enals Using Nitroarenes: An Atom Transfer Reaction That Proceeds via Single Electron Transfer. J. Am. Chem. Soc.,2014, 136, 14674-14677. http://pubs.acs.org/doi/abs/10.1021/ja5080739 [6] N-Heterocyclic Carbene Organocatalytic Reductive β,β-Coupling Reactions of Nitroalkenes via Radical Intermediates. Org. Lett.,2014, 16, 5678-5681. http://pubs.acs.org/doi/abs/10.1021/ol5027415?journalCode=orlef7 [7] N Heterocyclic Carbene-Catalyzed Radical Reactions for Highly Enantioselective β Hydroxylation of Enals. J. Am. Chem. Soc.,2015, 137, 2416-2419. http://pubs.acs.org/doi/abs/10.1021/ja511371a [8] Oxidatively Initiated NHC-Catalyzed Enantioselective Synthesis of 3,4-Disubstituted Cyclopentanones from Enals. J. Am. Chem. Soc.,2015, 137, 10112-10115. http://pubs.acs.org/doi/abs/10.1021/jacs.5b06390 (本文由岐黄柚子茶供稿) X-MOL催化领域学术讨论QQ群(210645329) 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 2 |
【本文地址】
今日新闻 |
推荐新闻 |