“物质的组成、性质、分类 ”知识点归纳 |
您所在的位置:网站首页 › 倒计时一百天图片大全 › “物质的组成、性质、分类 ”知识点归纳 |
“物质的组成、性质、分类 ”知识点归纳
|
②同位素的稳定性
③同位素的性质 a.天然同位素有稳定的百分组成 b.化学性质几乎相同(同种元素的同位素) ④同位素的应用 用作相对原子质量和阿伏加德罗常数的标准 示踪原子:用测岩石的年龄 放射治疗,如等 核能,如等 (3)核素: 具有一定数目的质子和一定数目的中子的一种原子叫做核素。即质子数、中子数不完全相同的一种原子就称为一种核素。 例如:都各自独立称为核素,即10种核素(但属于4种元素) 注意: 同一种元素的不同核素之间互称同位素。 (4)同素异形体 同素异形体:由同种元素所形成的几种性质不同种单质叫做同素异形体。如 (氧气)和(臭氧),红磷(P)和白磷(),金刚石和石墨等。 ①同素异形体的物理性质不同,化学性质相似。 ②性质不同的原因是结构不同或组成不同。 ③同素异形体之间可以相互转化,属于化学变化,但不属于氧化还原反应。如: 2、原子 ①原子是化学变化中的最小粒子。确切地说,在化学反应中,原子核不变,只有核外电子发生变化。 ②原子是组成某些物质(如金刚石、晶体硅等)和分子的基本粒子。 ③原子是由更小的粒子构成的。
④原子的概念是古希腊哲学家德谟克利特从哲学的角度首先提出来的。1803年英国化学家道尔顿提出了原子说。目前人类对原子结构的认识正在不断地深入。 注意: 化学反应的本质就是原子的重新排列和组合。 表1:原子与元素的联系与区别 原 子 元 素 联 系 具有相同核电荷数的同一类原子总称元素元素的最小基本微粒为原子 区 别 概 念 微观概念,化学反应中原子核不改变,而电子层结构可能发生变化 宏观概念,化学反应中元素种类不改变 分 类 根据质子数和中子数分 根据质子数分 应 用 说明物质的微观构成 说明物质的宏观组成 含 义 既有种类含义又有数量含义 只有种类含义 3、离子 离子是指带电荷的原子或原子团。 ①离子的种类 ②离子的生成途径 ③存在离子的物质
注意: 在金属晶体中只有阳离子,而没有阴离子。分子、原子、离子均是组成物质的基本粒子,是参加化学反应的基本单元,是化学研究的微观对象。 4、分子 分子是能够独立存在并保持物质化学性质的一种粒子。完整理解分子的概念,应包括以下几个方面。 ①分子是一种粒子,它同原子、离子一样是构成物质的基本粒子。如:水、氧气、干冰、蔗糖等就是由分子组成的物质。 ②分子有质量,其数量级约为。 ③分子间有间隔,并不断运动着。 ④同种分子的性质相同,不同种分子的性质不同。 ⑤每个分子一般是由一种或几种元素的若干原子按一定方式通过化学键结合而成的。 ⑥按组成分子的原子个数,可把分子分成
⑦分子间存在相互作用,此作用称作分子间作用力(又称范德华力)。它是一种较弱的作用力。 二、物质的分类
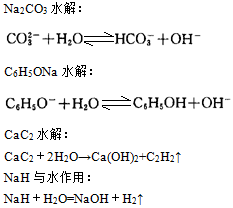
(一)混合物与纯净物 1、从宏观上讲,纯净物是由一种物质组成的。混合物是由多种物质组成的;从微观上讲,对于由分子构成的物质,纯净物只有一种分子,而混合物有多种分子。 在判断是混合物还是纯净物时,可以从有无固定熔沸点考虑,一般来说,纯净物有固定的熔沸点,而混合物由于组成物质的成分和量的多少不固定,致使没有固定的熔沸点。见下表: 表2:纯净物与混合物比较 纯净物 混合物 组 成 有固定组成,组成这种物质的各元素有一定的比例关系 没有固定组成,混合物中每种物质的含量可以任意调配 性 质 有固定的物理性质和化学性质 没有固定的性质,混合物中每种物质仍然保持着原有的性质 分 离 不能用物理方法将组成纯净物的各元素分开,只能通过化学方法才能达到分离各元素的目的 可用物理方法将混合物中各物质分离开来 2、常见的混合物包括: (1)高分子化合物(如蛋白质、淀粉、纤维素、聚合物等); (2)分散系(包括溶液、胶体、浊液) (3)同分异构间的混合体(如二甲苯总是混合物,含邻、间、对三种) (4)同素异形体间的混合体 (5)其他 ①氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、盐酸、浓硫酸; ②爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气; ③钢、生铁、普钙、漂白粉、碱石灰、黑火药、铝热剂、水泥、铁触媒、玻璃、煤; ④煤焦油、石油及其各种馏分、植物油和动物油。 (二)单质与化合物 单质:由同种元素组成的纯净物叫做单质。如:,金刚石(C),铁(Fe)等,HD也属于单质。 化合物:由不同种元素组成的纯净物叫做化合物。从不同的角度,化合物可以分成多种类型,如离子化合物和共价化合物;无机化合物和有机化合物;酸、碱、盐和氧化物等。 1、酸 酸:电离理论认为,电解质电离产生的阳离子全部是H+的化合物叫做酸。如: 注意: (1)酸与酸性不同,酸性是指酸所具有的性质或溶液的pH<7的性质。具有酸性的物质可以是盐、氧化物、单质的水溶液,如 的水溶液显酸性,但这些物质显然不是酸。
(2)酸的强弱与酸性的强弱。 酸的强弱是物质本身的属性,是指酸电离出的能力,与成酸核心元素的非金属强弱、价态、结构等因素有关。对于含氧酸一般非金属性越强,价态越高,酸越强。如: ① ②
对于同族的非金属元素形成的非含氧酸,其非金属越强则酸越弱。如酸性: 而酸性强弱是指水溶液中c(H+)大小,c(H+)大,则溶液的酸性强,c(H+)小,则酸性弱。 (3)酸、碱的概念是发展、变化着的,目前有四种关于酸碱的理论。理论不同,酸、碱的定义、范围、性质也不尽相同。 2、碱 碱:电离理论认为,电解质电离时产生的阴离子全部是 的化合物叫做碱。金属氧化物对应的水化物一般是碱。金属性越强,碱性越强。 常见的碱有:。溶液显碱性的本质是c(OH—)>c(H+),溶液呈碱性的原因有: (1)碱溶于水电离 (2)碱性氧化物与水反应生成碱 (3)金属过氧化物与水反应 (4)某些物质水解
(5)电解某些盐溶液 (6)活泼金属与水反应
3、盐 盐:电离时生成金属离子和酸根离子的化合物叫做盐。 (1)盐可以理解为是酸和碱中和后生成的一种较稳定的物质,在自然界中,盐是各种元素的主要存在形式。盐是化学反应时的常见生成物。 (2)从形成盐的酸碱的强弱,盐可分为:
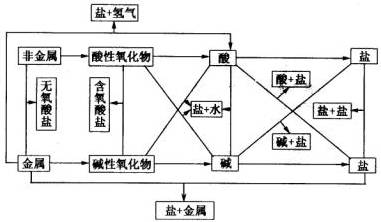
(3)盐的一般分类 正盐:酸碱完全中和后的生成的盐。如:等。 酸式盐:酸中氢被部分中和后生成的盐。如:等。 碱式盐:碱中氢氧根被部分中和后的生成物。如:等。 复盐:电离时产生两种或两种以上金属阳离子(其中一种也可以是铵离子)的盐。如:等。 (4)盐的一般性质 ①绝大部分盐是离子化合物,是强电解质; ②钠盐、钾盐、铵盐、硝酸盐都易溶于水; ③盐的绝大部分在通常情况下是晶体(固体); ④盐溶液可显中性、酸性或碱性。 4、氧化物 氧化物:由两种元素组成,其中一种元素是氧元素的化合物叫做氧化物。如等,而因含三种元素,不属于氧化物,可称为含氧化合物。 氧化物的分类 (1)按组成元素分成 ①金属氧化物:CaO… ②非金属氧化物:… (2)按化学性质分成 ①碱性氧化物:CaO… ②酸性氧化物:… ③不成盐氧化物:CO,NO… ④过氧化物: ⑤两性氧化物:… 单质、酸、碱、盐、氧化物间的转化
三、物质的变化和性质
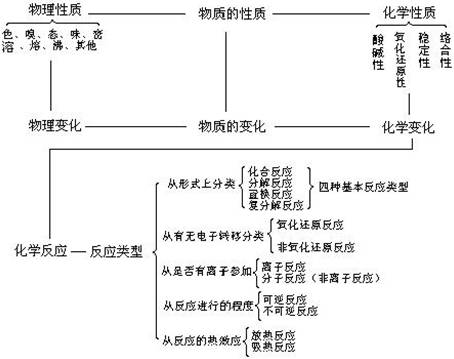
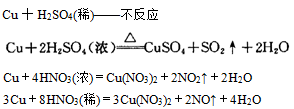
1、物理变化与化学变化 (1)物理变化: 没有生成其他物质的变化。即物理变化仅是物质形态的变化。如:水的三态转化,石油的分馏,用萃取碘水中的碘。物理变化过程中可能发生化学键的断裂或者形成化学键,如食盐晶体熔化时就是破坏晶体中的离子键,而液体NaCl降温变成晶体时,又形成了离子键。 (2)化学变化: 变化时生成其他物质,这种变化叫做化学变化。又叫化学反应。与物理变化相比,化学变化有以下特征: ①有新物质生成 ②常伴有放热、发光、变色、发声等现象 ③变化的本质是:旧键断裂、同时新键形成。如:石油裂化,煤干馏,胃内消化食物等。 化学变化过程的同时也发生了物理变化。例如,点燃蜡烛时,石蜡受热熔化是物理变化,石蜡燃烧生成和是化学变化。 2、物理性质与化学性质 物理性质:物质不需要发生化学变化就表现出来的性质,叫做物理性质。如颜色、状态、气味、溶解性、熔点、沸点、硬度、密度等。物理性质是物质本身的一种属性,一般指不涉及物质化学组成改变的一类性质。 化学性质:物质在化学变化中表现出来的性质叫做化学性质。化学性质也是物质本身的一种属性,是化学研究的主要对象之一,是学习化学的主要内容。 (1)化学性质主要包括 ①氧化性、还原性 ②酸性、碱性 ③稳定性 ④络合性 (2)影响化学性质的因素 ①物质结构。结构是影响化学性质的最重要因素,结构决定物质的主要化学性质。结构包括:原子结构、分子结构、离子结构、晶体结构等。 ②物质的浓度对化学性质也有影响,如浓与稀的性质不同,浓与稀的性质不同等。
表3:物理变化和化学变化的区别与联系
注:知识点若与教材有出入,请以教材为准。 学习方法:
|
【本文地址】
今日新闻 |
推荐新闻 |



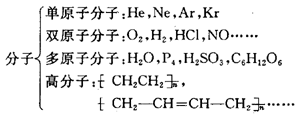

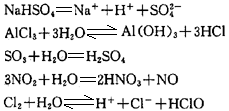
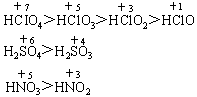
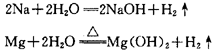
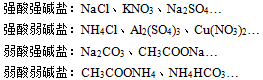

 返回搜狐,查看更多
返回搜狐,查看更多