指南·标准·共识│儿童呼吸道感染微生物检验标本采集 转运与检测建议(细菌篇) |
您所在的位置:网站首页 › 保护毛刷 › 指南·标准·共识│儿童呼吸道感染微生物检验标本采集 转运与检测建议(细菌篇) |
指南·标准·共识│儿童呼吸道感染微生物检验标本采集 转运与检测建议(细菌篇)
|
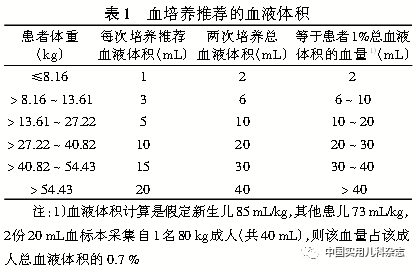
2.3 痰液 所有痰标本都会受到口咽部分泌物不同程度的污染,为减少污染菌的数量,对于能咳痰的年长儿,应向患儿解释痰和唾液的区别,指导患儿晨起清洗口腔或清水漱口3次,让患儿咳前深吸气,用力咳出呼吸道深部的痰液,尽量避免混入口腔、鼻咽分泌物。有研究表明,经过简单指导可显著增加所获取的痰液标本质量,减少工作量和成本[2]。咳出的痰液应收集到灭菌、有盖的一次性容器,为方便标本采集,容器最好为广口。对于婴幼儿或年龄较小不会咳痰的患儿,常用鼻咽吸取物代替痰液。将无菌吸引管连接到无菌收集容器,将吸痰管轻轻由鼻孔插入至鼻咽部,调节负压开始吸引,吸取物置入无菌收集容器内,立即加盖密封,及时送检。 2.4 BALF 支气管肺泡灌洗前要先评估临床状态, 严格遵循支气管镜检查的相关要求。患儿在静脉麻醉或局部麻醉后, 导入支气管镜; 常规检查气道形态后, 在活检、 刷检前进行支气管肺泡灌洗。病变局限者选择病变段灌洗, 病变弥漫者选择右肺中叶或左肺上叶舌段灌洗[3-4]。支气管镜顶端嵌顿在目标支气管段或亚段开口后, 根据儿童年龄, 经操作孔道每次将5~20 mL 37℃或室温无菌生理盐水(1 mL/kg)快速注入相应肺段[5], 并用吸引器以100 mmHg(1 mmHg=0.133 kPa)的负压将液体抽回, 如此共灌洗3~4次, 总回收率≥30 % 为宜[6]。通常儿童回收量不超过10 mL, 如果采集量>10 mL, 将标本离心可提高培养和涂片的阳性率[7]。用于病原学分析的标本须用无菌容器收集, 密封后送检, 细胞学分析的标本须选择硅化的塑料容器或玻璃容器以减少细胞的黏附。 2.5 气管吸取物 对于经气管切口或气管插管的患儿,采用无菌吸痰管小心地插入导管至气管,直到遇到阻碍,将导管抽回1~2 cm,使用间歇吸引装置从气管吸取标本,直接导入无菌收集容器,密封容器,及时送检。 2.6 血液 血培养标本的采集时间和培养频次取决于患儿的临床状况。很多病原菌感染时,菌血症是间歇性的,并且可能早于发热1 h,这使得血标本收集时间尤为重要。选择能覆盖更多病原的培养系统或增加采血量可能有助于减少培养频次。多数情况下,相同时间内两个部位的两份血培养标本已经足够,24 h以内是否需要收集第二套血培养标本取决于儿童年龄和临床病情。采样时,去掉培养瓶外部的封条和盖帽,用预备的消毒酒精棉球擦拭橡胶塞待酒精晾干;触寻一条静脉确定穿刺点;用碘伏棉签由穿刺点中心向外擦拭消毒,再用蘸酒精的棉拭子用同样方式擦拭一遍,等30~60 s待皮肤上的酒精晾干;勿再次触摸擦拭部位,用注射器抽血,然后将血液分装到需氧和厌氧两个培养瓶中;最后将瓶口或瓶身的血迹擦净。儿童血液培养分离菌株的采血量要求为20~30 mL,尽量每套>10 mL,每瓶>5 mL;对婴幼儿和儿童一般采血1~5 mL用于血培养。当细菌浓度足够高时,血量<1 mL也足以检测出菌血症[8]。感染患儿血量增加,细菌量随之增加,但由于人体血液中包含各种抑制细菌生长的因子,血量增加的同时抑制因子亦增加,因此血培养采血量应适宜,一般推荐血液和肉汤体积比保持在1∶5至1∶10之间[9]。小体积的血培养标本也应及时送检,但有可能延迟检测出阳性结果。表1介绍了血培养时根据患者体重以及患者总血量相应的百分比推荐的采血量[10]。
2.7 胸腔积液 胸腔积液标本由临床医生行胸腔穿刺术采集,或在胸腔闭式引流术中或术后采集。如应用胸腔镜取活检组织和采集胸腔积液,应先采集积液再取活检组织,避免活检给积液带来影响。操作过程严格遵守无菌要求。留取的胸腔积液标本应置于密闭无菌的抗凝试管并及时送检,可防止标本凝块形成、细胞变形及细菌自溶等。为提高胸腔积液培养的阳性率,可采集一定量的标本注入血培养瓶进行增菌培养。 3 标本的标识和转运 3.1 装置、容器和培养基 用于培养的呼吸道、血液和胸水标本, 应当用指定的无菌管或运输瓶; 若标本延迟送检或远距离送检,必须使用转运培养基。某些特殊病原菌如百日咳鲍特菌、糠秕马拉色菌培养等需要特殊的技术和收集装置,实验室常规储存的高营养或选择性培养基并非以上特殊病原菌的合适培养基。为更有利于微生物检验, 临床医生应与微生物实验室人员沟通, 准备特殊的装置或培养基,采用特殊的方式采集微生物标本。 3.2 标识 标签应选择放入冰箱后仍能粘牢的材料,且应贴在容器上,而非容器盖上。标签上所提供的信息应至少包括(但不限于)下列内容:(1)患者姓名或患者惟一性标识;(2)标本采集日期和时间;(3)检验项目;(4)标本类型。 3.3 转运和送检 呼吸道标本应在采集后1~2 h内迅速送至实验室,如果不能按时送达,则需要特殊的保存培养基或在冷藏条件下转运,而且应保证标本在24 h 内接种到细菌培养基上。某些呼吸道感染的细菌如流感嗜血杆菌、肺炎链球菌、百日咳鲍特菌等对周围环境特别敏感,对这些标本立即处理才能获得可靠结果。在转运培养基保存条件下,超过6 h未处理标本时,会导致菌落形成单位减少。如果延迟时间更长,即使使用了转运培养基,也会导致微生物的大量丢失。在转运培养基中超过6 h未处理的标本,冷藏能提高细菌存活,但流感嗜血杆菌、肺炎链球菌等对于低温环境很敏感,标本低温保存后接种可能造成漏检。采集的标本应置于防漏、有盖并标有患儿基本信息及检测码的无菌容器内。血培养标本应室温保存,不宜冷藏。特殊情况可用注射器运送,但严禁将针头暴露,应用无菌塞子堵住,放在密封、防漏的塑料袋中,装入运送箱中运送。 4 实验室标本核查 微生物实验室可能会拒收没有达到筛选、收集、运输等检验要求的标本,包括:(1)常温条件下标本采集至实验室接收时间超过2 h,或无标本采集时间,或保存的温度不当;(2)标本运送条件不正确,如厌氧培养未隔绝空气送检;(3)容器不规范,如容器有裂缝或被打破导致标本泄露、非无菌容器送检等;(4)未贴标签或贴错标签,标本与检验目的不符合,如痰培养送检尿标本;(5)标本明显被污染,如痰标本中混有食物残渣等,未经保护套收集的支气管刷检标本;(6)拭子上的标本已经干涸;(7)标本不符合检验要求,如痰标本以唾液为主,鼻冲洗物和分泌物、鼻拭子、痰液等做厌氧菌培养;(8)标本使用了固定剂或防腐剂;(9)标本量太少;(10)要求检验项目太多;(11)24 h内重复送检的标本(血培养除外)[11]。 另外要注意的还有: (1)除气管吸取物、 经支气管镜防污染保护毛刷采集的分泌物经双层套管保护进行床边接种(厌氧培养)、 活检标本、 胸腔积液或其他未经污染的标本外, 其他标本均不适合做厌氧培养; (2)诱导痰标本只适用于检测卡氏肺孢子菌和结核分枝杆菌, 对其他病原菌检出效果差。 5 标本的储存 保存标本、分离菌株是良好的实验室行为,是深入开展常规和研究性工作所必须的。条件具备时,建议:(1)所有标本4 ℃短期保存,如报告发出后再保存1周或3 d;(2)正常无微生物部位液体标本长期保存;(3)所有阳性培养物短期保存,如发出报告后保存3 d;(4)除国家规定的需要销毁、上交的分离株外,所有分离株长期保存(-70 ℃以下);(5)追加实验时,要注明可能影响相应检查的原因、程度、趋势和相应建议等。 6 细菌培养方法和结果解读 6.1 分离和鉴定 6.1.1 链球菌属 (1)β溶血链球菌是呼吸道重要的致病菌,应重点观察血平板上有β溶血的菌落,血平板的质量非常关键,否则难以观察到菌落的透明溶血现象;(2)对肺炎链球菌需鉴别草绿色链球菌,检查形态与肺炎链球菌相似的α溶血菌落,可通过胆汁溶菌试验、奥普托辛敏感试验、药敏试验进行鉴别。但存在对胆汁耐受或对奥普托辛耐药的肺炎链球菌菌株,将这两个试验联合检测可减少错误报告。 6.1.2 苛养革兰阴性杆菌 (1)流感嗜血杆菌:采用卫星试验法或Ⅹ、 Ⅴ因子生长法判断流感嗜血杆菌。流感嗜血杆菌分离株应检测其是否产β内酰胺酶。(2)鲍特菌属:有重要临床意义的鲍特菌在特殊培养基上生长,触酶和脲酶均为阳性,培养48 h出现肉眼可见菌落。(3)其他苛养革兰阴性杆菌:除非呈优势生长或数量很多,通常无需鉴定其他苛养的革兰阴性杆菌,因这些均为上呼吸道正常菌群,很少引起呼吸系统疾病。 6.1.3 革兰阴性双球菌 有临床意义的革兰阴性双球菌,主要是卡他莫拉菌和脑膜炎奈瑟菌,可采用快速筛查试验筛查:(1)检测到有意义数量的、用接种环可推移的菌落, 且DNA酶阳性, 确认是卡他莫拉菌(90%以上卡他莫拉菌株的β内酰胺酶试验为阳性,可帮助判断[12]);(2)检查巧克力平板上任何氧化酶阳性的菌落,且该菌落在血平板上不生长或生长不良,葡萄糖(+)、麦芽糖(+)、乳糖(-),确认是脑膜炎奈瑟菌,无需常规做药敏试验。 6.1.4 革兰阴性杆菌 在麦康凯或中国蓝平板上生长良好的革兰阴性杆菌,依照以下快速试验筛查:(1)若只生长了1种细菌并达到了有临床意义的数量,而无其他致病菌,通过初步试验筛查,此菌若为肠杆菌科细菌特别是肺炎克雷伯菌,需做鉴定和药敏试验;(2)对于住院患者,不管是否有其他病原菌,检查到有意义数量的铜绿假单胞菌、鲍曼不动杆菌、洋葱伯克霍尔德菌和嗜麦芽窄食单胞菌, 需做鉴定和药敏试验, 因这些菌多是典型的多重耐药菌, 可造成医院内流行; (3)若生长1种以上其他等量的革兰阴性杆菌, 做初步试验, 并报告具体试验结果(如吲哚、氧化的、在麦凯平板上的气味和形态、菌落色素和克氏双糖试验的结果)。 6.1.5 葡萄球菌属 对培养生长的葡萄球菌属的处理方法如下:(1)若革兰染色显示占优势的成堆球菌与白细胞相关,而无其他有意义数量的致病菌,只对有临床意义数量的金黄色葡萄球菌进行鉴定;(2)若是住院患者,依照感染控制原则,即使少量菌也应用头孢西丁检测苯唑西林是否耐药;(3)仅当凝固酶阴性葡萄球菌在平板上几乎为纯培养时,才需鉴定到种水平和(或)做药敏试验,其他葡萄球菌均为呼吸道正常菌群。 6.1.6 肠球菌属 对培养生长的肠球菌属的处理方法如下:(1)一般情况下,少量生长的肠球菌无需报告,当生长几乎为纯培养时,用初步生化试验鉴定确认;(2)很多革兰阳性球菌是呼吸道正常菌群,吡咯烷酮芳基酰胺酶(L-Pyrrolidonyl-β-naphthylamide,PYR)阳性甚至胆汁七叶苷和亮氨酸肽酶(leucine aminopeptidase,LAP)阳性。 6.1.7 革兰阳性杆菌 只对以下培养生长的革兰阳性杆菌处理,因其他革兰阳性杆菌通常不引起肺炎:(1)筛查并排除任何数量的来自免疫抑制患者的奴卡菌属和马红球菌(黏液样菌落、 脲酶阳性); (2)如有大的革兰阳性芽孢杆菌, 需排除炭疽芽孢杆菌和蜡样芽孢杆菌;(3)有限地鉴定棒状杆菌。当下述两种情况存在且细菌呈大量优势生长时,使用鉴定革兰阳性杆菌的商品试剂盒进行鉴定: 菌株快速脲酶试验阳性(假白喉棒杆菌、 假结核棒杆菌脲酶阳性); 标本来自重症监护病房(ICU)的插管患者。 6.1.8 涂片可见但培养不生长的细菌 如涂片时可见细菌,但培养后未见此形态的细菌生长,可能因使用了抗菌药物;但不能排除可能存在军团菌、百日咳鲍特菌和分枝杆菌等。实验室应及时与临床联系,扩大病原检查范围。 6.2 结果解读 6.2.1 应报告的病原菌 培养分离到化脓性链球菌、B族β溶血性链球菌(儿童)、鲍特菌属,特别是支气管脓毒鲍特菌、奴卡菌属、新生隐球菌、土拉弗朗西斯菌(高致病菌)、鼠疫耶尔森菌(高致病菌)、炭疽芽孢杆菌(高致病菌)、丝状真菌(排除腐生菌污染)均作为下呼吸道致病菌报告。 6.2.2 培养和涂片相符合时报告的病原菌 处理培养物应参考涂片的结果,应根据革兰染色所见炎症细胞和细菌的形态与培养物进行对照,当培养与涂片结果不相符时应重新读片。当培养生长的细菌在涂片中和炎症细胞相关时,报告以下两种病原菌:(1)肺炎链球菌,并报告药敏结果;(2)流感嗜血杆菌,常规报告产β内酰胺酶检测结果。 6.2.3 判断有临床意义数量的分离菌 以下情况可判断分离菌的数量具有临床意义:(1)定性培养生长的病原菌在平板第2区划线仍大量生长,或培养物生长量超过1/4平板;或培养中少量生长且革兰染色涂片可见此形态细菌与炎症细胞相关联的病原菌;或在平板划线第1区生长且纯度超过90%以上时,同时革兰染色涂片可见此形态细菌与炎症细胞相关的病原菌,判断为有临床意义;(2)BALF定量培养菌落计数≥107 CFU/L,经支气管镜防污染保护毛刷采集的分泌物定量培养菌落计数≥106 CFU/L,判断为有临床意义。 6.2.4 报告有临床意义数量的非优势菌 当培养的某些细菌达到上述所示有临床意义的数量时,即使不是优势菌也应报告的病原菌包括卡他莫拉菌、脑膜炎奈瑟菌。而住院患者培养到铜绿假单胞菌、嗜麦芽窄食单胞菌、不动杆菌属(特别是鲍曼不动杆菌)、洋葱伯克霍尔德菌均应报告,并做药敏试验。 6.2.5 报告有临床意义数量的优势菌 金黄色葡萄球菌、分离自成人患者的B族β溶血性链球菌(儿童患者只要分离到该菌,即应考虑为致病菌)、C族或G族β溶血性链球菌、单一形态革兰阴性杆菌(特别是肺炎克雷伯菌)、苛养的革兰阴性杆菌、脲酶阳性的棒状杆菌或分离自ICU患者的棒状杆菌、分离自免疫抑制患者的马红球菌,以上菌株生长到有临床意义的数量并呈优势菌时,特别当涂片提示分离菌与多形核白细胞相关时均应报告,同时报告药敏结果。 6.3 对非致病菌的报告 当培养出2种以上的革兰阴性杆菌,实验室只须初步鉴定和报告“肠杆菌科细菌”或“非发酵革兰阴性杆菌”,并不代表有临床意义,应该是定植菌。 6.4 平板上无细菌生长 如平板上无任何细菌生长,报告“无细菌生长”。出现此种情况的原因可能是使用抗菌药物抑制了正常菌群[12-13]。 7 其他检测方法 7.1 呼吸道标本细菌涂片 痰涂片革兰染色后在低倍镜下视野(low power field,LPF)检测20~40 个视野,气管吸取物涂片分别在LPF和油镜视野(oil immersion field,OIF)下观察,计算有细胞视野的细胞平均数量,分别记录鳞状上皮细胞(squamous epithelial cells,SECs)、多形核白细胞(polymorphonuclears,PMNs)和细菌的数量,详见表2、表3[12,14]。
7.2 肺炎链球菌尿抗原检测 肺炎链球菌尿抗原检测对有全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)表现的成人重症社区获得性肺炎患者具有高特异度、中灵敏度和快速等优势,使患者能尽早接受特定的抗菌药物治疗,且不受前期抗菌药物治疗的影响[15]。但由于儿童鼻咽部定植菌较多,在儿科使用还需要更多研究。 7.3 核酸检测 逆转录-聚合酶链反应(reverse tranion polymerase chain reaction,RT-PCR)是将RNA反转录和cDNA聚合酶链反应相结合的技术,可用于细菌等核酸检测。荧光定量PCR灵敏度高,特异度更高,重复性好。很多呼吸道样本可以通过核酸扩增检测到病原微生物及鉴定耐药基因,数小时内得到检测结果。环介导等温扩增(loop mediated isothermal amplification,LAMP)检测技术是恒温扩增技术。其具有恒温扩增、高特异度、高灵敏度、快速的优点,可实现早期、准确诊断,以便临床采取有效的早期干预和治疗措施。核酸序列依赖性扩增(nucleicacid sequence-based amplification,NASBA)同LAMP一样,是PCR基础上的一种恒温扩增技术。基因芯片可以一次检测多种病原微生物,不仅可进行病原微生物种、亚种、型的识别,同时可了解病原微生物的致病基因和耐药基因,以及寻找新的病原微生物。目前基因芯片主要用于科研,要从实验室研究推向临床应用还有一系列问题需要解决。 7.4 高通量的宏基因组测序 全基因组测序是对感染性疾病病原体的大规模核酸分析,可提供极为丰富的信息,对于未知病原体的发现具有不可比拟的优势,是分子生物学诊断的研究热点。 7.5 基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ ionization time of flight mass spectrometry,MALDI-TOF-MS) 该方法通过比较试验菌株和已知标准株的质量峰,进而分析细菌的16 S核糖体蛋白,能够在20 min内完成鉴定。MALDI-TOF-MS提供了一种快速鉴定方法,可使随后的治疗方案更加准确并及早启动。目前,这一方法正逐步应用于临床,用于各种感染性标本细菌病原的快速鉴定[16]。 8 生物学安全 标本处理和操作应在生物安全二级实验室(BSL-2)内进行;涉及气溶胶的步骤应在生物安全柜内进行操作;实验所用离心机应带盖,离心后标本在生物安全柜内操作。 其他参照《儿童呼吸道感染微生物检验标本采集 转运与检测建议(病毒篇)》。 参考文献 (略) (2018-08-02收稿)返回搜狐,查看更多 |
【本文地址】