NAT REV GENET |
您所在的位置:网站首页 › 何为密码子 › NAT REV GENET |
NAT REV GENET
|
原创 存在一棵树 图灵基因 今天 收录于话题 前沿分子生物学机制 撰文:存在一棵树IF=33.133推荐度:⭐⭐⭐⭐⭐亮点回顾了非典型氨基酸蛋白质合成的体内遗传密码子重编程的进展,重点概括了遗传密码子的扩展方法与翻译过过程。  2020年12月14日,英国剑桥大学医学研究理事会分子生物学实验室的Jason W.Chin与Daniel dela Torre在《Nature Reviews Genetics》上发表了一篇名为“Reprogramming the genetic code”的综述。该篇综述回顾了遗传密码子的扩充背景、方法以及近3年来的飞速进展。  编码蛋白质的生物合成为高保真长聚合物的合成提供了完美范例,但其序列和组成已确定,仅限于聚合20个典型氨基酸。而现在通过遗传密码子扩展,可以将数百种不同的非典型氨基酸(ncAA)进行特定于位点的共翻译,从而将其整合到细胞和动物体内合成的蛋白质中,以实现几种不同的非规范氨基酸的编码掺入。最初大多数遗传密码子扩展实验都致力于一次性将单种氨基酸掺入蛋白质,通常是响应琥珀终止密码子;现在,新的研究正在将多种不同的ncAA整合到蛋白质中,以实现遗传密码的整体重编程和非典型生物聚合物编码生物合成的细胞翻译。 如图1所示,细胞内合成蛋白质,翻译过程除了需要氨基酸之外,还需要密码子与转运RNA(tRNA)。而创建新的密码子,首先需要找到细胞中不用于蛋白质翻译的密码子,将其重新分配给ncAA;其次每个新密码子都需要匹配一个tRNA,即需要匹配一个氨酰基-tRNA合成酶(aaRS / tRNA),且一种aaRS / tRNA只能识别一种ncAA,且不能识别典型氨基酸。  目前遗传密码子的扩展方法分为创建新的密码子与有义密码子的压缩两类。其中创建新密码子的方法有以下两种。 1) 四联体密码子:常规密码子为三联体,因此可将256个四联密码子分配给ncAA。但大多数四联密码子不能被天然核糖体解码,且自然翻译的四联体密码子可能会介导蛋白质错误合成或产生毒性,因而开发出正交核糖体(ribo-Q)可有效解码其同源正交mRNA上的四联密码子和琥珀密码子,同时开发出具有反密码子茎环的吡咯基-tRNAs及其相应的合成酶也进一步提高了ncAA掺入蛋白质的效率。 2) 非天然碱基对密码子:开发出既不是核苷酸也不是碱基的成对“合成核苷酸”和“非天然碱基”,可通过各种非共价相互作用而碱基配对,包括氢键、形状互补、金属离子螯合、疏水性堆积和交叉嵌入。如图2所示,为在非天然碱基,脱氧核苷三磷酸(dXTP和dYTP)培养环境下的特异大肠杆菌,其表达脱氧三磷酸转运蛋白及相应的aaRS / tRNA,其经转录可产生含有非天然碱基的mRNA,也可制备含有非天然碱基的tRNA,随后核糖体翻译结合ncAAs,成功将其掺入蛋白质。 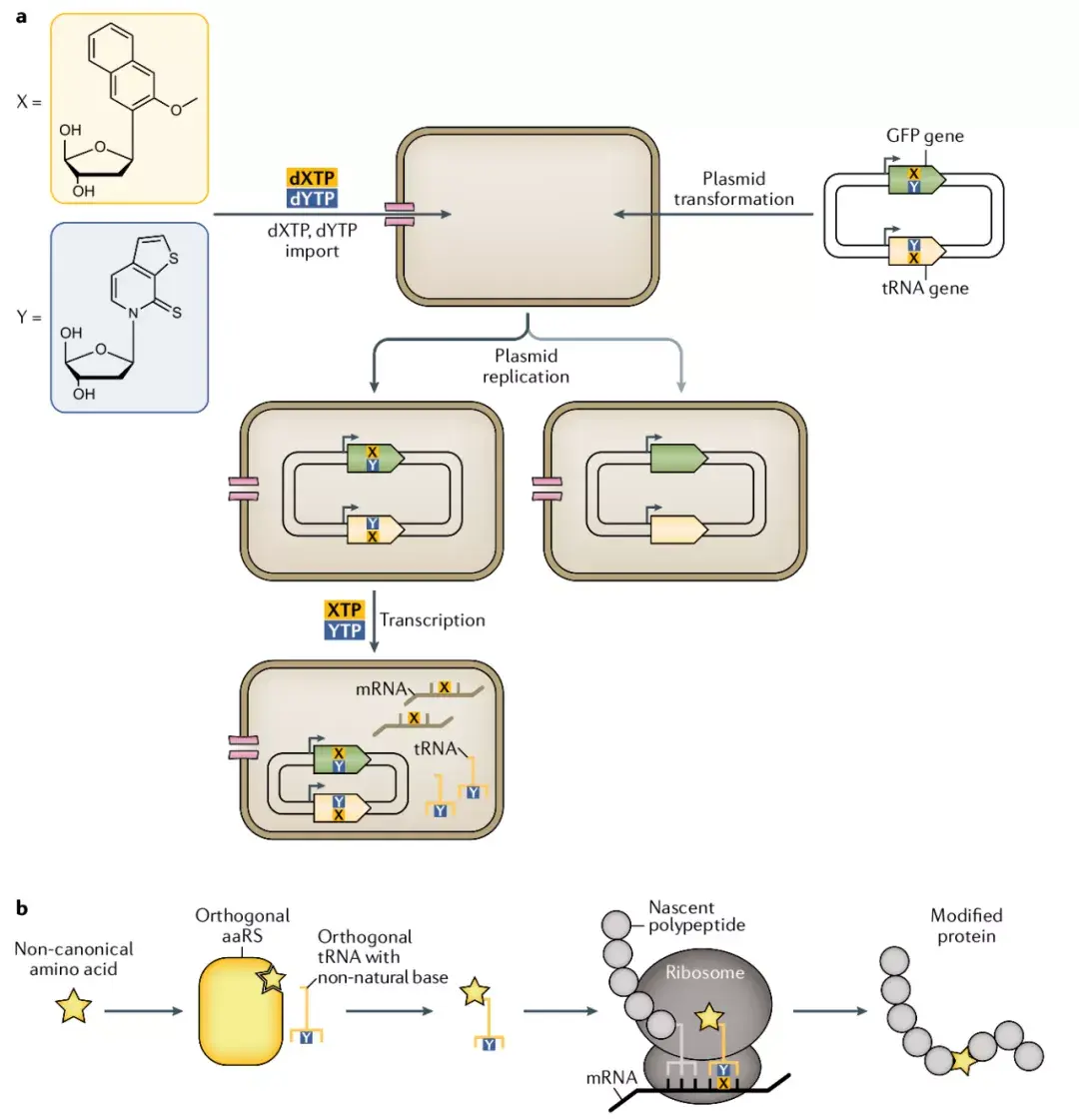 有义密码子压缩分为可变同义密码子压缩与定义同义密码子压缩,即通过删除多余与同义密码子匹配的tRNA,并将密码子重新分配给ncAA,匹配ncAA的tRNA,即可实现遗传密码的重编程。由于同义密码子已牵涉mRNA二级结构的形成,缺乏二级结构的mRNA可能会导致有毒蛋白质的产生,因此如果能达到在全基因组范围内耐受,则可以实现同义密码子压缩。 1)可变同义密码子压缩:基于预测的局部特征(mRNA二级结构\核糖体结合位点和密码子适应性)的最小破坏决定每个基因组位置的同义密码子替换,可能在不同基因种相同密码子编码不同的ncAA。目前可变同义密码子的压缩方案研究表明并非所有的取代都可以被容忍,且还不知道如何设计在全基因组范围内可以容忍的可变方案。 2)定义同义密码子压缩:对同义密码子进行重新定义,即删除同义密码子匹配的tRNA,并将密码子重新分配给固定对应的ncAA。目前定义同义密码子压缩研究表明,某些同义密码子压缩方案最多可以容忍已测试的位置,此种策略需研究数量较少,可通过实验探索完成(与可变方案不同),并且每个方案都将目标密码子在所有位置更改为单个ncAA,从而在不同位置观察到的差异可以明确地对应序列上下文,视为较良好的策略。 当遗传密码子扩展后,若想成功合成含有ncAA的蛋白质,则tRNA种类与核糖体功能应与之一同进化。目前已经可以合成出相互正交的aaRS / tRNA对,其具有足够的特异性使在单细胞的蛋白合成中掺入不同的ncAA成为可能。细菌核糖体的小亚基包含16S rRNA,大亚基包含23S rRNA,若能创建大亚基和小亚基彼此相互作用但不与内源性大小亚基相互作用的正交核糖体则利于在蛋白合成中掺入ncAA。如图3所示,在大肠杆菌种,通过非结构化双链RNA链将小亚基的16S rRNA与大亚基的环状排列的23S rRNA连接或自剪接内含子的结构化RNA铰链产生活性核糖体,通过嵌合体16S rRNA部分的突变可以定向到正交信息,从而成功合成含有ncAA的蛋白质。  尽管在用于编码非典型氨基酸蛋白质合成的细胞工程方面取得了令人振奋的进展,但仍然存在许多挑战,包括创建大量有用的正交密码子,以足够的效率和保真度被读取;也需要创建一套相互正交的aaRS / tRNA系统以进行解码这些密码子与ncAA结合,从而扩展化学细胞翻译的范围。 教授介绍  Jason Chin,博士,目前是医学研究理事会分子生物学实验室(MRC-LMB)的项目负责人,也是化学与合成生物学中心(CCSB)的负责人,任职剑桥大学化学与化学生物学教授,还是剑桥三一学院的自然科学研究员。本科毕业于牛津大学,以富布赖特奖学金获得者的身份在耶鲁大学获得博士学位,与Alanna Schepartz教授一起研究微型蛋白质的设计和进化;后在Peter Schultz教授在斯克里普斯研究所任职达蒙·鲁尼研究员,开发了第一种可系统地扩展真核细胞遗传密码的方法。现其实验室的研究方向包括:模型生物的遗传密码扩展、光化学遗传学、蛋白质标记和成像、翻译后修饰、重新编程翻译。 参考文献1、de la Torre, D., Chin, J.W. Reprogramming thegenetic code. Nat Rev Genet (2020). |
【本文地址】
今日新闻 |
推荐新闻 |