JACS:自由基取代合成不对称二硫键 |
您所在的位置:网站首页 › 二硫键是什么键 › JACS:自由基取代合成不对称二硫键 |
JACS:自由基取代合成不对称二硫键
|
JACS:自由基取代合成不对称二硫键
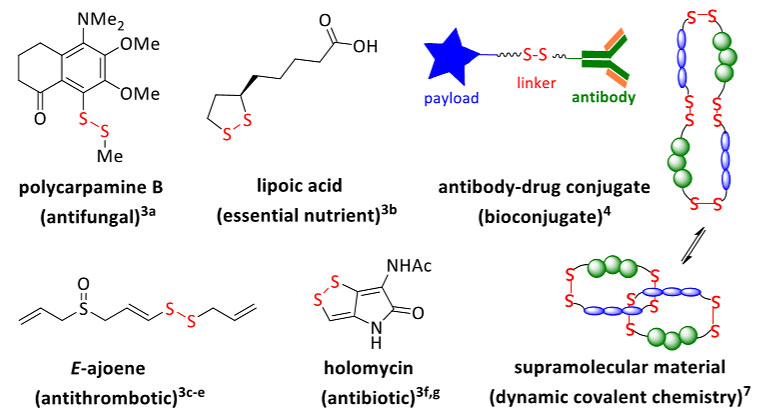
二硫键广泛存在于生物学中,它既是蛋白质三级结构的关键稳定因素,又是参与多种生化过程调控的独特反应性部分。此外,许多具有生物活性的天然产物和药物分子也含有二硫键(图1),其活性通常取决于蛋白质常见的二硫键交换反应。交换反应也是许多生物偶联方法的基础,通常使用二硫键将化学探针、显像剂或治疗剂连接到生物分子上。尽管二硫键交换是有针对性地引入二硫键的最常用方法,但是需要酶催化来克服固有的平衡且仅限于缺电子二硫化物与亲核硫醇(酯)的反应。事实上,除二硫键交换外,构建二硫键的方法仍然相对有限。
图1. 代表性的二硫化物及其应用。图片来源:J. Am. Chem. Soc. 二硫化物的形成通常通过氧化来活化其中一个硫醇前体,然后与另一个进行取代反应或金属催化的交叉偶联反应(图2A)。但是,通常会伴随不可避免的自身偶联反应、较差的官能团耐受性和活化衍生物的副反应(通常为过氧化)。为了解决这些问题,化学家们致力于开发预功能化/活化的二硫试剂(RSS-LG),以通过形成C-S键引入“RSS”部分(图2B,Org. Lett., 2016, 18, 904-907; Angew. Chem. Int. Ed., 2016, 55, 14121-14125; Tetrahedron, 2017, 73, 3702-3706; Nat. Commun., 2018, 9, 2191-2200; Org. Lett., 2018, 20, 3829-3832; ACS Catal., 2019, 9, 11426-11430)。但是,这些策略仍主要限于构建芳基取代的二硫化物,并且通常需要多步来制备二硫试剂。 2019年,加拿大渥太华大学的Derek A. Pratt教授(点击查看介绍)课题组发现四硫化物被过氧自由基取代后会释放出热力学稳定的过硫自由基(RSS•,Chem. Sci., 2019, 10, 4999-5010)。那么,用亲核烷基自由基代替亲电过氧自由基,取代反应是否会更容易进行?近日,他们通过加热或光照生成烷基/芳基自由基后,与简单易得的二烷基、二芳基、二酰基四硫化物进行自由基取代反应(图2C),成功地合成了一系列不对称的二硫化物。相关成果发表在J. Am. Chem. Soc. 上。
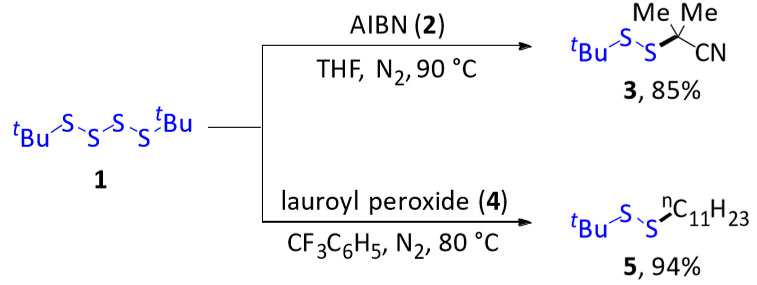
图2. 构建非对称二硫化物的策略。图片来源:J. Am. Chem. Soc. 首先,作者将四硫化叔丁基(1,由t-BuSH和S2Cl2定量制备)和自由基引发剂AIBN(2)(1:3)溶于脱氧THF中于90 °C下搅拌回流12 h,以85%的收率分离出预期的二硫化物3。同样,将1和自由基引发剂月桂酰过氧化物(4)(1:2)在三氟甲苯中于80 °C下反应12 h,以94%的收率得到5(图3)。
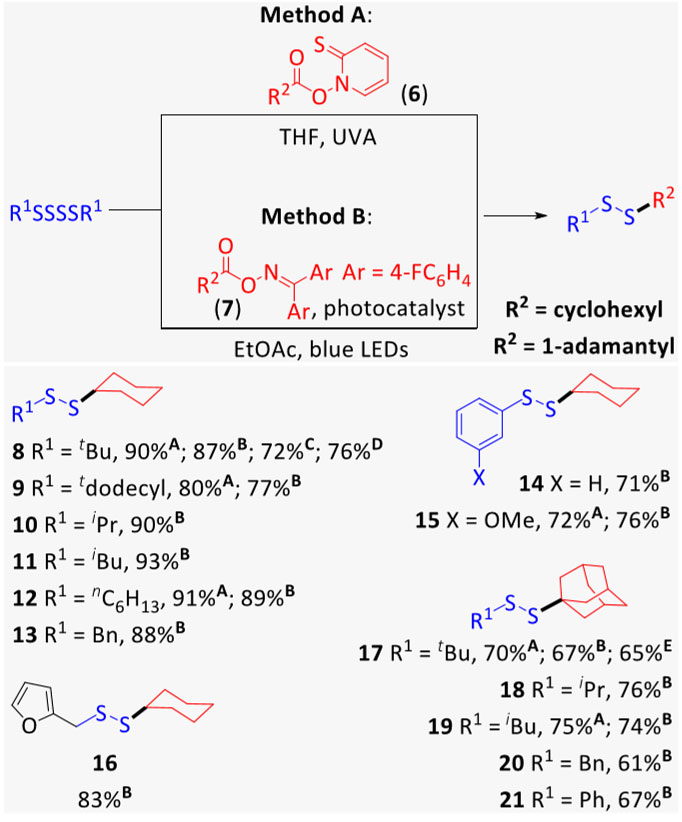
图3. 二叔丁基四硫化物的自由基取代。图片来源:J. Am. Chem. Soc. 随后,作者分别使用经典的光化学法(图4,Method A)和现代的光化学方法(Method B)以使羧酸生成烷基自由基,并对底物范围进行了考察。由环己烷和1-金刚烷的羧酸制备Barton酯(Method A)和Glorius酯(Method B),并对溶剂进行筛选(Method A选择THF;Method B选择EtOAc)后,使其与一系列四硫化物反应。令人高兴的是,伯、仲和叔四硫化物(正己基、异丁基、异丙基、叔丁基、叔十二烷基)以及芳基(苯基、3-甲氧基苯基)和苄基四硫化物都能够兼容该反应,以较高的收率得到相应的二硫化物(8-21)。有意思的是,该反应也可以在水中进行(例如8)。此外,作者发现1 mol%[Ir(dF(CF3)ppy)2(dtbbpy)]PF6可用10 mol%的噻吨酮替换,从而可以在可见光介导下实现无金属反应。
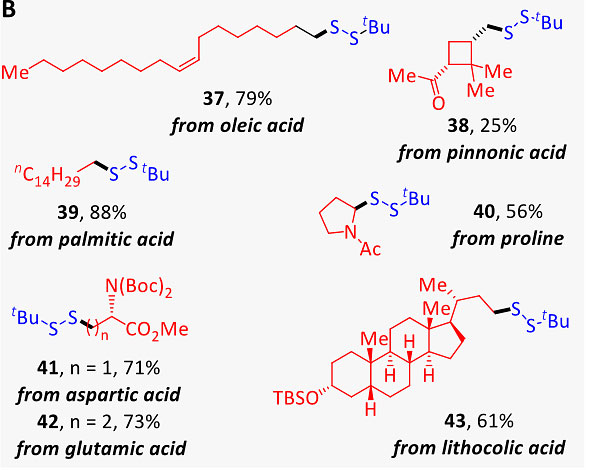
图4. 底物范围研究(一)。图片来源:J. Am. Chem. Soc. 为了进一步探究自由基(前体)的底物范围,作者制备了多种Glorius酯。如图5所示,伯、仲、叔烷基都得到了良好的产率,并可以耐受各种官能团,例如烯基、炔基、烯丙基、苄基、卤素、醚、酮以及各种碳环、杂环化合物(22-32)。值得注意的是,该反应还可以生成二叔烷基二硫化物(33、34),表明该反应对位阻效应不敏感,甚至可以耐受大位阻取代基(35),尽管收率有所降低。将四硫化物的载量从0.4当量增加到5当量,便可得到所需的芳基二硫化物(36),但是收率较差(17%)。为了进一步展示该转化的应用价值,作者制备了一系列含羧酸天然产物的肟酯,并将其置于优化的反应条件下(图5B)。结果显示氨基酸(脯氨酸40、天冬氨酸41、谷氨酸42)、饱和及不饱和脂肪酸(棕榈酸39、油酸37)以及甾醇衍生物(石胆酸43)都能以较好的收率转化为相应的不对称二硫化物。其中松果酸衍生物38的产率降低部分归因于中间体自由基的竞争性开环以及其他无法确定的副产物。
图5. 底物范围研究(二)。图片来源:J. Am. Chem. Soc. 在相似的反应条件下,二硫化物也能在[Ir(dF(CF3)ppy)2(dtbbpy)]PF6下进行能量转移,导致在所谓的二硫化物-ene反应中使用硫自由基。此外,四硫化物是能量转移的良好底物,特别是因为其S-S键比二硫键中的S-S键弱30 kcal/mol。实际上,将二叔丁基四硫化物1和二甲基苯基四硫化物44(1:1)的混合物在Ir光催化剂存在下进行蓝光LED照射时,在约1 h内观察到了自身偶联和交叉偶联的四硫化物(1:2:1)混合物(图6A)。
图6. 机理研究。图片来源:J. Am. Chem. Soc. 为了进一步探究该反应的动力学,作者进行了自由基钟实验——使用5-己烯基自由基环化作为标定的单分子重排(kcyc = 2×105 s-1)。在不同浓度的二甲基苯基四硫化物44下进行了优化,并通过1H NMR谱确定了5-己烯基(未重排)或环戊基甲基(重排)自由基形成的两种二硫化物的比率(图6B,47和48)。绘制产物比与四硫化物浓度的函数关系图,可以得到很好的线性相关性(R2 = 0.993)以及取代速率常数ksub = 5.8×105 M-1s-1。由此可见,该反应可以应用于多组分和/或自由基串联反应中,如邻位烯烃的双官能化反应(图6C)。 为了能够直接比较四硫化物和过氧自由基的反应性,作者进行CBS-QB3计算来确定两个过程的过渡态结构和能量学特征(图6D),结果显示模型烷基(乙基)自由基与t-BuSSSSt-Bu反应的ΔG‡ = 11.6 kcal/mol,而在298 K时模拟过氧(甲基过氧)自由基则为19.9 kcal/mol。与298 K下甲基过氧自由基(ΔG° = -0.4 kcal/mol)相比,四硫化物与乙基自由基(ΔG° = -21.0 kcal/mol)的反应驱动力更大,这可能是由于过渡态的极化更有利,因此作者推测二酰基四硫化物是否会是更好的试剂。实际上,尽管驱动力大大降低(ΔG° = -12.6 kcal/mol),但CBS-QB3计算表明,与t-BuSSSSt-Bu相比,AcSSSSAc与乙基反应的势垒较低(ΔG‡ = 10.1 kcal/mol),这是因为中心S-S键更强(AcSSSSAc中的BDE = 44.8 kcal/mol,而t-BuSSSSt-Bu中的BDE = 36.3 kcal/mol)(图6D)。事实上,当将等量的BzSSSSBz 52和t-BuSSSSt-Bu 1与月桂酰过氧化物4在三氟甲苯中于80 °C反应时,产物苯甲酰过硫化物53与二硫化物5的比例为6.4:1(图6E)。 酰基四硫化物的均裂取代反应在合成化学中十分有用,因为它可轻松获得酰基过硫化物、通用中间体和难以获得的氢过硫化物(RSSH)的前体。例如,可以48%的收率制备一种“稳定的”氢过硫化物56的前体——乙酰基1-金刚烷基过硫化物55(从54和51的制备出发,总收率为38%,图6F),而先前的报道需要三步操作,收率仅为19%。 总结 Derek A. Pratt教授课题组报道了制备简单的四硫化物会被烷基自由基有效地均裂取代,从而能够合成各种不对称的二硫化物。鉴于原料化学品中羧酸简单易得以及四硫化物制备过程简单,该方案将会广泛用于制备合成化学和生物学上重要的含硫化合物。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Radical Substitution Provides a Unique Route to Unsymmetric Disulfides Zijun Wu, Derek A. Pratt J. Am. Chem. Soc., 2020, 142, 10284-10290, DOI: 10.1021/jacs.0c03626 导师介绍 Derek A. Pratt https://www.x-mol.com/university/faculty/6396 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】