(1)二氧化氯溶于水的反应方程式2ClO2+H2OHClO3+HClO2.请用双线桥标明电子转移方向和数目.(2)写出下列物质熔融态的电离方程式:NaHSO4Na++HSO4 |
您所在的位置:网站首页 › 二氧化氯和氢离子反应 › (1)二氧化氯溶于水的反应方程式2ClO2+H2OHClO3+HClO2.请用双线桥标明电子转移方向和数目.(2)写出下列物质熔融态的电离方程式:NaHSO4Na++HSO4 |
(1)二氧化氯溶于水的反应方程式2ClO2+H2OHClO3+HClO2.请用双线桥标明电子转移方向和数目.(2)写出下列物质熔融态的电离方程式:NaHSO4Na++HSO4
|
分析 (1)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数,据此回答判断;(2)在熔融状态电离出硫酸氢根离子和钠离子;(3)加Na2CO3溶液除去钙离子以及过量的钡离子;(4)氢氧化铁胶体的制备是在沸水中滴加饱和氯化铁溶液加热到红褐色液体得到氢氧化铁胶体;氢氧化铁胶体能与HCl反应生成三氯化铁和水;(5)反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0价降低到-1价,被还原,Cl2为氧化剂,N元素化合价由-3价升高到0价,被氧化,NH3为还原剂,结合元素化合价的变化和反应的方程式解答该题. 解答 解:(1)反应2ClO2+H2O═HClO3+HClO2中,Cl从+4价升高到了+5价,从+4价降低到了+3价,电子转移为: 点评 本题考查了胶体的制备、化学方程式的书写、氧化还原反应的计算,把握反应中元素的化合价变化及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大. |
【本文地址】
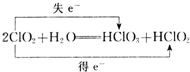 ,故答案为:
,故答案为: