新药临床开发桥接策略与案例分析 |
您所在的位置:网站首页 › 二期临床试验需要多少例 › 新药临床开发桥接策略与案例分析 |
新药临床开发桥接策略与案例分析
|
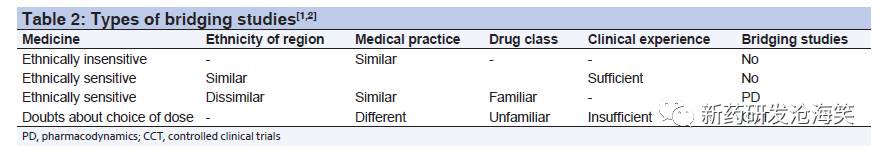
新药临床开发桥接策略与案例分析 CIO专家-山丹 发布日期:2023-03-21 阅读:3398 桥接研究最重要的指导原则是ICHE5. ICHE5指导原则提供了一般性框架,用于评估种族因素对外国临床试验数据的可接受性,目标是减少临床试验数据重复,描述了外国临床试验数据跨区域推广所需桥接研究的要求。该指导原则建议判断外国临床试验数据可接受性的三个步骤:第一步是对药物临床数据包的完整性进行评估,若临床数据包完整,则进入第二步,评估该药品对种族因素的敏感程度;第三步则是根据药品对种族因素的敏感程度、以及是否存在外在种族因素影响药品安全性、疗效和剂量-效应关系等因素来判断是否需要进行桥接研究。 评估临床数据包的完整性 根据ICH-E5,申请人需要先提交临床数据包。在外国地区所生成的临床数据是否完整取决于能否准确外推到新地区。外推是接受外国临床数据的重要概念,取决于临床数据包的完整性。区域监管当局将对数据包的格式和质量进行评估,不论其地理来源。一个临床数据包若满足所有区域监管要求的话将被定义为“完整”的临床数据包并用于提交和批准。 为使跨区域外推得到新地区的认可,申请人需要向新地区提交的完整临床数据包(包括外国临床试验数据):外国地区人口的药代动力学(PK)、药效学(PD)、剂量-效应关系、疗效和安全性进行充分的描述。确立剂量-效应关系、疗效和安全性需要临床试验数据支持,这些临床试验应根据新地区监管当局的标准来设计、开展和管理。这些临床试验的充分和良好控制,使用适合评估治疗的终点。此外,应按照新地区接受的医学和诊断定义来评估外国数据是否符合这些标准。如果外国数据不满足这些严格标准,新地区监管当局可能会要求额外的临床试验来评估其是否符合要求。这些临床试验可以针对特殊人群(例如包括肾脏或肝脏功能受损的患者)、特定的阳性对照、指定剂量或给药方案,以及药物相互作用等。 评估种族敏感性 种族因素被定义为人群中与遗传和生理因素(内因)、以及文化和环境(外因)特征有关的因素。评估药品对种族因素的敏感性是指评估可能受种族因素影响的PK、PD或其他特征。对种族敏感的因素包括:非线性 PK、陡峭 PD曲线、治疗窗狭窄,代谢率高,基因多态性,以前药形式给药且有可能在种族间存在酶生物转化差异性,个体间变异大,生物利用度低,多重给药的概率大,不恰当用药概率大。见下表:
根据E5要求是否需要开展桥接研究 按照E5的要求,根据药品对种族因素的敏感程度和外因是否可能影响药品安全、疗效和量效关系的情况,判断是否需要开展桥接研究。桥接研究,顾名思义是用来将国外数据从外推到新地区。ICH-E5定义桥接研究是在新地区进行的研究,提供新地区PD或临床有效性、安全、剂量和给药方案数据,以便将外国临床数据外推到新地区。一般来说,那些被认为种族不敏感的药物,桥接研究的类型(如果需要)需要根据该药物类别的经验,以及种族因素是否影响药物安全、疗效和剂量的可能性来决定。 在某些情况下,桥梁研究可能不必进行。第一种情况是,如果药物对族裔没有敏感性,外部因素,例如医学实践和试验的行为是类似的,或者药物对种族敏感但这两个地区的种族是相似的并且有足够的经验。这种情况下不需进行桥接。如果药物对种族因素敏感,但两个区域的种族差别大,外部因素类似。在这种情况下,可以通过在新地区开展PD研究,并使用药理学终点或已确定的生物标志物进行控制,从而将外国数据桥接起来。对于可能引起严重不良反应的药物,需要在上市前进行临床试验以明确该药品的本地安全性。此外,某些情况下严重不良反应的发生率较低且需要大样本量才能检测出来。见下表:
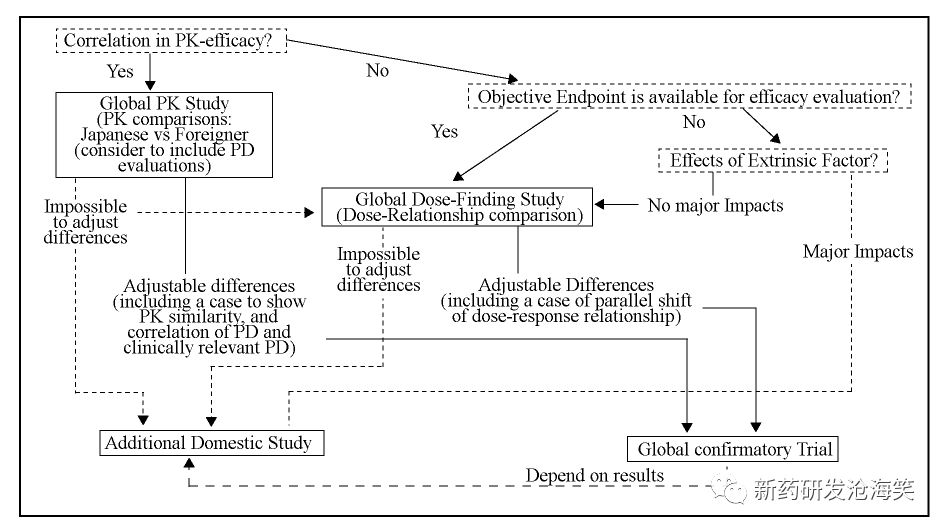
他山之石-日本桥接研究介绍 日本是最早提出和引入相关概念的亚洲国家之一。2007 年,日本发布《国际临床试验基本原则》。2012 年指南补充文件发布( Basic Principles on Global Clinical Trials ( Reference Cases) ) 发布,旨在帮助进一步理解2007 年指南,确保日本早期参与全球开发。在全球临床试验开始前,至少要求在日本健康人或患者中进行单次给药的安全性和PK研究,以提前确认日本人无特定的安全性风险。但是,如果有合理原因,如可以从外国Ⅰ期研究结果中获得日本人的安全性信息,或从同类药推断日本和非日本人推荐剂量相似等,日本人群的Ⅰ期临床试验不一定需要在全球试验前开展。但即使在这种情况下,考虑日本和非日本人群PK 比较信息对确定日本剂量的重要性,推荐与GCT 平行进行临床药理学研究,或在GCT 中研究PK 和临床疗效的关系,以评估与临床疗效的相关性及解释全球试验结果。在GCT 设计中,仍推荐日本加入剂量探索研究,以便在早期临床开发中确认剂量- 效应关系的种族间差异,随后设计确证性临床试验。即使不同人群的推荐剂量不同,如果可充分解释不同地区的不同剂量可产生等同的有效性和安全性,那么在每个区域随后进行的Ⅲ期GCT 的结果可合并且作为主要分析人群的结果进行处理。当PK 和PK/PD 相似,且与临床疗效具有明确相关性,基于临床疗效的日本剂量探索研究是非必要要求。GCT 决策流程见下图:
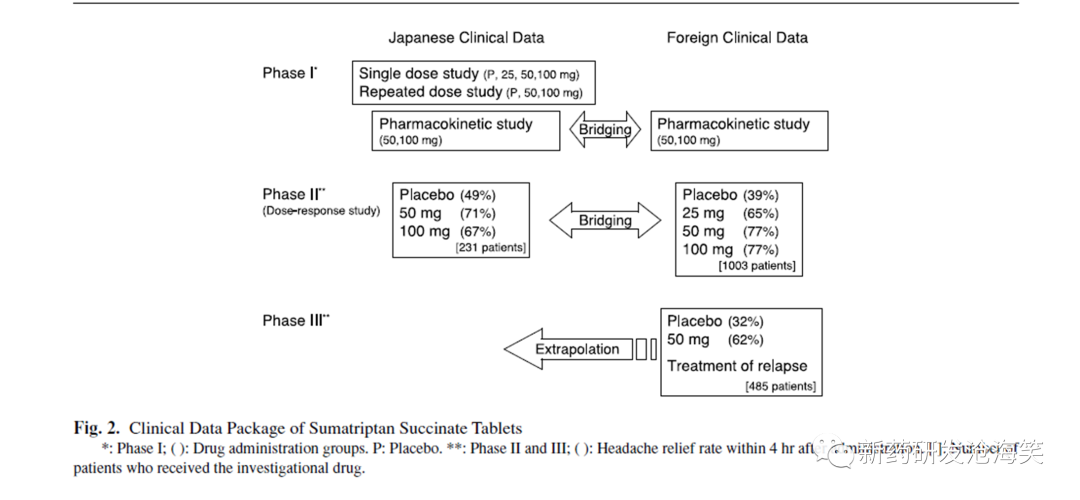
案例分析 1. 桥接策略:I期+II期 舒马曲坦即是通过桥接研究上市的典型案例,该品种在日本单独开展了健康人群Ⅰ期单次给药( 剂量: 25,50,100 mg) 以及多次给药( 剂量: 50,100 mg)的PK 及安全性研究,Ⅱ期安慰剂对照的231 例患者( 剂量: 50,100 mg) 的临床安全有效性研究,以桥接国外Ⅱ期及Ⅲ期近1500 例患者的安全有效性数据,于2003 年在日本获批上市。
2. 桥接策略 I期+II期+长期研究 恩替卡韦在日本提交申请资料时注册分类为新有效成分,申请适应症为抑制乙型肝炎病毒的增殖,本药以此适应症已在21 个国家/地区上市。由于迫切的临床需要,在美国已通过优先审评上市,在日本同样已纳入优先审评。在日本递交的完整临床试验数据包见下图:
总结与启示: 日本是应用桥接研究时间最长应用最广的国家。日本的桥接研究可分为Ⅰ期PK( PD) 比较研究及Ⅱ/Ⅲ期有效性研究。西方一般将这两种研究都称为桥接研究,而日本仅把Ⅱ/Ⅲ期有效性研究定义为桥接研究。Ⅰ期不同人群的比较PK( PD) 研究则是日本的常规要求,但Ⅰ期研究可在日本以外地区进行。大多数情况下,PMDA 要求在日本人群中开展Ⅰ期PK 试验后,再开展桥接试验。对于海外试验中量效关系不明显的新药,PMDA 常要求在日本人群中重新开展Ⅱ/Ⅲ期试验。 中国已加入ICH,也已实施多项ICH指导原则,包括ICHE1、E5、E17等等。中国加入全球研究有助海外新药早日进入中国。欧美人群中的数据,由于基因、体型、饮食文化上的差异,可能产生对药物安全性、有效性的较大影响,可见桥接研究的重要性。中国目前的临床开发现状与十多年前的日本有相似之处,学习日本的药物研发全球化之路,有助突破我们现有的瓶颈。 参考文献: 1. ICH E5. 2. Development of triptans in Japan : Bridging strategy based on the ICH-E5 guideline 3.李皛等,日本新药临床研发的桥接策略 4.李敏等,日本接受境外临床试验数据历程简介 *本文转载自微信公众号 - - 新药研发沧海笑
相关文件下载、服务及学习课程: 合规文库:药品生产企业质量管理管理规程模板—2022版 合规培训:AAV基因治疗产品CMC开发的合规实践 委托定制:药品生产许可证办理 联系专家,获取专家指导意见:e邀专家 *以上文章仅代表作者个人观点 |
【本文地址】
今日新闻 |
推荐新闻 |