指南与共识|中国乳腺癌中心静脉血管通路临床实践指南(2022版) |
您所在的位置:网站首页 › 乳腺癌化疗植入式静脉输液港会手麻无力吗 › 指南与共识|中国乳腺癌中心静脉血管通路临床实践指南(2022版) |
指南与共识|中国乳腺癌中心静脉血管通路临床实践指南(2022版)
|
中心静脉作为一种安全的输液途径已经获得共识。临床常用的中心静脉血管通路(central venous access,CVA)包括经颈内静脉、锁骨下静脉、股静脉置入的中心静脉导管(central venous catheter,CVC),经颈内静脉或锁骨下静脉的完全置入式静脉输液港,经外周静脉置入中心静脉导管(peripherally inserted central catheter,PICC)等,这些CVA在乳腺癌临床领域得到了广泛应用。为规范CVA在乳腺癌治疗实践中的临床应用,中华医学会外科学分会乳腺外科学组组织国内部分乳腺外科专家在《中华医学会乳腺外科临床实践指南(2021版):乳腺癌植入式静脉输液港临床实践指南》[1]基础上通过文献调研和专家讨论,提出乳腺癌病人CVA临床实践的关键临床问题,参照GRADE(Grading of Recommendations Assessment,Development and Evaluation)系统对相关证据进行评价,并结合中国临床可及性,制定本指南,旨在为我国乳腺癌及其他专业医师提供参考借鉴。 1 证据等级标准及推荐强度标准1.1 证据推荐等级标准 本指南证据等级参考GRADE系统,结合中国临床研究特点制定,将证据等级分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4类,量化体现指南编写专家对证据可靠性的评价情况。基于本指南在中国临床实践的可及性,专家组优先选择Ⅰ类和Ⅱ类证据纳入指南评价体系(表1)。
1.2 推荐强度标准 本指南推荐强度结合GRADE系统及国内临床实践特点,纳入证据等级、卫生经济学、产品等效性、可及性4个影响因素,根据权重,采用赋分制,由指南编写专家对推荐意见逐一进行评分,根据评分结果将推荐强度分为:A级(强推荐)、B级(弱推荐)、C级(不推荐)。见表2、3。
1.3 推荐强度评审委员会 本指南投票委员会成员共37名,均为乳腺外科医生(100%)。 1.1 证据推荐等级标准 本指南证据等级参考GRADE系统,结合中国临床研究特点制定,将证据等级分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4类,量化体现指南编写专家对证据可靠性的评价情况。基于本指南在中国临床实践的可及性,专家组优先选择Ⅰ类和Ⅱ类证据纳入指南评价体系(表1)。
1.2 推荐强度标准 本指南推荐强度结合GRADE系统及国内临床实践特点,纳入证据等级、卫生经济学、产品等效性、可及性4个影响因素,根据权重,采用赋分制,由指南编写专家对推荐意见逐一进行评分,根据评分结果将推荐强度分为:A级(强推荐)、B级(弱推荐)、C级(不推荐)。见表2、3。
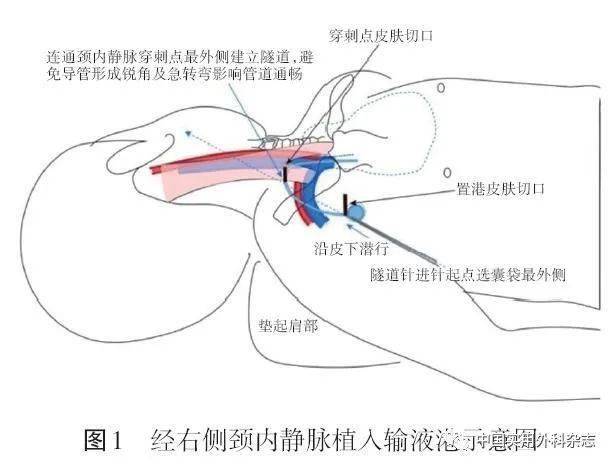
1.3 推荐强度评审委员会 本指南投票委员会成员共37名,均为乳腺外科医生(100%)。 2 应用对象本指南以中国乳腺疾病专业临床医生为主要适用对象。 本指南以中国乳腺疾病专业临床医生为主要适用对象。 3 推荐意见3.1 适应证 需要输入化疗药物、高渗透性或黏稠度较高的液体如静脉营养或输血和长期输液的乳腺癌病人[2-3] (证据等级:Ⅰ类;推荐强度:A级)。 3.2 通道选择 3.2.1 植入式静脉输液港 (1)锁骨下静脉、颈内静脉、贵要静脉[4-5] (证据等级:Ⅰ类;推荐强度:A级)。(2)股静脉置入[6] (证据等级:Ⅱ类;推荐强度:A级)。 3.2.2 PICC (1)贵要静脉 (证据等级:Ⅰ类;推荐强度:A级)。(2)肘正中静脉、头静脉、肱静脉、颈外静脉(新生儿可通过大隐静脉、颞静脉、耳后静脉等)、股静脉 (证据等级:Ⅱ类;推荐强度:B级)。 3.2.3 CVC (1)颈内静脉[7] (证据等级:Ⅰ类;推荐强度:A级)。(2)锁骨下静脉、股静脉[8] (证据等级:Ⅰ类;推荐强度:A级)。 3.3 CVA导管尖端位置 3.3.1 植入式静脉输液港 (1)上腔静脉下1/3部分[9-11] (证据等级:Ⅰ类;推荐强度:A级)。(2)上腔静脉和右心房交界处[10-12] (证据等级:Ⅰ类;推荐强度:A级)。 3.3.2 PICC (1)上腔静脉下1/3部分[9-11] (证据等级:Ⅰ类;推荐强度:A级)。(2)上腔静脉和右心房交界处[10-12] (证据等级:Ⅰ类;推荐强度:A级)。 3.3.3 CVC 上腔静脉下1/3与右心房上1/3之间[13] (证据等级:Ⅱ类;推荐强度:A级)。 3.4 导管尖端定位方法 (1)术中X线透视或术后胸片[14-15] (证据等级:Ⅰ类;推荐强度:A级)。(2)术中心电图(electrocardiogram,ECG)定位,如腔内ECG(injection of vien electrocardiogram,IV-ECG)[16-21] (证据等级:Ⅰ类;推荐强度:A级)。 3.5 常见并发症预防和处理 3.5.1 气胸、血胸、空气栓塞、误穿动脉等 推荐超声定位或术中使用超声引导下静脉穿刺[22-23] (证据等级:Ⅰ类;推荐强度:A级)。 3.5.2 导管相关性血流感染 严格无菌操作;血培养和药敏试验结果出来前,经验性使用抗生素,明确感染病原体后,根据药物敏感性选择用药;治疗无效取出静脉港[12-23] (证据等级:Ⅱ类;推荐强度:A级)。 3.5.3 导管相关性血栓 避免反复穿刺;导管尖端位置正确。一旦出现导管相关性血栓,首选抗凝治疗[23-24] (证据等级:Ⅱ类;推荐强度:A级)。 3.6 CVA维护 3.6.1 植入式静脉输液港 (1)由经过专业培训的医护人员进行植入式静脉输液港维护[25-26] (证据等级:Ⅰ类;推荐强度:A级)。(2)应使用植入式静脉输液港专用无损伤针进行穿刺,无损伤针每7 d需进行更换[11] (证据等级:Ⅰ类;推荐强度:A级)。(3)穿刺后应评估导管回血及通畅情况[25] (证据等级:Ⅰ类;推荐强度:A级)。(4)穿刺后需使用无菌敷料覆盖穿刺点,无菌透明敷料应至少每7 d更换1次,无菌纱布敷料应至少每2 d更换1次 [11, 26] (证据等级:Ⅰ类;推荐强度:A级)。(5)用10 mL及以上注射器,采用脉冲式手法进行冲管,正压手法进行封管[25](证据等级:Ⅱ类;推荐强度:A级)。(6)用生理盐水或100 kU/L肝素盐水进行冲封管[11, 26] (证据等级:Ⅰ类;推荐强度:A级)。(7)治疗间歇期至少每4周进行1次维护[11] (证据等级:Ⅰ类;推荐强度:A级)。 3.6.2 PICC (1)由经过专业培训的医护人员或团队进行PICC维护[27-28] (证据等级:Ⅰ类;推荐强度:A级)。(2)导管置入24 h后常规更换敷料;穿刺部位发生渗血、敷料潮湿或松动时立即更换敷料,视情况决定是否更换肝素帽。无菌透明敷料及肝素帽每7 d进行1次维护或更换;无菌纱布敷料至少每2 d更换1次[25, 29-31] (证据等级:Ⅰ类;推荐强度:A级)。(3)冲管及封管使用10 mL注射器或一次性专用冲洗装置[31] (证据等级:Ⅱ类;推荐强度:A级)。(4)治疗间歇期至少每周维护1次[31] (证据等级:Ⅱ类;推荐强度:A级)。(5)使用稀释肝素盐水(1~10 kU/L)或不含防腐剂生理盐水脉冲式正压封管[32-34] (证据等级:Ⅰ类;推荐强度:A级)。 3.6.3 CVC (1)穿刺后24 h内更换贴膜;每天进行消毒护理;敷料被污染、潮湿或松动时立即更换[12, 21, 30, 35-36] (证据等级:Ⅰ类;推荐强度:A级)。(2)每天评估导管使用情况[35] (证据等级:Ⅰ类;推荐强度:A级)。(3)使用时间不超过 14 d [36](证据等级:Ⅰ类;推荐强度:A级)。(4)10 mL注射器脉冲式冲洗导管,3~5 mL肝素盐水正压封管;严禁高压注射[37](证据等级:Ⅱ类;推荐强度:A级)。 针对乳腺癌病人建立中心静脉输液通道应根据病人特点、用药方案和疗程周期等因素采取不同的血管通路和方式。本指南主要针对乳腺癌需要接受化疗的病人群体,由于美国国家综合癌症网络(NCCN)及中国临床肿瘤学会(CSCO)临床实践指南对乳腺癌推荐的化疗方案均≥4个周期,因此,专家组优先推荐选择中心静脉输液港方式。同时,本指南也介绍了PICC和CVC应用的注意事项,为临床合理选择提供参考。 3.1 适应证 需要输入化疗药物、高渗透性或黏稠度较高的液体如静脉营养或输血和长期输液的乳腺癌病人[2-3] (证据等级:Ⅰ类;推荐强度:A级)。 3.2 通道选择 3.2.1 植入式静脉输液港 (1)锁骨下静脉、颈内静脉、贵要静脉[4-5] (证据等级:Ⅰ类;推荐强度:A级)。(2)股静脉置入[6] (证据等级:Ⅱ类;推荐强度:A级)。 3.2.2 PICC (1)贵要静脉 (证据等级:Ⅰ类;推荐强度:A级)。(2)肘正中静脉、头静脉、肱静脉、颈外静脉(新生儿可通过大隐静脉、颞静脉、耳后静脉等)、股静脉 (证据等级:Ⅱ类;推荐强度:B级)。 3.2.3 CVC (1)颈内静脉[7] (证据等级:Ⅰ类;推荐强度:A级)。(2)锁骨下静脉、股静脉[8] (证据等级:Ⅰ类;推荐强度:A级)。 3.3 CVA导管尖端位置 3.3.1 植入式静脉输液港 (1)上腔静脉下1/3部分[9-11] (证据等级:Ⅰ类;推荐强度:A级)。(2)上腔静脉和右心房交界处[10-12] (证据等级:Ⅰ类;推荐强度:A级)。 3.3.2 PICC (1)上腔静脉下1/3部分[9-11] (证据等级:Ⅰ类;推荐强度:A级)。(2)上腔静脉和右心房交界处[10-12] (证据等级:Ⅰ类;推荐强度:A级)。 3.3.3 CVC 上腔静脉下1/3与右心房上1/3之间[13] (证据等级:Ⅱ类;推荐强度:A级)。 3.4 导管尖端定位方法 (1)术中X线透视或术后胸片[14-15] (证据等级:Ⅰ类;推荐强度:A级)。(2)术中心电图(electrocardiogram,ECG)定位,如腔内ECG(injection of vien electrocardiogram,IV-ECG)[16-21] (证据等级:Ⅰ类;推荐强度:A级)。 3.5 常见并发症预防和处理 3.5.1 气胸、血胸、空气栓塞、误穿动脉等 推荐超声定位或术中使用超声引导下静脉穿刺[22-23] (证据等级:Ⅰ类;推荐强度:A级)。 3.5.2 导管相关性血流感染 严格无菌操作;血培养和药敏试验结果出来前,经验性使用抗生素,明确感染病原体后,根据药物敏感性选择用药;治疗无效取出静脉港[12-23] (证据等级:Ⅱ类;推荐强度:A级)。 3.5.3 导管相关性血栓 避免反复穿刺;导管尖端位置正确。一旦出现导管相关性血栓,首选抗凝治疗[23-24] (证据等级:Ⅱ类;推荐强度:A级)。 3.6 CVA维护 3.6.1 植入式静脉输液港 (1)由经过专业培训的医护人员进行植入式静脉输液港维护[25-26] (证据等级:Ⅰ类;推荐强度:A级)。(2)应使用植入式静脉输液港专用无损伤针进行穿刺,无损伤针每7 d需进行更换[11] (证据等级:Ⅰ类;推荐强度:A级)。(3)穿刺后应评估导管回血及通畅情况[25] (证据等级:Ⅰ类;推荐强度:A级)。(4)穿刺后需使用无菌敷料覆盖穿刺点,无菌透明敷料应至少每7 d更换1次,无菌纱布敷料应至少每2 d更换1次 [11, 26] (证据等级:Ⅰ类;推荐强度:A级)。(5)用10 mL及以上注射器,采用脉冲式手法进行冲管,正压手法进行封管[25](证据等级:Ⅱ类;推荐强度:A级)。(6)用生理盐水或100 kU/L肝素盐水进行冲封管[11, 26] (证据等级:Ⅰ类;推荐强度:A级)。(7)治疗间歇期至少每4周进行1次维护[11] (证据等级:Ⅰ类;推荐强度:A级)。 3.6.2 PICC (1)由经过专业培训的医护人员或团队进行PICC维护[27-28] (证据等级:Ⅰ类;推荐强度:A级)。(2)导管置入24 h后常规更换敷料;穿刺部位发生渗血、敷料潮湿或松动时立即更换敷料,视情况决定是否更换肝素帽。无菌透明敷料及肝素帽每7 d进行1次维护或更换;无菌纱布敷料至少每2 d更换1次[25, 29-31] (证据等级:Ⅰ类;推荐强度:A级)。(3)冲管及封管使用10 mL注射器或一次性专用冲洗装置[31] (证据等级:Ⅱ类;推荐强度:A级)。(4)治疗间歇期至少每周维护1次[31] (证据等级:Ⅱ类;推荐强度:A级)。(5)使用稀释肝素盐水(1~10 kU/L)或不含防腐剂生理盐水脉冲式正压封管[32-34] (证据等级:Ⅰ类;推荐强度:A级)。 3.6.3 CVC (1)穿刺后24 h内更换贴膜;每天进行消毒护理;敷料被污染、潮湿或松动时立即更换[12, 21, 30, 35-36] (证据等级:Ⅰ类;推荐强度:A级)。(2)每天评估导管使用情况[35] (证据等级:Ⅰ类;推荐强度:A级)。(3)使用时间不超过 14 d [36](证据等级:Ⅰ类;推荐强度:A级)。(4)10 mL注射器脉冲式冲洗导管,3~5 mL肝素盐水正压封管;严禁高压注射[37](证据等级:Ⅱ类;推荐强度:A级)。 针对乳腺癌病人建立中心静脉输液通道应根据病人特点、用药方案和疗程周期等因素采取不同的血管通路和方式。本指南主要针对乳腺癌需要接受化疗的病人群体,由于美国国家综合癌症网络(NCCN)及中国临床肿瘤学会(CSCO)临床实践指南对乳腺癌推荐的化疗方案均≥4个周期,因此,专家组优先推荐选择中心静脉输液港方式。同时,本指南也介绍了PICC和CVC应用的注意事项,为临床合理选择提供参考。 4 乳腺癌病人CVA适应证和通道的选择专家组认为需要输入化疗药物、高渗透性或黏稠度较高的液体,如静脉营养或输血和长期输液的乳腺癌病人是CVA的适应证[30]。常见禁忌证包括置入部位感染以及对导管材质过敏者。慎用于需要动静脉造瘘进行血液滤过治疗的严重肾功能不全病人。 4.1 植入式静脉输液港适应证和通道的选择 植入式静脉输液港改变了长期输注细胞毒性药物或高渗、黏稠性药物病人的护理模式,改善了乳腺癌病人生活质量。具体适应证[23]包括:需输入化疗药物;需长期输入高渗透性或黏稠度较高的药物;需使用加压泵快速输液;需长期输液和保留静脉通路;每日需多次静脉采血检查等。由于缺乏足够高级别证据支持,专家组认为植入静脉输液港禁忌证可参照深静脉置管执行。包括:无法耐受手术;凝血机制障碍;对港体和导管所含成分过敏;拟置管深静脉有静脉炎和静脉血栓形成史;以及拟置入部位感染或有放疗史[23]。 植入通道选择与医生习惯和血管条件有关。文献报道,长期使用颈内静脉植入输液港有效性和安全性优于锁骨下静脉[4-5]。在上腔静脉及相关静脉有压迫受阻或其他特殊情况可选择股静脉置入[6]。颈内静脉置管到胸壁港体的距离较远,穿刺点导管经皮下隧道连接注射座易形成锐角导致输液不畅,将置港囊袋定位于穿刺点皮肤切口外侧可减少其发生。隧道针穿刺时起点取置港皮肤切口最外侧点,并与穿刺点皮肤切口最外侧连接建立皮下隧道(图1)。
在乳腺癌治疗领域,胸壁输液港在国内开展较早,积累的经验更多,其植入主要由外科医生在手术室或导管室按外科手术要求完成。手臂输液港从2014年开始在国内报道,由静脉治疗专科护士在专用的深静脉置管B超引导下操作,取得医生配合埋入注射座。手臂输液港多以贵要静脉、肱静脉、头静脉等作为入路植入导管,港座完全埋入手臂皮下。其中,经上肢贵要静脉植入输液港(手臂港)是简单、安全的植入方式[29]。手臂港相比胸壁港可降低动脉误穿、气胸夹闭综合征等并发症。手臂港因置港部位隐蔽,不存在改变乳腺癌病人穿衣习惯、暴露植入港体部位等问题,病人感受相比胸壁港更佳。 4.2 PICC适应证和通道的选择 PICC相对于输液港留置过程简单,通过外周血管置入中心静脉,创伤较小,操作简便,但是管道护理频繁,每周至少要换药1次,同时部分导管外露,感染和皮炎等的发生率较高,因此并非乳腺癌病人的首选,专家组推荐等级低于输液港。需要短、中期化疗的乳腺癌病人可以选择PICC。禁忌证包括:无合适的穿刺血管,穿刺部位有严重的感染如蜂窝织炎,或者有严重的凝血功能障碍等因素。 穿刺部位应进行血管评估,根据血管的深度、管腔是否狭窄、血管壁结构、血管分布、血管曲直等选择合适的血管进行穿刺。常用血管通道包括贵要静脉、肘正中静脉及头静脉。贵要静脉具有粗、短、静脉瓣少的优势,是通道的首选。肘正中静脉及头静脉也是PICC可选血管。肘正中静脉粗、直,方便活动,但静脉瓣较多;头静脉前粗后细,进入无名静脉时常有角度导致导管易反折至腋静脉。 4.3 CVC适应证和通道的选择 CVC是最早使用的中心静脉通路置管方式,操作简单,但其并发症较多,不能在体内长期保留,目前多用于重症监护病房(ICU)或冠心病监护病房(CCU)中的危重病人,目的是短时间安全快速输液,适用于更短期(7~10 d)化疗的乳腺癌病人[38],或外周静脉、PICC或静脉港有禁忌时,可急诊放置[39]。因此,除特殊情况外,专家组不推荐乳腺癌病人选择。 CVC主要经颈内静脉、锁骨下静脉及股静脉穿刺置管。因右颈内静脉与无名静脉和上腔静脉几乎成一条直线且右侧胸膜顶低于左侧,同时右侧无胸导管,故首选右侧颈内静脉插管。经锁骨下静脉穿刺可导致血气胸、上腔静脉或右心房穿孔、纵隔出血、心包填塞以及胸导管损伤等严重并发症,一般不做乳腺癌病人的常规推荐应用。经皮股静脉置管术尤其适用于卧床及全身情况较差者,以及锁骨下静脉和上腔静脉血栓形成或颈内、锁骨下静脉插管有困难等情况。 专家组认为需要输入化疗药物、高渗透性或黏稠度较高的液体,如静脉营养或输血和长期输液的乳腺癌病人是CVA的适应证[30]。常见禁忌证包括置入部位感染以及对导管材质过敏者。慎用于需要动静脉造瘘进行血液滤过治疗的严重肾功能不全病人。 4.1 植入式静脉输液港适应证和通道的选择 植入式静脉输液港改变了长期输注细胞毒性药物或高渗、黏稠性药物病人的护理模式,改善了乳腺癌病人生活质量。具体适应证[23]包括:需输入化疗药物;需长期输入高渗透性或黏稠度较高的药物;需使用加压泵快速输液;需长期输液和保留静脉通路;每日需多次静脉采血检查等。由于缺乏足够高级别证据支持,专家组认为植入静脉输液港禁忌证可参照深静脉置管执行。包括:无法耐受手术;凝血机制障碍;对港体和导管所含成分过敏;拟置管深静脉有静脉炎和静脉血栓形成史;以及拟置入部位感染或有放疗史[23]。 植入通道选择与医生习惯和血管条件有关。文献报道,长期使用颈内静脉植入输液港有效性和安全性优于锁骨下静脉[4-5]。在上腔静脉及相关静脉有压迫受阻或其他特殊情况可选择股静脉置入[6]。颈内静脉置管到胸壁港体的距离较远,穿刺点导管经皮下隧道连接注射座易形成锐角导致输液不畅,将置港囊袋定位于穿刺点皮肤切口外侧可减少其发生。隧道针穿刺时起点取置港皮肤切口最外侧点,并与穿刺点皮肤切口最外侧连接建立皮下隧道(图1)。
在乳腺癌治疗领域,胸壁输液港在国内开展较早,积累的经验更多,其植入主要由外科医生在手术室或导管室按外科手术要求完成。手臂输液港从2014年开始在国内报道,由静脉治疗专科护士在专用的深静脉置管B超引导下操作,取得医生配合埋入注射座。手臂输液港多以贵要静脉、肱静脉、头静脉等作为入路植入导管,港座完全埋入手臂皮下。其中,经上肢贵要静脉植入输液港(手臂港)是简单、安全的植入方式[29]。手臂港相比胸壁港可降低动脉误穿、气胸夹闭综合征等并发症。手臂港因置港部位隐蔽,不存在改变乳腺癌病人穿衣习惯、暴露植入港体部位等问题,病人感受相比胸壁港更佳。 4.2 PICC适应证和通道的选择 PICC相对于输液港留置过程简单,通过外周血管置入中心静脉,创伤较小,操作简便,但是管道护理频繁,每周至少要换药1次,同时部分导管外露,感染和皮炎等的发生率较高,因此并非乳腺癌病人的首选,专家组推荐等级低于输液港。需要短、中期化疗的乳腺癌病人可以选择PICC。禁忌证包括:无合适的穿刺血管,穿刺部位有严重的感染如蜂窝织炎,或者有严重的凝血功能障碍等因素。 穿刺部位应进行血管评估,根据血管的深度、管腔是否狭窄、血管壁结构、血管分布、血管曲直等选择合适的血管进行穿刺。常用血管通道包括贵要静脉、肘正中静脉及头静脉。贵要静脉具有粗、短、静脉瓣少的优势,是通道的首选。肘正中静脉及头静脉也是PICC可选血管。肘正中静脉粗、直,方便活动,但静脉瓣较多;头静脉前粗后细,进入无名静脉时常有角度导致导管易反折至腋静脉。 4.3 CVC适应证和通道的选择 CVC是最早使用的中心静脉通路置管方式,操作简单,但其并发症较多,不能在体内长期保留,目前多用于重症监护病房(ICU)或冠心病监护病房(CCU)中的危重病人,目的是短时间安全快速输液,适用于更短期(7~10 d)化疗的乳腺癌病人[38],或外周静脉、PICC或静脉港有禁忌时,可急诊放置[39]。因此,除特殊情况外,专家组不推荐乳腺癌病人选择。 CVC主要经颈内静脉、锁骨下静脉及股静脉穿刺置管。因右颈内静脉与无名静脉和上腔静脉几乎成一条直线且右侧胸膜顶低于左侧,同时右侧无胸导管,故首选右侧颈内静脉插管。经锁骨下静脉穿刺可导致血气胸、上腔静脉或右心房穿孔、纵隔出血、心包填塞以及胸导管损伤等严重并发症,一般不做乳腺癌病人的常规推荐应用。经皮股静脉置管术尤其适用于卧床及全身情况较差者,以及锁骨下静脉和上腔静脉血栓形成或颈内、锁骨下静脉插管有困难等情况。 5 乳腺癌病人CVA导管尖端的合理位置5.1 植入式静脉输液港及PICC导管尖端的合理位置 植入式静脉输液港及PICC导管尖端位置应参照中心静脉导管置管位置。导管尖端会受病人体位变化和呼吸影响出现2~3 cm的位移[40],因此,两种静脉血管通路导管尖端的理想位置并不固定。2000年美国静脉输液护理学会推荐中心静脉导管尖端放置于上腔静脉下1/3,邻近上腔静脉和右心房交界处[9]。欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南推荐中心静脉导管尖端理想位置为上腔静脉与右心房连接处[12]。多项非随机回顾性研究结果认为中心静脉导管尖端位置与发生有症状血栓、心脏穿孔等并发症有关[41-42]。中华人民共和国卫生行业标准《静脉治疗护理技术操作规范》(WS/T 433-2013)指出,输液港定义为“完全植入人体内闭合输液装置,包括尖端位于上腔静脉的导管部分及埋植于皮下的注射座”[11],推荐静脉输液港导管尖端放置于上腔静脉。2009年欧洲临床营养和代谢学会(European Society for Clinical Nutrition and Metabolism,ESPEN)关于肠外营养指南以循证医学A类证据推荐用于高渗透压输液(如肠外营养输液)的中心静脉导管尖端除了可选择置于上腔静脉下1/3部分、上腔静脉和右心房交界处,也可置于右心房上半部分[10]。由于早期曾出现导管尖端位于心脏导致心脏穿孔或心包填塞的病例报道[43-44],1989年美国食品药品监督管理局要求放置中心静脉导管尖端应避免放置或移位进入心脏,并应用影像学或其他成像手段确认导管尖端位置,目前也有研究报道称导管尖端置于右心房相比上腔静脉能获得更高液体流量,而且导管尖端异位率低[45],目前右心房上半部分是否能作为导管尖端理想位置,仍存在争议。 乳腺癌病人静脉输液港及PICC导管定位方式与其他中心静脉置管方法相同。成人中心静脉通路植入及管理指南[14]要求放置输液港需要有成像设备(透视、静脉造影或标准影像学检查),中心静脉导管使用之前要完善X线检查,确认导管尖端位置。随机对照研究显示,相比盲穿,术中X线透视能显著降低中心静脉导管尖端异位以及需要调整导管尖端位置的比例[15]。虽然此研究是针对外周中心静脉置管,导管定位方法同样适用于静脉输液港植入术及PICC。专家组推荐中心静脉通路建立应采用术中透视或术后胸片检查明确导管尖端位置[36]。前瞻性对照研究结果表明应用ECG定位能显著降低中心静脉导管尖端异位风险,且不延长操作时间,高效经济[16-17]。单中心回顾性观察研究结果认为IV-ECG可以降低缺少经验的医生进行静脉输液港植入手术发生导管异位的概率。多项随机对照研究结果表明,IV-ECG能显著提高中心静脉导管首次置管成功率,经术后胸片验证,IV-ECG组相比解剖标志更容易将导管尖端置于最佳位置[18-20],显著降低导管置入心脏的风险[17]。2015年ESMO指南指出,IV-ECG可以用于导管定位(证据级别V)[11]。2020年美国麻醉医师协会发布的《中心静脉通路操作指南》以A2类证据推荐IV-ECG用于导管尖端位置定位[21]。2019年版中心静脉血管通路装置安全管理专家共识推荐PICC导管尖端位于上腔静脉下1/3为理想位置。研究结果显示导管末端位于上腔静脉、右心房或位于横膈膜水平以上的高下腔静脉的病人并发症发生率低于非以上位置的病人[46]。 5.2 CVC导管尖端的合理位置 CVC置管深度建议放置在上腔静脉的下1/3和右心房的上1/3之间,以防止血栓形成。此外,植入完成后需检查导管的位置[13]。建议在手术过程中检查导管尖端的位置,否则术后行X线摄影应显示正确的位置[10, 47]。 5.1 植入式静脉输液港及PICC导管尖端的合理位置 植入式静脉输液港及PICC导管尖端位置应参照中心静脉导管置管位置。导管尖端会受病人体位变化和呼吸影响出现2~3 cm的位移[40],因此,两种静脉血管通路导管尖端的理想位置并不固定。2000年美国静脉输液护理学会推荐中心静脉导管尖端放置于上腔静脉下1/3,邻近上腔静脉和右心房交界处[9]。欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南推荐中心静脉导管尖端理想位置为上腔静脉与右心房连接处[12]。多项非随机回顾性研究结果认为中心静脉导管尖端位置与发生有症状血栓、心脏穿孔等并发症有关[41-42]。中华人民共和国卫生行业标准《静脉治疗护理技术操作规范》(WS/T 433-2013)指出,输液港定义为“完全植入人体内闭合输液装置,包括尖端位于上腔静脉的导管部分及埋植于皮下的注射座”[11],推荐静脉输液港导管尖端放置于上腔静脉。2009年欧洲临床营养和代谢学会(European Society for Clinical Nutrition and Metabolism,ESPEN)关于肠外营养指南以循证医学A类证据推荐用于高渗透压输液(如肠外营养输液)的中心静脉导管尖端除了可选择置于上腔静脉下1/3部分、上腔静脉和右心房交界处,也可置于右心房上半部分[10]。由于早期曾出现导管尖端位于心脏导致心脏穿孔或心包填塞的病例报道[43-44],1989年美国食品药品监督管理局要求放置中心静脉导管尖端应避免放置或移位进入心脏,并应用影像学或其他成像手段确认导管尖端位置,目前也有研究报道称导管尖端置于右心房相比上腔静脉能获得更高液体流量,而且导管尖端异位率低[45],目前右心房上半部分是否能作为导管尖端理想位置,仍存在争议。 乳腺癌病人静脉输液港及PICC导管定位方式与其他中心静脉置管方法相同。成人中心静脉通路植入及管理指南[14]要求放置输液港需要有成像设备(透视、静脉造影或标准影像学检查),中心静脉导管使用之前要完善X线检查,确认导管尖端位置。随机对照研究显示,相比盲穿,术中X线透视能显著降低中心静脉导管尖端异位以及需要调整导管尖端位置的比例[15]。虽然此研究是针对外周中心静脉置管,导管定位方法同样适用于静脉输液港植入术及PICC。专家组推荐中心静脉通路建立应采用术中透视或术后胸片检查明确导管尖端位置[36]。前瞻性对照研究结果表明应用ECG定位能显著降低中心静脉导管尖端异位风险,且不延长操作时间,高效经济[16-17]。单中心回顾性观察研究结果认为IV-ECG可以降低缺少经验的医生进行静脉输液港植入手术发生导管异位的概率。多项随机对照研究结果表明,IV-ECG能显著提高中心静脉导管首次置管成功率,经术后胸片验证,IV-ECG组相比解剖标志更容易将导管尖端置于最佳位置[18-20],显著降低导管置入心脏的风险[17]。2015年ESMO指南指出,IV-ECG可以用于导管定位(证据级别V)[11]。2020年美国麻醉医师协会发布的《中心静脉通路操作指南》以A2类证据推荐IV-ECG用于导管尖端位置定位[21]。2019年版中心静脉血管通路装置安全管理专家共识推荐PICC导管尖端位于上腔静脉下1/3为理想位置。研究结果显示导管末端位于上腔静脉、右心房或位于横膈膜水平以上的高下腔静脉的病人并发症发生率低于非以上位置的病人[46]。 5.2 CVC导管尖端的合理位置 CVC置管深度建议放置在上腔静脉的下1/3和右心房的上1/3之间,以防止血栓形成。此外,植入完成后需检查导管的位置[13]。建议在手术过程中检查导管尖端的位置,否则术后行X线摄影应显示正确的位置[10, 47]。 6 乳腺癌病人CVA常见并发症预防和处理6.1 植入式静脉输液港常见并发症预防和处理 静脉输液港植入的并发症包括术中和术后并发症,其中术后并发症以术后30 d为界,≤30 d为早期并发症,>30 d为延期并发症。超声引导下颈內静脉穿刺较其他静脉的操作相对容易、并发症更少、手术更加安全[12]。穿刺过程中发生少量气胸,首选临床观察,定期复查X线胸片,大量气胸可行胸腔闭式引流。出现血胸后应立即停止穿刺置管,监测生命体征,同时行胸腔穿刺引流。误穿动脉后局部压迫穿刺点直至出血停止。 静脉港输液植入前预防性应用抗生素以降低相关血流感染并发症这一做法缺少证据支持,专家组不推荐常规使用抗生素预防感染[12, 23]。导管相关性血流感染发病机制主要原因是细菌在血管内导管的定植,穿刺部位皮肤菌群定植导管尖端是常见原因。典型表现为使用或维护静脉输液港后,出现寒颤、高热伴有白细胞升高等表现。怀疑导管相关性血流感染时,应暂停使用静脉输液港,同时抽取港体内和外周血作血培养和药敏试验,根据试验结果选用敏感抗生素全身治疗,使用“抗生素锁定疗法”(将抗生素注入并保留在港座及导管内,常规应用时间不超过3 d)进行封管。经抗感染治疗(通常不超过5 d)无效后,应立即取出静脉输液港[12, 23]。静脉输液港导管相关性血栓主要是指导管外壁或导管内通路中血凝块的形成。大多数导管相关性血栓无明显临床症状,常在使用或维护过程中发现输液速度降低,回抽导管内无回血。预防措施包括:正确护理、注意无菌操作及避免术中反复穿刺导致的血管内膜损伤、导管尖端位置正确。一旦明确为导管相关性血栓,首选抗凝治疗,抗凝药物大多数指南建议初始治疗首选低分子肝素或利伐沙班[12, 23-24],一般不推荐溶栓治疗。临床认为保守治疗无效必须拔出导管时,抗凝治疗应至拔除导管后至少3个月。预防性抗凝治疗对预防导管相关性血栓疗效及副反应不明确,专家组不推荐预防性抗凝。导管阻塞是由于导管扭曲夹闭管腔或血凝块及其他物质沉积管腔,导致输液不畅或回抽血困难,通过定期肝素冲洗管腔和正压封管技术可以降低导管的阻塞率。血栓性堵塞处理方法:根据临床观察和体会,可以考虑给予尿激酶 (5000 kU/L,2~5 mL)正压封管,30~120 min 后抽出,重复上述步骤。纤维蛋白鞘是覆盖于植入导管表面的含有由纤维蛋白血栓进一步发展而成的血管化纤维结缔组织,通常包裹导管外壁及导管端孔,可引起导管功能丧失。静脉造影是确诊纤维蛋白鞘形成的主要方法。溶解纤维蛋白鞘常用药物包括:尿激酶、链激酶和阿替普酶等。导管断裂和移位是罕见但严重的晚期并发症之一,导管断裂发生率在0.1%~2.1%,可能危险因素包括导管的长期使用和重复操作,制造缺陷及材料老化、降解。经锁骨下静脉穿刺途径时,夹闭综合征是发生断裂的主要原因。导管移位首发表现为导管功能障碍,移位的导管须采用介入技术处理,避免血栓栓塞。 静脉港植入的术中并发症还包括:心律失常、胸导管损伤、神经损伤、导管移位、导管无法植入等;术后并发症还包括:感染或非感染原因导致的皮肤软组织损伤、导管断裂或破裂、导管异位、药物外渗等,由于发生率相对较低,并且相关的概念、发生机制或临床处理没有形成统一意见,特别是针对乳腺癌病人的相关参考文献较少且证据等级较低,故未在本指南中详细说明。 6.2 PICC常见并发症预防和处理 对于PICC常见的机械性静脉炎,建议置管前对乳腺癌病人进行心理护理,冲洗手套上滑石粉,预冲导管并且在送管时动作轻柔。在PICC置管后建议抬高患肢并对肿胀部位进行热敷、药物涂抹(喜疗妥)、理疗(紫外线照射),可适当增加手指的精细动作(握拳、松拳)训练,避免肘关节的过度活动;抬高患肢,促进静脉的回流,减轻症状。预防及治疗细菌性静脉炎需严格无菌操作,如有细菌性静脉炎表现应进行血培养,及时给予抗菌素,必要时拔出PICC导管。乳腺癌病人出现血栓性静脉炎应有专科医生会诊,制动,禁忌按摩与热敷血栓侧肢体,抬高患肢30°;每日测量上臂臂围,观察患肢肿胀、麻木、皮温、颜色及疼痛情况;50%硫酸镁溶液200 mL联合地塞米松20 mg混合液湿敷,和喜疗妥软膏外涂或七叶皂凝胶20 g联合地塞米松20 mg混合液外涂交替使用[48];同时肝素稀释液冲管或遵医嘱尿激酶溶栓;若情况严重或肢体肿胀不能消失,需拔出PICC导管。导管堵塞应首先明确导管末端位置是否正确,是否打折,若导管末端位置正确,对导管进行脉冲式冲管,同时尽量降低胸腔压力。血凝性导管堵塞可以考虑给予尿激酶(5000 kU/L,2~5 mL)正压封管,30~120 min后抽出[49],必要时拔出PICC导管。预防非血栓性导管堵塞要求保证正确冲管,合理输入药物及掌握药物配伍禁忌。一旦发生非血栓性导管堵塞,解除导管阻塞的药物因病因不同而有区别,如由脂肪乳引起应选择75%乙醇,药物沉积引起应根据药物的pH值选择弱酸性液或碳酸氢钠等[9]。预防导管相关性感染需做好无菌防护,对导管穿刺位置固定妥当,使用PICC时限制输入完全肠外营养(TPN)的导管输入其他药物。一旦发生导管相关性感染,尽早进行血培养,局部伴有感染者每天换药,同时局部或全身使用抗菌素,必要时拔出PICC导管。出现PICC导管脱出应缝合固定导管。预防导管脱出的措施包括换药方法正确、动作轻柔;护士对病人进行宣教以及专业护士操作同等重要。 6.3 CVC常见并发症预防和处理 穿刺部位出血或血肿,局部压迫即可。误穿动脉常见于颈动脉及锁骨下动脉,应立即拔出穿刺针,指压20 min,否则易发生血肿。锁骨下静脉穿刺易出现气胸及血气胸,发生后可按一般气胸处理。预防此并发症主要在于避免穿刺点过低,避免扩皮器进入太深。空气栓塞少见,但可致命,一旦发生,应紧急抢救,病人左侧头低位,呼吸循环支持,高浓度吸氧,同时经皮行右心房或右心室穿刺抽气。导管感染主要见于股静脉穿刺,一旦确诊应立即拔除导管,并作细菌培养,应用抗生素治疗。 6.1 植入式静脉输液港常见并发症预防和处理 静脉输液港植入的并发症包括术中和术后并发症,其中术后并发症以术后30 d为界,≤30 d为早期并发症,>30 d为延期并发症。超声引导下颈內静脉穿刺较其他静脉的操作相对容易、并发症更少、手术更加安全[12]。穿刺过程中发生少量气胸,首选临床观察,定期复查X线胸片,大量气胸可行胸腔闭式引流。出现血胸后应立即停止穿刺置管,监测生命体征,同时行胸腔穿刺引流。误穿动脉后局部压迫穿刺点直至出血停止。 静脉港输液植入前预防性应用抗生素以降低相关血流感染并发症这一做法缺少证据支持,专家组不推荐常规使用抗生素预防感染[12, 23]。导管相关性血流感染发病机制主要原因是细菌在血管内导管的定植,穿刺部位皮肤菌群定植导管尖端是常见原因。典型表现为使用或维护静脉输液港后,出现寒颤、高热伴有白细胞升高等表现。怀疑导管相关性血流感染时,应暂停使用静脉输液港,同时抽取港体内和外周血作血培养和药敏试验,根据试验结果选用敏感抗生素全身治疗,使用“抗生素锁定疗法”(将抗生素注入并保留在港座及导管内,常规应用时间不超过3 d)进行封管。经抗感染治疗(通常不超过5 d)无效后,应立即取出静脉输液港[12, 23]。静脉输液港导管相关性血栓主要是指导管外壁或导管内通路中血凝块的形成。大多数导管相关性血栓无明显临床症状,常在使用或维护过程中发现输液速度降低,回抽导管内无回血。预防措施包括:正确护理、注意无菌操作及避免术中反复穿刺导致的血管内膜损伤、导管尖端位置正确。一旦明确为导管相关性血栓,首选抗凝治疗,抗凝药物大多数指南建议初始治疗首选低分子肝素或利伐沙班[12, 23-24],一般不推荐溶栓治疗。临床认为保守治疗无效必须拔出导管时,抗凝治疗应至拔除导管后至少3个月。预防性抗凝治疗对预防导管相关性血栓疗效及副反应不明确,专家组不推荐预防性抗凝。导管阻塞是由于导管扭曲夹闭管腔或血凝块及其他物质沉积管腔,导致输液不畅或回抽血困难,通过定期肝素冲洗管腔和正压封管技术可以降低导管的阻塞率。血栓性堵塞处理方法:根据临床观察和体会,可以考虑给予尿激酶 (5000 kU/L,2~5 mL)正压封管,30~120 min 后抽出,重复上述步骤。纤维蛋白鞘是覆盖于植入导管表面的含有由纤维蛋白血栓进一步发展而成的血管化纤维结缔组织,通常包裹导管外壁及导管端孔,可引起导管功能丧失。静脉造影是确诊纤维蛋白鞘形成的主要方法。溶解纤维蛋白鞘常用药物包括:尿激酶、链激酶和阿替普酶等。导管断裂和移位是罕见但严重的晚期并发症之一,导管断裂发生率在0.1%~2.1%,可能危险因素包括导管的长期使用和重复操作,制造缺陷及材料老化、降解。经锁骨下静脉穿刺途径时,夹闭综合征是发生断裂的主要原因。导管移位首发表现为导管功能障碍,移位的导管须采用介入技术处理,避免血栓栓塞。 静脉港植入的术中并发症还包括:心律失常、胸导管损伤、神经损伤、导管移位、导管无法植入等;术后并发症还包括:感染或非感染原因导致的皮肤软组织损伤、导管断裂或破裂、导管异位、药物外渗等,由于发生率相对较低,并且相关的概念、发生机制或临床处理没有形成统一意见,特别是针对乳腺癌病人的相关参考文献较少且证据等级较低,故未在本指南中详细说明。 6.2 PICC常见并发症预防和处理 对于PICC常见的机械性静脉炎,建议置管前对乳腺癌病人进行心理护理,冲洗手套上滑石粉,预冲导管并且在送管时动作轻柔。在PICC置管后建议抬高患肢并对肿胀部位进行热敷、药物涂抹(喜疗妥)、理疗(紫外线照射),可适当增加手指的精细动作(握拳、松拳)训练,避免肘关节的过度活动;抬高患肢,促进静脉的回流,减轻症状。预防及治疗细菌性静脉炎需严格无菌操作,如有细菌性静脉炎表现应进行血培养,及时给予抗菌素,必要时拔出PICC导管。乳腺癌病人出现血栓性静脉炎应有专科医生会诊,制动,禁忌按摩与热敷血栓侧肢体,抬高患肢30°;每日测量上臂臂围,观察患肢肿胀、麻木、皮温、颜色及疼痛情况;50%硫酸镁溶液200 mL联合地塞米松20 mg混合液湿敷,和喜疗妥软膏外涂或七叶皂凝胶20 g联合地塞米松20 mg混合液外涂交替使用[48];同时肝素稀释液冲管或遵医嘱尿激酶溶栓;若情况严重或肢体肿胀不能消失,需拔出PICC导管。导管堵塞应首先明确导管末端位置是否正确,是否打折,若导管末端位置正确,对导管进行脉冲式冲管,同时尽量降低胸腔压力。血凝性导管堵塞可以考虑给予尿激酶(5000 kU/L,2~5 mL)正压封管,30~120 min后抽出[49],必要时拔出PICC导管。预防非血栓性导管堵塞要求保证正确冲管,合理输入药物及掌握药物配伍禁忌。一旦发生非血栓性导管堵塞,解除导管阻塞的药物因病因不同而有区别,如由脂肪乳引起应选择75%乙醇,药物沉积引起应根据药物的pH值选择弱酸性液或碳酸氢钠等[9]。预防导管相关性感染需做好无菌防护,对导管穿刺位置固定妥当,使用PICC时限制输入完全肠外营养(TPN)的导管输入其他药物。一旦发生导管相关性感染,尽早进行血培养,局部伴有感染者每天换药,同时局部或全身使用抗菌素,必要时拔出PICC导管。出现PICC导管脱出应缝合固定导管。预防导管脱出的措施包括换药方法正确、动作轻柔;护士对病人进行宣教以及专业护士操作同等重要。 6.3 CVC常见并发症预防和处理 穿刺部位出血或血肿,局部压迫即可。误穿动脉常见于颈动脉及锁骨下动脉,应立即拔出穿刺针,指压20 min,否则易发生血肿。锁骨下静脉穿刺易出现气胸及血气胸,发生后可按一般气胸处理。预防此并发症主要在于避免穿刺点过低,避免扩皮器进入太深。空气栓塞少见,但可致命,一旦发生,应紧急抢救,病人左侧头低位,呼吸循环支持,高浓度吸氧,同时经皮行右心房或右心室穿刺抽气。导管感染主要见于股静脉穿刺,一旦确诊应立即拔除导管,并作细菌培养,应用抗生素治疗。 7 乳腺癌病人CVA维护7.1 植入式静脉输液港的维护 静脉输液港的植入和(或)维护、监测等工作应由具有输液治疗教育背景、接受过培训并考核合格的个人和(或)团队承担,可以降低导管相关血流感染的发生率。使用无损伤针可以保护注射座的穿刺硅胶隔膜,确保静脉输液港的使用寿命。目前,较少研究探讨乳腺癌病人静脉输液港无损伤针的更换频率及最长留置时间,相关证据不足,但我国的卫生行业标准规定持续输液时应每7 d更换1次无损伤针,有助于皮肤愈合和预防局部感染。穿刺后必须通过抽吸回血评估导管的通畅情况,确保导管位置及其功能正常。如遇到阻力或抽不出回血的情况,排除导管夹闭、导管反折或敷料影响等外部原因后,可尝试让病人变换体位、抬高置港侧肢体等方法,也可尝试输注0.9%生理盐水进行观察,输液通畅可继续使用);内部原因如导管断裂、导管异位和血栓形成等需要通过胸片、彩超等检查进行排查。 穿刺后无损伤针针翼及延长管需使用无菌敷料进行固定和保护,避免该部位受到污染。如穿刺点存在渗血、渗液等情况,可使用无菌纱布覆盖进行吸收。无菌透明敷料应至少每7 d更换1次,无菌纱布敷料应至少每2 d更换1次,若出现潮湿、松动、污染时应及时更换。建议至少使用10 mL注射器来评估静脉通路装置的功能,因为较大直径的注射器产生的注射压力较低,有利于保护导管。脉冲式手法可以使管腔内产生涡流,增加冲洗效果;正压封管可以避免导管尖端的血液回流形成血栓。但是,需要更多的临床研究对乳腺癌病人脉冲式冲管手法的真实效果提供依据。关于治疗间歇期进行静脉输液港冲封管维护的频率,我国卫生行业标准规定,静脉输液港在治疗间歇期应至少每4周维护1次。 7.2 PICC的维护 PICC的维护、监测等工作应由具有输液治疗教育背景、接受过培训并考核合格的个人和(或)团队承担,可以降低PICC相关并发症发生率。PICC植入后要求第1个24 h必须换药[50],以后伤口愈合良好,无感染、渗血时,每7 d更换敷料1次[30]。如伤口敷料松动、潮湿,随时更换。若穿刺部位有红肿、皮疹、渗出、过敏等异常情况,可缩短更换敷料时间,并须连续观察局部变化情况[31]。每次更换敷料时应严格执行无菌操作,贴膜要自下向上撕取,并注意固定导管,防止脱管。肝素帽或无针接头应至少7 d更换1次[51]。2014年原国家卫生和计划生育委员会颁布了最新的静脉输液治疗行标,明确规定了中心静脉导管包括 PICC 都必须通过抽回血来确定导管在血管内。静脉输液护理学会 (Infusion Nursing Society,INS)《2016输液治疗实践标准》冲管与封管的标准[51]:每次输液之前,推荐使用 0.9% 氯化钠溶液冲洗血管通路装置,并抽回血,以评估导管功能,预防并发症。冲管和封管时的冲洗均须遵循 SASH 原则[32](S 指生理盐水,A 指药物注射,H 指肝素盐水)。脉冲式冲管[33]:使用 10 mL 以上注射器冲管,边冲边停顿,使生理盐水在导管内形成小漩涡,有利于将导管内的残留药液冲洗干净。正压封管技术[34]:脉冲式推注封管液剩余0.5~1.0 mL时,一边推封管液,一边拔针头,推液速度大于拔针速度,确保留置导管内充满封管液,使导管内无药液或血液,以减少血液反流入管腔,降低堵管、导管相关性血流感染等风险。PICC可用0~10 kU/L的肝素溶液封管。 7.3 CVC的维护 穿刺点每2 d更换敷料,伤口敷料松动、潮湿或污染时,随时更换[30]。输液或治疗完毕,用5~10 mL浓度0~10 kU/L的肝素溶液封管。输注血液制品、营养液、高浓度液体后需采用20 mL生理盐水脉冲式冲管1次。24 h持续补液病人需每日冲管1次。留置间歇期,可来福接头每周冲管1次,肝素帽封堵每日冲管1次。 7.1 植入式静脉输液港的维护 静脉输液港的植入和(或)维护、监测等工作应由具有输液治疗教育背景、接受过培训并考核合格的个人和(或)团队承担,可以降低导管相关血流感染的发生率。使用无损伤针可以保护注射座的穿刺硅胶隔膜,确保静脉输液港的使用寿命。目前,较少研究探讨乳腺癌病人静脉输液港无损伤针的更换频率及最长留置时间,相关证据不足,但我国的卫生行业标准规定持续输液时应每7 d更换1次无损伤针,有助于皮肤愈合和预防局部感染。穿刺后必须通过抽吸回血评估导管的通畅情况,确保导管位置及其功能正常。如遇到阻力或抽不出回血的情况,排除导管夹闭、导管反折或敷料影响等外部原因后,可尝试让病人变换体位、抬高置港侧肢体等方法,也可尝试输注0.9%生理盐水进行观察,输液通畅可继续使用);内部原因如导管断裂、导管异位和血栓形成等需要通过胸片、彩超等检查进行排查。 穿刺后无损伤针针翼及延长管需使用无菌敷料进行固定和保护,避免该部位受到污染。如穿刺点存在渗血、渗液等情况,可使用无菌纱布覆盖进行吸收。无菌透明敷料应至少每7 d更换1次,无菌纱布敷料应至少每2 d更换1次,若出现潮湿、松动、污染时应及时更换。建议至少使用10 mL注射器来评估静脉通路装置的功能,因为较大直径的注射器产生的注射压力较低,有利于保护导管。脉冲式手法可以使管腔内产生涡流,增加冲洗效果;正压封管可以避免导管尖端的血液回流形成血栓。但是,需要更多的临床研究对乳腺癌病人脉冲式冲管手法的真实效果提供依据。关于治疗间歇期进行静脉输液港冲封管维护的频率,我国卫生行业标准规定,静脉输液港在治疗间歇期应至少每4周维护1次。 7.2 PICC的维护 PICC的维护、监测等工作应由具有输液治疗教育背景、接受过培训并考核合格的个人和(或)团队承担,可以降低PICC相关并发症发生率。PICC植入后要求第1个24 h必须换药[50],以后伤口愈合良好,无感染、渗血时,每7 d更换敷料1次[30]。如伤口敷料松动、潮湿,随时更换。若穿刺部位有红肿、皮疹、渗出、过敏等异常情况,可缩短更换敷料时间,并须连续观察局部变化情况[31]。每次更换敷料时应严格执行无菌操作,贴膜要自下向上撕取,并注意固定导管,防止脱管。肝素帽或无针接头应至少7 d更换1次[51]。2014年原国家卫生和计划生育委员会颁布了最新的静脉输液治疗行标,明确规定了中心静脉导管包括 PICC 都必须通过抽回血来确定导管在血管内。静脉输液护理学会 (Infusion Nursing Society,INS)《2016输液治疗实践标准》冲管与封管的标准[51]:每次输液之前,推荐使用 0.9% 氯化钠溶液冲洗血管通路装置,并抽回血,以评估导管功能,预防并发症。冲管和封管时的冲洗均须遵循 SASH 原则[32](S 指生理盐水,A 指药物注射,H 指肝素盐水)。脉冲式冲管[33]:使用 10 mL 以上注射器冲管,边冲边停顿,使生理盐水在导管内形成小漩涡,有利于将导管内的残留药液冲洗干净。正压封管技术[34]:脉冲式推注封管液剩余0.5~1.0 mL时,一边推封管液,一边拔针头,推液速度大于拔针速度,确保留置导管内充满封管液,使导管内无药液或血液,以减少血液反流入管腔,降低堵管、导管相关性血流感染等风险。PICC可用0~10 kU/L的肝素溶液封管。 7.3 CVC的维护 穿刺点每2 d更换敷料,伤口敷料松动、潮湿或污染时,随时更换[30]。输液或治疗完毕,用5~10 mL浓度0~10 kU/L的肝素溶液封管。输注血液制品、营养液、高浓度液体后需采用20 mL生理盐水脉冲式冲管1次。24 h持续补液病人需每日冲管1次。留置间歇期,可来福接头每周冲管1次,肝素帽封堵每日冲管1次。 8 乳腺癌病人CVA的取出8.1 植入式静脉输液港的取出 已结束治疗但需长期保留者,可按上述正常维护程序,按时维护。对不需要保留者或不适宜继续保留的输液港可取出。专家组认为早期乳腺癌病人在完成全身辅助治疗后即可取出输液港。静脉输液港取出后需查看装置是否完整,皮下隧道开口处可 “8”字缝合,静脉穿刺处需压迫5 min;清除注射座周围的纤维包膜组织,严密止血,缝合皮下组织和皮肤,无菌敷料覆盖手术切口[16-17]。 8.2 PICC的取出 PICC拔管时病人置于头低仰卧位或仰卧位,将导管出口部位(如颈部、手臂)置于低于病人心脏水平处[52]。拔管时指导病人屏住呼吸,在拔除导管的最后部分时进行Valsalva操作(深吸气后屏气,再用力做呼气动作),或在病人呼气末屏气状态下拔除[52]。导管拔出后确认其完整性。病人拔管后保持平卧30 min,同时应用无菌敷料密闭穿刺点至少24 h,之后评估穿刺点愈合情况。 8.3 CVC的取出 CVC拔管时病人置于头低足高位或仰卧位,拔管前夹毕开关,嘱病人屏气后保持住,在拔除导管的最后部分时进行Valsalva操作[52],或在病人呼气末屏气状态下拔除,导管拔出后确认其完整性,操作者左手示指贴于皮肤进针点,中指、环指沿血管走行按压,按压止血后应以无菌纱布覆盖,外贴无菌密闭性透明贴膜(标记好时间,一般于24 h后去除),便于观察。拔管后病人需要静卧30~60 min。 8.1 植入式静脉输液港的取出 已结束治疗但需长期保留者,可按上述正常维护程序,按时维护。对不需要保留者或不适宜继续保留的输液港可取出。专家组认为早期乳腺癌病人在完成全身辅助治疗后即可取出输液港。静脉输液港取出后需查看装置是否完整,皮下隧道开口处可 “8”字缝合,静脉穿刺处需压迫5 min;清除注射座周围的纤维包膜组织,严密止血,缝合皮下组织和皮肤,无菌敷料覆盖手术切口[16-17]。 8.2 PICC的取出 PICC拔管时病人置于头低仰卧位或仰卧位,将导管出口部位(如颈部、手臂)置于低于病人心脏水平处[52]。拔管时指导病人屏住呼吸,在拔除导管的最后部分时进行Valsalva操作(深吸气后屏气,再用力做呼气动作),或在病人呼气末屏气状态下拔除[52]。导管拔出后确认其完整性。病人拔管后保持平卧30 min,同时应用无菌敷料密闭穿刺点至少24 h,之后评估穿刺点愈合情况。 8.3 CVC的取出 CVC拔管时病人置于头低足高位或仰卧位,拔管前夹毕开关,嘱病人屏气后保持住,在拔除导管的最后部分时进行Valsalva操作[52],或在病人呼气末屏气状态下拔除,导管拔出后确认其完整性,操作者左手示指贴于皮肤进针点,中指、环指沿血管走行按压,按压止血后应以无菌纱布覆盖,外贴无菌密闭性透明贴膜(标记好时间,一般于24 h后去除),便于观察。拔管后病人需要静卧30~60 min。
参考文献 (在框内滑动手指即可浏览) [1] Ma L, Ge ZC, Xin L, et al. Clinical practice guidelines for breast cancer implantable intravenous infusion ports: Chinese Society of Breast Surgery practice guidelines 2021 [J]. Chin Med J, 2021, 134(16): 1894-1896. [2] Zhang P, Du J, Fan C, et al. Utility of totally implantable venous access ports in patients with breast cancer [J]. Breast J, 2020, 26(2): 333-334. [3] Taxbro K, Hammarskjöld F, Thelin B, et al. Clinical impact of peripherally inserted central catheters vs implanted port catheters in patients with cancer: an open-label, randomised, two-centre trial [J]. Br J Anaesth, 2019, 122(6): 734-741. [4] Xu H, Chen R, Jiang C, et al. Implanting totally implantable venous access ports in the upper arm is feasible and safe for patients with early breast cancer [J]. J Vasc Access, 2020, 21(5): 609-614. [5] 王啟瑶, 莫霖, 李霞, 等. 颈内静脉与锁骨下静脉植入静脉输液港的有效性和安全性的Meta分析 [J]. 解放军护理杂志, 2018, 35(22): 7. [6] Kato K, Iwasaki Y, Onodera K, et al. Totally implantable venous access port via the femoral vein in a femoral port position with CT-venography [J]. J Surg Oncol, 2016, 114(8): 1024-1028. [7] Merrer J, De jonghe B, Golliot F, et al. Complications of femoral and subclavian venous catheterization in critically ill patients: a randomized controlled trial [J]. JAMA, 2001, 286(6): 700-707. [9] Gorski LA. Infusion Nursing Standards of Practice [J]. J Infus Nurs, 2007, 30(3): 151-152. [10] Pittiruti M, Hamilton H, Biffi R, et al. ESPEN Guidelines on Parenteral Nutrition: central venous catheters (access, care, diagnosis and therapy of complications) [J]. Clin Nutr, 2009, 28(4): 365-377. [11] 中华人民共和国国家卫生健康委员会.静脉治疗护理技术操作规范(WS/T 433-2013 [S/OL].(2013-11-14)[2021-10-11].http://www.nhc.gov.cn/ewebeditor/uploadfile/2014/12/2014 [12] Sousa B, Furlanetto J, Hutka M, et al. Central venous access in oncology: ESMO Clinical Practice Guidelines [J]. Ann Oncol, 2015, 26( suppl 5):v152-168. [13] Wyer N. Parenteral nutrition: indications and safe management [J]. Br J Community Nurs, 2017, 22(suppl 7): 22-28. [14] Bishop L, Dougherty L, Bodenham A, et al. Guidelines on the insertion and management of central venous access devices in adults [J]. Int J Lab Hematol, 2007, 29(4): 261-278. [16] Gebhard RE, Szmuk P, Pivalizza EG, et al. The accuracy of electrocardiogram-controlled central line placement [J]. Anesth Analg, 2007, 104(1): 65-70. [17] Mcgee WT, Ackerman BL, Rouben LR, et al. Accurate placement of central venous catheters: a prospective, randomized, multicenter trial [J]. Crit Care Med, 1993, 21(8): 1118-1123. [18] Yin YX, Gao W, Li XY, et al. Insertion of peripherally inserted central catheters with intracavitary electrocardiogram guidance: A randomized multicenter study in China [J]. J Vasc Access, 2019, 20(5): 524-529. [19] Li A, Jiao J, Zhang Y, et al. A randomized controlled study of bedside electrocardiograph-guided tip location technique & the traditional chest radiography tip location technique for peripherally inserted central venous catheter in cancer patients [J]. Indian J Med Res, 2018, 147(5): 477-483. [21] Practice Guidelines for Central Venous Access 2020: An Updated Report by the American Society of Anesthesiologists Task Force on Central Venous Access [J]. Anesthesiology, 2020, 132(1): 8-43. [22] Wu SY, Ling Q, Cao LH, et al. Real-time two-dimensional ultrasound guidance for central venous cannulation: a meta-analysis [J]. Anesthesiology, 2013, 118(2): 361-375. [23] 中华医学会外科学分会乳腺外科学组. 乳腺癌植入式静脉输液港临床应用专家共识及技术操作指南(2017版) [J]. 中国实用外科杂志, 2017, 37(12): 1377-1382. [24] Kovacs MJ, Kahn SR, Rodger M, et al. A pilot study of central venous catheter survival in cancer patients using low-molecular-weight heparin (dalteparin) and warfarin without catheter removal for the treatment of upper extremity deep vein thrombosis (The Catheter Study) [J]. J Thromb Haemost,2007, 5(8): 1650-1653. [25] Gorski LA, Hadaway L, Hagle ME, et al. Infusion Therapy Standards of Practice, 8th Edition [J]. J Infus Nurs, 2021, 44(1S suppl 1):1-224. [26] O'grady NP, Alexander M, Burns LA, et al. Guidelines for the prevention of intravascular catheter-related infections [J]. Clin Infect Dis, 2011, 52(9): e162-193. [27] Robinson MK, Mogensen KM, Grudinskas GF, et al. Improved care and reduced costs for patients requiring peripherally inserted central catheters: the role of bedside ultrasound and a dedicated team [J]. JPEN J Parenter Enteral Nutr, 2005, 29(5): 374-379. [28] Simcock L. No Going Back: Advantages of Ultrasound- Guided Upper Arm PICC Placement [J]. J Assoc Vasc Access, 2008, 13(4): 191-197. [29] Shiono M, Takahashi S, Kakudo Y, et al. Upper arm central venous port implantation: a 6-year single institutional retrospective analysis and pictorial essay of procedures for insertion [J]. PloS One, 2014, 9(3): e91335. [30] Schreiber S, Zanchi C, Ronfani L, et al. Normal saline flushes performed once daily maintain peripheral intravenous catheter patency: a randomised controlled trial [J]. Arch Dis Child, 2015, 100(7): 700-703. [31] Gorski LA. The 2016 Infusion Therapy Standards of Practice [J]. Home Healthc Now, 2017, 35(1): 10-18. [32] Bowers L, Speroni KG, Jones L, et al. Comparison of occlusion rates by flushing solutions for peripherally inserted central catheters with positive pressure Luer-activated devices [J]. J Infus Nurs, 2008, 31(1): 22-27. [33] Lenz JR, Degnan DD, Hertig JB, et al. A Review of Best Practices for Intravenous Push Medication Administration [J]. J Infus Nurs, 2017, 40(6): 354-358. [34] Institute for Safe Medication Practice(ISMP). ISMP Safe pracetice guidelines for adult IV push medications[EB/OL].(2015- 07-23) [35] Loveday HP, Wilson JA, Pratt RJ, et al. epic3: national evidence-based guidelines for preventing healthcare-associated infections in NHS hospitals in England [J]. J Hosp Infect, 2014, 86 (suppl 1):1-70. [36] Rupp SM, Apfelbaum JL, Blitt C, et al. Practice guidelines for central venous access: a report by the American Society of Anesthesiologists Task Force on Central Venous Access [J]. Anesthesiology, 2012, 116(3): 539-573. [38] Estrada-orozco K, Cantor-cruz F, Larrotta-castillo D, et al. Central venous catheter insertion and maintenance: Evidence-based clinical recommendations] [J]. Rev Colomb Obstet Ginecol, 2020, 71(2): 115-162. [39] Cruz RP, Pires RC, Rodrigues N, et al. Central venous catheterization: An updated review of historical aspects, indications, techniques, and complications [J]. Transl Surg, 2017, 2(3): 66-70. [40] Vesely TM. Central venous catheter tip position: a continuing controversy [J]. J Vasc Interv Radiol, 2003, 14(5): 527-534. [41] Caers J, Fontaine C, Vinh-hung V, et al. Catheter tip position as a risk factor for thrombosis associated with the use of subcutaneous infusion ports [J]. Support Care Cancer, 2005, 13(5): 325-331. [42] Cadman A, Lawrance JA, Fitzsimmons L, et al. To clot or not to clot? That is the question in central venous catheters [J]. Clin Radiol, 2004, 59(4): 349-355. [43] Collier PE, Ryan JJ, Diamond DL. Cardiac tamponade from central venous catheters. Report of a case and review of the English literature [J]. Angiology, 1984, 35(9): 595-600. [44] Chabanier A, Dany F, Brutus P, et al. Iatrogenic cardiac tamponade after central venous catheter [J]. Clin Cardiol, 1988, 11(2): 91-99. [45] Petersen J, Delaney JH, Brakstad MT, et al. Silicone venous access devices positioned with their tips high in the superior vena cava are more likely to malfunction [J]. Am J Surg, 1999, 178(1): 38-41. [46] Racadio JM, Doellman DA, Johnson ND, et al. Pediatric peripherally inserted central catheters: complication rates related to catheter tip location [J]. Pediatrics, 2001, 107(2): E28. [47] Gavin NC, Button E, Castillo MI, et al. Does a dedicated lumen for parenteral nutrition administration reduce the risk of catheter-related bloodstream infections? A systematic literature review [J]. J Infus Nurs, 2018, 41(2): 122-130. [48] 邓健, 徐廷惠, 李成琳, 等. PICC导管在肿瘤大剂量化疗中的应用及护理 [J]. 护士进修杂志, 2001, 16(9): 672-673. [49] 袁丽, 罗艳, 许蓉芳, 等. 不同浓度尿激酶及停留时间对PICC堵管再通效果的体外模拟研究 [J]. 护士进修杂志, 2018, 33(11): 973-977. [50] Whiting D, Dinardo JA. TEG and ROTEM: technology and clinical applications [J]. Am J Hematol, 2014, 89(2): 228-232. [51] Gorski LA, Hadaway L, Hagle ME, et al. Infusion therapy standards of practice [J]. Home Healthc Now, 2016, 39(suppl 1): 1-159. [52] Feil M. Reducing Risk of Air Embolism Associated with Central Venous Access Devices [J]. Pa Patient Saf Advis,2012, 9(2):58-64. (2021-12-20收稿) 版权声明 本文为《中国实用外科杂志》原创文章。其他媒体、网站、公众号等如需转载本文,请联系本刊编辑部获得授权,并在文题下醒目位置注明“原文刊发于《中国实用外科杂志》,卷(期):起止页码”。谢谢合作!返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |