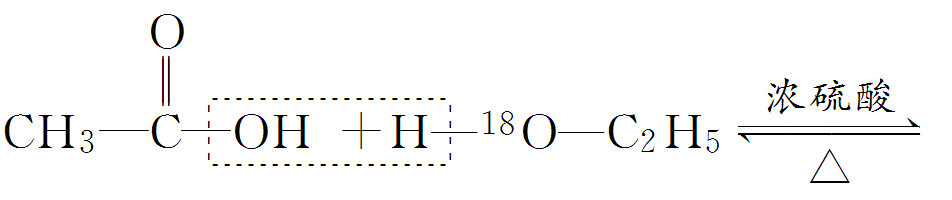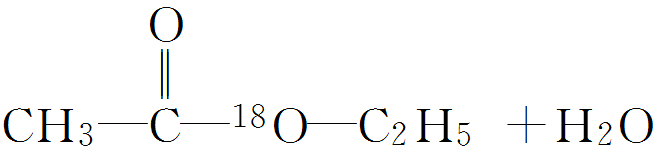高中化学乙烯、乙醇、乙酸的结构与性质!(可下载打印) |
您所在的位置:网站首页 › 乙烯生成乙醇的化学方程式 › 高中化学乙烯、乙醇、乙酸的结构与性质!(可下载打印) |
高中化学乙烯、乙醇、乙酸的结构与性质!(可下载打印)
|
②使酸性高锰酸钾溶液(紫色)褪色。 (2)加成反应 有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。 乙烯可与H 2 、HCl、Br 2 、Cl 2 、H 2 O等物质发生加成反应。 CH2 ==CH2 +Br2 ―→CH 2 BrCH2 Br(乙烯可使溴水或溴的四氯化碳溶液褪色); CH2 ==CH2 +H2 CH3 CH3 ; CH2 ==CH2 +HClCH3 CH2 Cl; CH2 ==CH2 +H2 OCH3 CH2 OH。 (3)加聚反应 nCH2 ==CH2
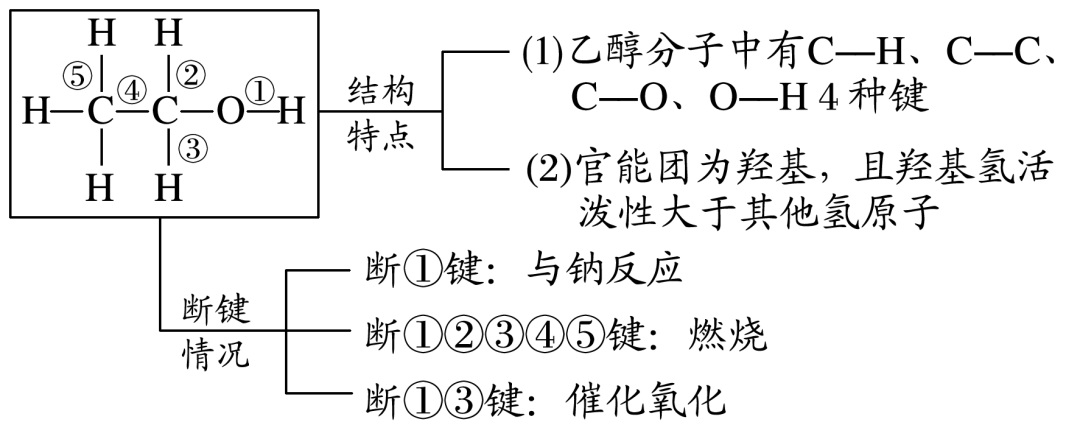
(聚乙烯)。 【特别提醒】制取氯乙烷时若用乙烷和Cl2 进行取代反应得到的是混合物,副产物太多,生成物不纯,若乙烯和HCl进行加成反应可制得较纯净的氯乙烷,产物单一。 4. 用途 (1)重要化工原料,用来制聚乙烯塑料、聚乙烯纤维、乙醇等。 (2)可作水果催熟剂。 二、乙醇的结构与性质 1.乙醇结构特点、断键与性质的关系
2. 乙醇与钠的反应实验 实验操作 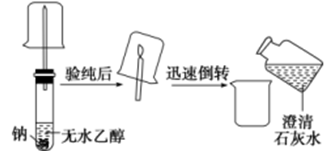 实验现象
①开始钠位于试管底部,最终慢慢消失,试管中有气泡产生;②放出的气体在空气中安静燃烧,烧杯内壁有水珠产生;③向烧杯中加入澄清石灰水后,石灰水无明显现象产生。
实验结论
乙醇与钠反应生成氢气,化学方程式为:2Na+2CH3 CH2 OH2CH3 CH2 ONa+H2 ↑。
实验现象
①开始钠位于试管底部,最终慢慢消失,试管中有气泡产生;②放出的气体在空气中安静燃烧,烧杯内壁有水珠产生;③向烧杯中加入澄清石灰水后,石灰水无明显现象产生。
实验结论
乙醇与钠反应生成氢气,化学方程式为:2Na+2CH3 CH2 OH2CH3 CH2 ONa+H2 ↑。
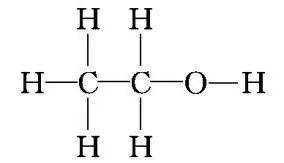
①乙醇与钠反应说明乙醇的结构是
,而不是
。 ②乙醇乙醇羟基上的氢不如水中的氢活泼,乙醇分子中的—OH键比H2 O分子中的O—H键更稳定。 羟基中氢原子的活泼性 水与钠反应 乙醇与钠反应 钠的变化 钠粒浮于水面,熔成闪亮的小球,并快速地四处游动,很快消失 钠粒开始沉于试管底部,未熔化,最终慢慢消失 声的现象 有“嘶嘶”声响 无声响 气体检验 点燃,发出淡蓝色的火焰 点燃,发出淡蓝色的火焰 实验结论 钠的密度小于水,熔点低。钠与水剧烈反应,生成氢气。水分子中羟基上的氢原子比较活泼 钠的密度比乙醇的大。钠与乙醇缓慢反应生成氢气。乙醇中羟基上的氢原子相对不活泼 化学方程式 2Na+2H2 O===2NaOH+H2 ↑ 2Na+2CH3 CH2 OH―→2CH3 CH2 ONa+H2 ↑ 3.乙醇的氧化反应 (1)燃烧 化学方程式为CH 3 CH2 OH+3O2 2CO2 +3H2 O。 (2)催化氧化 实验操作 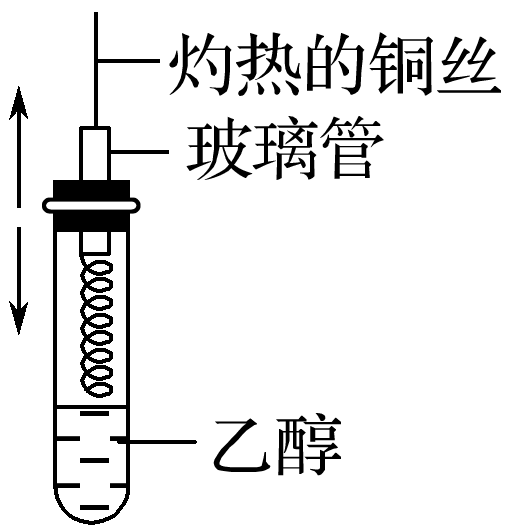 实验现象
在空气中灼烧过的铜丝表面由黑变红,试管中的液体有刺激性气味
化学方程式
2CH3 CH2 OH+O2 2CH3 CHO+2H2 O
实验现象
在空气中灼烧过的铜丝表面由黑变红,试管中的液体有刺激性气味
化学方程式
2CH3 CH2 OH+O2 2CH3 CHO+2H2 O
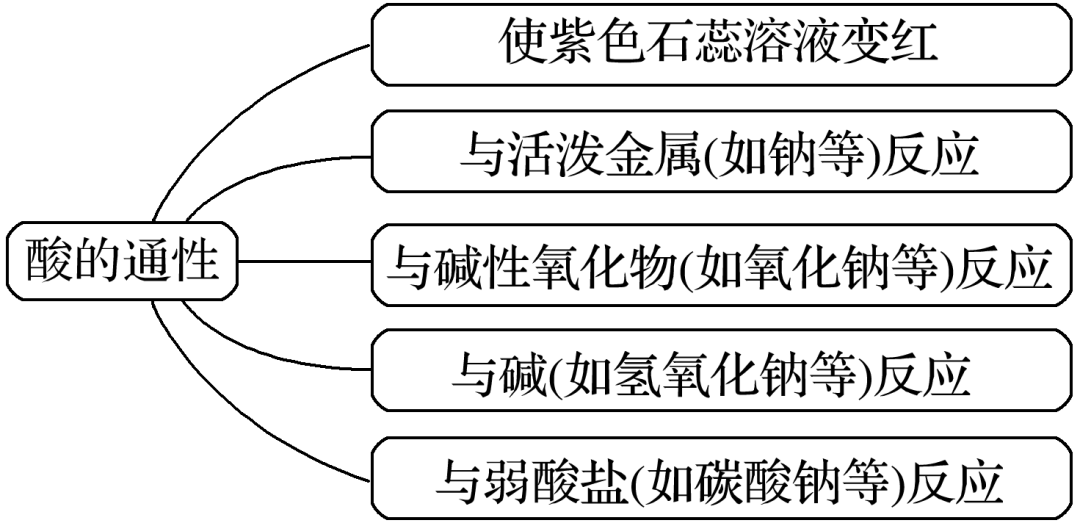
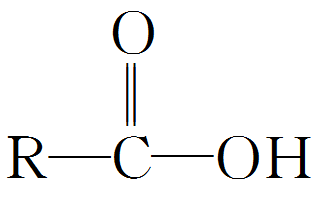
(2)与强氧化剂反应 乙醇可被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化,生成乙酸。交通警察检查司机是否酒后驾车的装置中,含有橙色的酸性重铬酸钾,当其遇到乙醇时橙色变为绿色,由此可以断定司机饮酒超过规定相当标准。 【特别提醒】在乙醇的催化氧化实验中,要把铜丝制成螺旋状,是为了增大接触受热面积,增强实验效果。 三、乙酸的性质 1.乙酸酸性的实验探究 (1)弱酸性 乙酸在水中的电离方程式为CH 3 COOH CH 3 COO − +H + ,是一元弱酸,具有酸的通性。
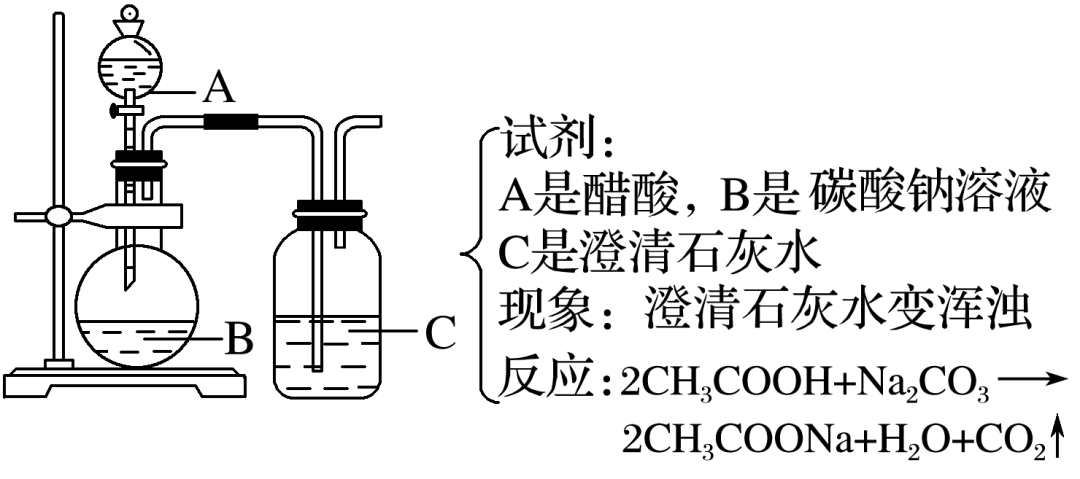
(2)醋酸与碳酸酸性强弱的比较实验
2 .乙酸与乙醇的酯化反应实验 酯化反应:酸跟醇作用生成酯和水的反应叫酯化反应。酯化反应是可逆反应,反应物不能完全转化成生成物。反应比较慢,一般要加入浓硫酸作催化剂,并加热。酯化反应的实质是酸脱羟基、醇脱氢(羟基上的)。乙酸与乙醇的酯化反应归纳如下: 实验步骤 在试管里先加入3 mL无水乙醇,然后一边摇动一边慢慢地加入2 mL浓硫酸和2 mL无水乙酸。然后用酒精灯小心均匀地加热试管3~5 min。同时将导管通到装有饱和碳酸钠溶液的试管中,观察现象,注意产物的气味 实验装置 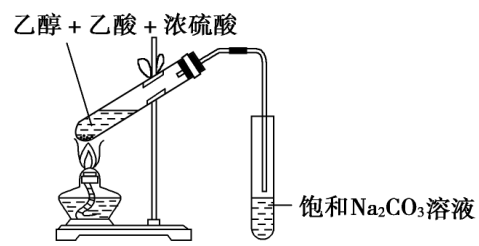 实验现象
饱和Na2 CO3 溶液的液面上有透明的油状液体生成,且能闻到香味
反应方程式
CH3 COOH+C2 H5 OHCH3 COOC2 H5 +H2 O
反应机理
羧酸脱去羧基上的羟基,醇脱去羟基上的氢原子:
问题思考
试剂的加入顺序:在试管中加入3 mL乙醇,然后边摇动试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸
浓硫酸的作用:做催化剂提高反应速率;做脱水剂使反应向正反应方向进行
饱和碳酸钠溶液来的作用是吸收挥发出来的乙醇和中和挥发出来的乙酸;降低酯的溶解度,使乙酸乙酯和碳酸钠溶液分层
导管不能伸入饱和碳酸钠溶液中的原因是防止倒吸
采用分液法分离右侧试管中的液体混合物,所得上层液体即为乙酸乙酯
注意事项
对乙酸、乙醇、浓H2 SO4 的混合液加热时,要用小火慢慢加热,并且温度不能过高,目的是尽量减少乙酸、乙醇的挥发,提高乙酸、乙醇的转化率
实验现象
饱和Na2 CO3 溶液的液面上有透明的油状液体生成,且能闻到香味
反应方程式
CH3 COOH+C2 H5 OHCH3 COOC2 H5 +H2 O
反应机理
羧酸脱去羧基上的羟基,醇脱去羟基上的氢原子:
问题思考
试剂的加入顺序:在试管中加入3 mL乙醇,然后边摇动试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸
浓硫酸的作用:做催化剂提高反应速率;做脱水剂使反应向正反应方向进行
饱和碳酸钠溶液来的作用是吸收挥发出来的乙醇和中和挥发出来的乙酸;降低酯的溶解度,使乙酸乙酯和碳酸钠溶液分层
导管不能伸入饱和碳酸钠溶液中的原因是防止倒吸
采用分液法分离右侧试管中的液体混合物,所得上层液体即为乙酸乙酯
注意事项
对乙酸、乙醇、浓H2 SO4 的混合液加热时,要用小火慢慢加热,并且温度不能过高,目的是尽量减少乙酸、乙醇的挥发,提高乙酸、乙醇的转化率
深化理解 1.乙烯的一些性质辨析 (1)乙烯在燃烧时,火焰比甲烷明亮,并伴有黑烟,这是由于乙烯中碳的质量分数比甲烷高的缘故。据此可鉴别乙烯和甲烷。 (2)乙烯被酸性KMnO4 溶液氧化后得到的产物是CO2 ,故除去甲烷或乙烷中的乙烯不能使用酸性KMnO4 溶液。 (3)乙烯因发生加成反应能使溴水和溴的CCl4 溶液褪色,但现象有差异,乙烯通入溴水中,溴水褪色,液体分层;而乙烯通入溴的CCl4 溶液中,溶液只褪色不分层。 (4)乙烯使溴水和酸性KMnO4 溶液褪色原理不相同,前者为加成反应,后者为氧化反应。 2.羧基、醇羟基及水中氢原子活泼性比较
 R—OH
H—OH
钠
能反应
能反应
能反应(比醇反应剧烈)
氢氧化钠
能反应
不反应
不反应
碳酸氢钠
能反应
不反应
不反应
活泼性:羧酸(—OH)>水(—OH)>醇(—OH)
R—OH
H—OH
钠
能反应
能反应
能反应(比醇反应剧烈)
氢氧化钠
能反应
不反应
不反应
碳酸氢钠
能反应
不反应
不反应
活泼性:羧酸(—OH)>水(—OH)>醇(—OH)
3.酯化反应实验注意事项
(2)试剂的加入顺序:先加入乙醇,然后慢慢加入浓硫酸和乙酸。 (3)酯化反应的机理 通常用同位素示踪原子法来证明:如用含18 O的乙醇与乙酸反应,可以发现,生成物乙酸乙酯中含有18 O。
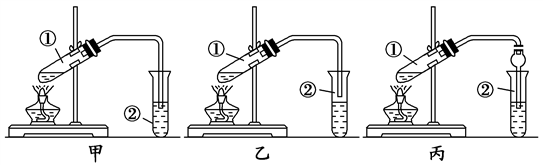
可见,发生酯化反应时,有机酸断C—O键,醇分子断O—H 键,即“酸去羟基,醇去氢”。 (4)浓硫酸 的作用 1.催化剂--加快反应速率 2.吸水剂--提高反应物的转化率 (5)饱和碳酸钠溶液的作用 1.降低乙酸乙酯的溶解度便于分层得到酯 2.中和挥发出来的乙酸 3.溶解挥发出来的乙醇 典型例题 例1(2020·江苏省锡山高级中学高一月考)在实验室中,下列除杂的方法中正确的是() A.溴苯中混有溴,加入KI 溶液,振荡,用汽油萃取出溴 B.乙烷中混有乙烯,通入H 2 在一定条件下反应,使乙烯转化为乙烷 C.硝基苯中混有浓硫酸和浓硝酸,将其倒入NaOH 溶液中,静置,分液 D.乙烯中混有CO 2 和SO 2 ,将其通入NaOH 溶液中洗气 答案CD 解析A、反应生成的I2 溶于溴苯,且汽油和溴苯混溶,应用氢氧化钠溶液除杂,故A错误; B、氢气和乙烷都是气体,不易分离,且无法控制H2 的量,故B错误; C、浓硝酸和浓硫酸可与氢氧化钠反应,而硝基苯不反应,且不溶于水,可用氢氧化钠溶液除杂,故C正确; D、乙烯与氢氧化钠不反应,CO2 和SO2 与氢氧化钠反应,可用于除杂,故D正确。 故选:CD。 例2(2020·北京八十中高一期中)能证明乙醇分子中含有一个羟基的事实是() A.乙醇容易挥发 B.乙醇能与水以任意比例互溶 C.乙醇完全燃烧生成CO 2 和H 2 O D.0.1 mol 乙醇与足量Na 反应生成0.05 mol H 2 答案D 解析A.乙醇容易挥发是乙醇的物理性质,与是否含有羟基无关,故A不符合题意; B.乙醇能和水以任意比互溶,是由于乙醇和水分子之间能形成氢键,不能说明乙醇中含几个羟基,故B不符合题意; C.乙醇燃烧生成二氧化碳和水,只能说明其含碳元素和氢元素,不能确定是否含有氧元素;即不能确定是否含有羟基,故C不符合题意; D.乙醇与生成的氢气的物质的量之比为0.1:0.05=2:1,说明乙醇分子中有一个活泼的氢原子可被金属钠取代(置换),即乙醇分子中有一个羟基,故D符合题意; 答案选D。 例3下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。 【实验目的】制取乙酸乙酯 【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。 【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置: 请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_______。
【实验步骤】 (1)用酒精灯对试管 ①加热;(2)将试管①固定在铁架台上(3)按所选择的装置组装仪器,在试管①中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;(4)在试管②中加入适量的饱和Na2 CO 3 溶液;(5)当观察到试管②中有明显现象时停止实验。 【问题讨论】 a.用序号写出该实验的步骤:____________; b.装好实验装置,加入药品前还应检查____________; c.写出试管 ①发生反应的化学方程式(注明反应条件):_____________________; d.试管 ②中饱和Na2 CO 3 溶液的作用是_____________________________。 【答案】【装置设计】乙 能防止倒吸 【实验步骤】a.(3)(2)(4)(1)(5) b.检查装置的气密性 c.CH3 COOH+C2 H5 OHCH3 COOC2 H5 +H2 O d.吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度,使其分层 【解析】【装置设计】乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸;球形干燥管导气的同时也起到防倒吸作用,则较合理的是装置是乙、丙。 【实验步骤】a.实验步骤:(3)按所选择的装置组装仪器,在试管①中先加入3mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸并加入碎瓷;(2)将试管①固定在铁架台上;(4)在试管②中加入适量的饱和Na2 CO3 溶液,并滴加几滴酚酞溶液;(1)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。b.实验前,要检查装置的气密性。c.酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为CH3 COOH+CH3 CH2 OHCH3 COOCH2 CH3 +H2 O。d.饱和Na2 CO3 溶液的作用有:吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度,使其分层。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |