更精准定义药物临床试验目标人群,《药物临床试验富集策略与设计指导原则(征求意见稿)》来了! |
您所在的位置:网站首页 › 临床试验中心筛选问题分析 › 更精准定义药物临床试验目标人群,《药物临床试验富集策略与设计指导原则(征求意见稿)》来了! |
更精准定义药物临床试验目标人群,《药物临床试验富集策略与设计指导原则(征求意见稿)》来了!
|
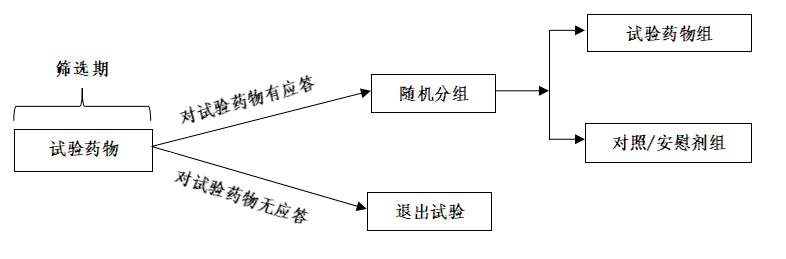
四、富集策略与设计的相关考虑 (一)标志物检测的灵敏度和特异度 (二)是否纳入标志物阳性和阴性的受试者 (三)入选人群和分析集 (四)筛选富集人群对优效和非劣效试验的不同影响 (五)控制I类错误 五、监管考虑 (一)明确界定富集人群 (二)不应忽视非富集人群的疗效 (三)预先确定研究方案并与监管机构沟通 六、参考文献 附录1:词汇表 附录2:中英文对照表 附录3:富集设计的研究案例 示例1:预后型富集——心血管病研究 示例2:预测型富集——黑色素瘤研究 示例3:随机撤药设计——普瑞巴林用于治疗纤维性肌痛症的研究 示例4:预测型富集——MSI研究 药物临床试验富集策略与设计指导原则 临床试验的目的是在入组的受试者中验证试验药物的有效性和安全性。但实际上,由于受试者病理生理学特点和药物作用机理的复杂性,不同受试者的药物治疗效果不尽相同,从而影响临床试验的效率。为了入组能够从试验药物中获益最大化的受试者,以提高临床试验的效率,富集策略的概念应运而生。 富集是指在临床试验中根据受试者的某些特征(如人口学、病理生理学、组织学、基因组和蛋白质组学等)前瞻性地精准定义从试验药物中获益最大化的目标人群。在临床试验有多种选择受试者的富集策略,例如,可以选择因具有一定特征而对研究药物最有可能应答的受试者,也可以选择那些对现有药物治疗效果不明显而可能对试验药物敏感的受试者,或者单纯选择更容易出现终点事件的受试者,等等。 本指导原则阐述了常用的富集策略与设计的原理与方法、各自的优缺点,并从实际应用和监管角度说明需要考虑的关键问题。本指导原则中,“富集策略”主要是指随机对照临床试验中用于选择最有可能获益的受试者的方法,但也可以扩展到使用外部(历史或平行)对照的单臂试验。 本指导原则主要适用于以支持药品注册上市为目的的确证性临床试验,也可供以非注册为目的的临床试验参考使用。 二、富集策略与设计的适用性 广义来讲,所有临床试验设计都在运用富集的概念,这主要反映在受试者的入选和排除标准上,其目的是尽可能入选对试验药物有应答的受试者,从而提高临床试验的效率。例如,研究降胆固醇药物降低心血管事件发生率时,临床试验只入组血液中总胆固醇浓度高于某一阈值的患者。实际上,根据疾病领域、药物作用机理以及受试者的应答情况等,可选择不同的富集策略和设计,其适用性主要从科学上的有效性、试验结果的可解释性和医疗实践中的可推广性等方面考虑。 1. 科学上的有效性:包括筛选受试者有科学依据,筛选工具的灵敏度和特异度符合一定要求,试验设计时使用避免偏倚的措施(如随机、盲法等),以及I类错误的控制等。 2. 试验结果的可解释性:指试验药物在富集人群中的疗效可以从疾病的病理生理学、基因组学、遗传学或者药物作用机理等方面进行解释;如果限于生物学、医学或者药理学等方面的知识而无法解释,则试验药物在富集人群中的疗效需要具有一定程度的重现性。 三、常用的富集策略与设计 根据临床试验关注的主要问题和实施过程,可以选择不同的富集策略,主要包括同质化富集、预后型富集、预测型富集、复合型(预后型和预测型相结合的)富集和适应性富集五种策略类型。 实际应用中,通常依据与药物作用机理相关的标志物选择富集策略与设计。这里的“标志物”定义为与受试者预后或药物治疗应答有关的流行病学因素(如人口学)、既往病史、家族史、临床观测变量(如疾病严重程度)、实验室检查(如病理生理学、药物代谢)、基因组学和蛋白质组学等各种特征变量。根据标志物的不同作用,可分为预后型、预测型和混合型标志物。另外,在有些疾病领域,可能没有明显的标志物,这时一般根据受试者在筛选期间对治疗的应答情况,或者其他临床试验的数据以及文献报道选择富集的受试者。 (一)同质化富集 同质化富集是指通过减少受试者间的异质性以提高临床试验的检验效能的一种研究策略。减少异质性最简单且实用的方法是尽量选择病情稳定的受试者,同时对入选受试者进行精准定义,并对疾病的状态和有关变量进行精确测量。例如,在高血压药物试验中,为了筛选出血压相对稳定的受试者,可以在入组前对受试者的血压进行一段时间的观察,以排除血压变化较大的受试者。 一般来说,为了更加准确地定义富集人群,除常规的入选和排除标准外,还要考虑以下几方面问题: (1)入选标准:更仔细地定义入选标准,以确保入选受试者间的基线特征具有较好的一致性。 (2)排除标准:①对安慰剂过于敏感的受试者;②基线检测结果不稳定的受试者,如在初筛期病情或症状不稳定的受试者;③伴随某种疾病可能导致过早死亡的受试者;④服用与试验药具有相似治疗作用的药物的受试者;⑤可能无法耐受试验药物治疗的受试者;⑥可能因并发症提前退出研究的受试者。 (4)培训:研究人员和临床试验协调员应接受相关培训,确保严格按照方案入选和排除受试者,并按照方案进行研究。 (二)预后型富集 1. 基于终点事件的富集设计 在以降低终点事件发生率为主要评价指标的研究中,一般认为有效的试验药物在高风险人群中能够减少或者避免发生更多的终点事件。因此,应考虑在高风险人群中招募受试者。通常,在样本量不变时,与低风险人群相比,高风险人群更容易发生终点事件,经治疗后终点事件发生率降幅较大,因此检验效能更高。这种策略经常用在抗肿瘤和治疗心血管疾病的药物研究中,例如在基因BRCA1/2突变的女性人群中进行乳腺癌或卵巢癌预防的研究;又如在降血脂药物的研究中,选择血液中高含量低密度脂蛋白(LDL)、低含量高密度脂蛋白(HDL)和高含量C反应蛋白(CRP)的患者试验。在有些疾病领域,如阿尔兹海默症和各种癌症药物研究中,也可以通过基因组或蛋白质组学筛选高风险的患者。 2. 基于疾病进展的富集设计 预后型富集设计也可用于研究能够减缓疾病进展的试验药物,如在对阿尔茨海默症、帕金森病、类风湿性关节炎、慢性阻塞性肺疾病和恶性肿瘤等疾病开展药物临床试验时,可以选择疾病进展可能较快的受试者。例如,在类风湿性关节炎的患者中,具有以下特征的患者疾病往往进展较快:类风湿因子阳性、具有某些临床特征(如多关节受影响、关节以外的病症、皮下结节、活动受限等)以及实验室指标异常(如血红蛋白降低)等;又如在慢性阻塞性肺疾病(COPD)的患者中,具有近期发作史(过去一年中至少发作一次)或血浆纤维蛋白原较高的患者疾病进展较快。在抗肿瘤药物研究中,常见的预后标志物包括组织学分级、血管浸润、分子亚型以及转移性肿瘤结节等指标。 需要注意的是,如果预后型标志物与试验药物之间存在交互作用,即试验药物对该标志物阳性和阴性患者都有效果,但疗效不同,则该预后型标志物也可以起到预测的作用,此类标志物通常称为混合型标志物。 (三)预测型富集 预测型富集是指根据受试者的生理或疾病特征选择对试验药物最可能有应答的受试者,以提高试验效率的一种研究策略。例如在靶向治疗中,可根据药物相关的靶向基因或蛋白,或生理机能(如肾素型高血压/低血压、慢性心力衰竭时的射血分数),选择可能有应答的受试者。采用这一策略既能增加试验药物的绝对效应,也能增加其相对效应,因此能够以较小的样本量获得较高的检验效能。当患有某种疾病的受试者中只有一小部分对试验药物有应答时(如只有部分受试者具有药物作用的受体),使用这种富集策略十分有效。在实践中,既可以基于研究者对疾病的认识(如各种标志物)选择受试者,也可以根据以往的试验数据和结果。 1. 基于病理生理学特征的富集设计 疾病的病理生理学特征可以提示对试验药物有更好应答的受试者。基于病理生理学的富集指标可以是生物标志物(如影响肿瘤生长的基因突变、基因/蛋白表达水平)、影像学特征,以及与疾病表型相关的一些人口学(如年龄、种族等)或临床特征(如疾病分期、分型等)。根据富集标志物的性质,可将其分为以下几类: (1)基因或蛋白标志物 治疗肿瘤的药物通常针对肿瘤细胞表面或细胞内相关的受体、酶、激素或其他内源活性物质,对此可根据一个或多个相应的基因或蛋白标志物选择富集人群。例如曲妥珠单抗主要针对人表皮生长因子受体2(HER-2)蛋白阳性的乳腺癌患者;也有一些细胞受体最初作为蛋白标志物,但后来被确认为肿瘤基因标志物(如EGFR和BRAF基因突变),并用该基因标志物定义病理生理状态、选择最有可能获益的受试者。 当在富集设计中使用基因或蛋白标志物时,标志物检测的准确性和精确性至关重要。如果诊断检测不准确,不仅会影响富集的效果导致检验效能降低,而且在非劣效试验中可能会增加I类错误。同时,还要尽可能地考虑标志物与疗效之间的关系,从而有助于选择合适的受试者。 (2)药物代谢物 不同受试者对试验药物的代谢能力不同,入组能够产生足够数量活性代谢物的受试者,可以提高临床试验的效率。在某些情况下,给予产生活性物质能力较弱的患者更高的剂量,有助于他们产生足够的活性物质,从而更可能观察到药物的疗效。然而,对于完全不能代谢出有效活性成分的患者,也应该纳入试验或事先设定的分析计划中,目的是对指定的代谢物进行验证和获益-风险分析。 (3)肿瘤代谢物 抗肿瘤药物试验可以通过检测组织或血液中的肿瘤代谢物含量选择受试者。例如,只入选那些代谢反应较强的受试者,或者在肿瘤患者中按代谢反应程度进行分组,并对代谢反应较强的受试者进行主要分析。 2. 基于对试验药物应答证据的富集设计 此类富集设计根据受试者在筛选期内对试验药物(或既往对类似药物)的应答情况,选择可能合适的受试者。 (1)筛选有应答的受试者 选择有应答的受试者还可以使用随机撤药设计。该设计一般分为两个阶段,即第一阶段测试受试者是否对试验药物有应答(可以使用单臂开放试验或随机对照试验),第二阶段对试验药物有应答的受试者,随机分到试验组(继续使用试验药物)或安慰剂组(将试验药物撤出),无应答的受试者退出试验(图1)。判断患者对试验药物是否有应答,可以根据某些替代指标如症状、体征、实验室检查和疾病复发等进行评估。
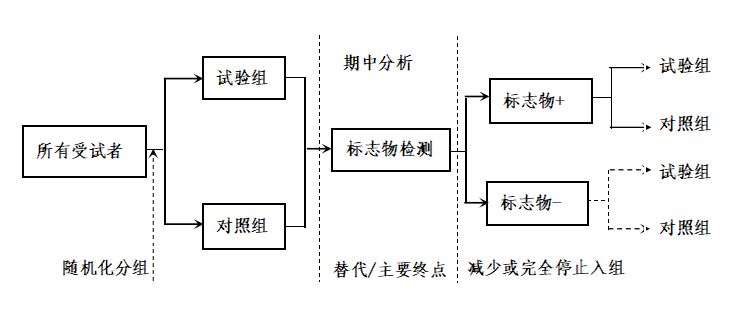
图1 随机撤药研究流程图 随机撤药设计由于筛选了对试验药物有应答的受试者,从而提高了临床试验的效率;同时,可利用已经入组的受试者研究药物的长期疗效或安全性,以及利用退出试验的受试者研究撤药效应。另一方面,这种设计更符合伦理学要求,即一旦治疗失败可及时终止试验,可用于儿童药物研究。该设计的主要缺点是可能具有残留效应以及研究时间相对较长。 (2)基于历史数据或文献报道确定入选受试者 根据既往研究中确定的亚组特征入选受试者,即在总体人群中很少或几乎没有观察到明显的治疗效果,但通过分析特定的亚组人群可能获得显著疗效,最后仅在亚组人群中招募受试者。例如,复方硝酸异山梨酯/盐酸肼屈嗪是一种治疗严重心力衰竭的药物,之前的研究发现其对非裔美国人的治疗效果明显优于高加索人,在后续设计的随机安慰剂对照试验中,入选了1050名心力衰竭的非裔美国人患者,由此验证了该复方在该心力衰竭患者中的有效性。 3. 基于对现有药物无应答的富集设计 在富集设计中,除上述选择对试验药物有应答的受试者外,还可以考虑选择对现有药物无应答的受试者,目的是更好地显现出试验药物的治疗效果。 无应答的富集设计适用于满足一定条件的临床试验,即试验药物与现有药物具有不同的作用机制,或试验药物的疗效至少略优于现有药物。如果对受试者未加选择,则需要较大的样本量才能显示出试验药物的疗效;相反,如果只选择对现有药物无应答的受试者,由于对照组的应答率很低,则可能只需要较小的样本量,就能得出试验组优于对照组的结论。必须指出的是,对于某些可能危及生命、并不断进展的疾病来说,采用无应答的富集设计会将受试者随机分配到无应答的对照组,可能存在伦理问题。 (四)复合型富集 复合型富集指同时使用多个标志物(如预后型和预测型标志物)以减少受试者异质性的富集策略。对有些疾病领域,疾病的发生、发展和预后机制复杂、个体异质性高,使用单一标志物不大可能富集最有可能获益的受试者,而使用复合标志物(例如综合评分)进行富集可以有效地降低受试者的异质性,从而提高试验效率。 需要注意的是,使用复合标志物评分时应列出其构成的单个标志物并阐明它们之间的关系;如果对不同的单个标志物赋予不同的权重,应详细说明其生物学上的原理。 (五)适应性富集 适应性富集策略是指按照预先制定的计划,根据临床试验期中分析结果,在保证试验的合理性和完整性的前提下,对临床试验方案进行修改,如改变入组标准或仅纳入一个亚组的受试者,并对样本量进行调整等。 当试验药物在标志物阳性和阴性的受试者中的疗效不确定时,试验可以同时入组标志物阳性和阴性的受试者,根据期中分析结果适应性地调整需要入选的受试者。当主要终点规定为标志物阳性受试者的疗效时,如果期中分析结果显示标志物阴性受试者的疗效远低于标志物阳性受试者,则应减少或完全停止标志物阴性的受试者入组(图2)。假定标志物阳性受试者的疗效高于标志物阴性受试者的疗效,也可以考虑首先入组标志物阳性的受试者,如果期中分析结果表明试验药物在该标志物阳性的受试者中有疗效,则考虑入组标志物阴性的受试者;否则,终止试验。
图2 适应性富集设计流程图 一般来说,如果标志物与疗效的关系越不确定,越需要包含标志物阴性的受试者,此时可以评估药物在全人群中使用时的获益与风险。当不确定一个标志物的预测性时,主要终点可以是全人群中的疗效;如果标志物阳性人群和全人群的疗效同时作为主要分析时,需要按照一定的规则将检验水准α进行分配。无论何种情况,都应事先在方案中明确规定检验假设,并需要对I类错误进行控制。 四、富集策略与设计的相关考虑 (一)标志物检测的灵敏度和特异度 当采用筛检试验选择受试者时,必须考虑检测方法的可靠性,以便能更准确地选择高风险或者对试验药物有应答的受试者。理想情况下,用于筛选受试者的检测方法,应该对选择高风险或对试验药物有应答的受试者有较高的灵敏度,同时对鉴别低风险或对试验药物无应答的受试者有较高的特异度。 当利用生物标志物筛选入组受试者时,如果不能准确给出预测标志物的阈值,可以通过受试者诊断特征(ROC)分析,即对标志物不同阈值点的灵敏度和特异度进行分析,并用ROC曲线下面积衡量其筛检效果。关于预测标志物阈值的确定,一般可以先在早期研究阶段给出一个初步的阈值,然后通过较大样本的试验对其进行调整,获得更可靠的阈值。 (二)是否纳入标志物阳性和阴性的受试者 富集设计既可以只纳入标志物阳性的受试者,也可以同时纳入阳性和阴性的受试者。然而,富集设计的关键问题是纳入标志物阴性受试者的比例。一般来说,可以考虑如下的富集设计: 1. 只纳入生物标志物阳性的受试者 如果作用机制或已有数据表明,试验药物在标志物阳性的受试者中有明显的疗效,而在标志物阴性的受试者中疗效较小或者完全没有疗效,尤其在试验药物有较大毒性的情况下,不应纳入标志物阴性的受试者。 2. 同时纳入生物标志物阳性和阴性的受试者 如果作用机制或已有数据表明,标志物阳性的受试者较阴性受试者的疗效更好,则在试验药物毒性相对较小的情况下,应同时纳入标志物阳性和阴性的受试者。这种策略的优点是,能在非富集人群中提供合理的获益-风险估计。 如果在试验开始之前就能够明确标志物,则可以通过对其分组实施分层随机化,主要分析可限制在生物标志物阳性的受试者中。实际中,也可以在全人群中进行主要分析,或者在全人群和标志物阳性受试者中同时进行主要分析,并适当地控制Ⅰ类错误。 一般来说,如果标志物的阈值或标志物阴性的受试者应答程度不确定,则有必要纳入标志物阴性的受试者。 (三)入选人群和分析集 (四)筛选富集人群对优效和非劣效试验的不同影响 使用标志物选择受试者时,对优效和非劣效试验有着不同的影响。对于优效试验,当采用富集策略时,如果筛检方法的灵敏度不高,则需要招募更多的受试者从中进行筛选,才能获得规定的富集样本量;如果特异度不高,则需要增加富集样本量或延长试验时间才能获得足够的终点事件数。尽管如此,但不会增加优效试验的I类错误。 然而,对于非劣效试验,筛检的准确度不仅会影响研究所需的样本量或持续时间,还可能增加I类错误。例如,采用预后型富集策略进行非劣效试验,如果阳性对照的筛选方法与以往研究不同,则可能导致阳性对照组的疗效低于以往研究的疗效,从而增加I类错误。另外,对于基于预测型富集策略的非劣效试验,对I类错误的影响更为复杂,它取决于标志物是与试验药物和阳性对照药物的治疗相关,还是仅与其中一种治疗相关。因此,非劣效试验中选择受试者的检测方法最好与阳性对照以往研究的筛检方法一致,或者两种筛检方法有相似的灵敏度和特异度。 (五)控制I类错误 对于同时入选富集人群和非富集人群的富集设计,可根据筛检方法的准确度和受试者对治疗的应答情况,选择不同的假设检验策略。如果有多个假设检验,如在标志物阳性人群和总体人群中分别进行假设检验,则需要考虑多重性调整的问题;如果仅有一个假设检验,如在标志物阳性人群中进行假设检验,则无需考虑这一问题。在不同假设下I类错误α的分配,可以根据标志物阳性人群对药物的应答程度、阳性人群在总体人群中的比例以及按照预先设定的检验效能所需要的样本量进行设置。对总体人群和富集人群进行假设检验时,可以采取独立或者序贯策略进行假设检验。 五、监管考虑 (一)明确界定富集人群 临床试验是否使用、何时使用以及使用何种富集策略,主要取决于能否准确界定富集人群,这显然会对产品说明书的撰写和后续的医疗实践产生影响。如果使用富集策略和设计无法准确界定富集人群,则可能导致在说明书中无法准确地定义对治疗有效的患者人群,进而无法准确指导临床合理用药。 (二)不应忽视非富集人群的疗效 试验药物在富集人群中的有效性和安全性得到确证后,其在非富集人群中相应的信息也应受到重视。通过在非富集人群中开展进一步研究,可以更全面地描述药物的获益-风险状况,为药物能够在更广泛的患者人群中使用提供依据。 对基于高风险人群预后型富集分析获批上市的药物,在随后的低风险人群中试验,可能会使用不同的结局指标,如在高风险人群中使用病死率,而在低风险人群中可以使用一个复合结局指标,有助于提高试验效率。 (三)预先确定研究方案并与监管机构沟通 一般来说,在研究开始之前,应预先计划并确定受试者的选择方案。如果已知可用于富集的特征变量或标志物,可在筛选受试者时对其进行测量。而当特征变量或标志物在研究人群中富集的效果或分布不确定时,可以考虑进行适应性富集,即在试验过程中依据积累的数据,对试验设计的要素进行调整。无论采用何种策略和设计,调整方法和过程应在研究方案中事先说明,确保其合理性和正确性,并与监管机构进行充分的沟通。 六、参考文献 [1] FDA. Enrichment Strategies for Clinical Trials to Support Determination of Effectiveness of Human Drugs and Biological Products: Guidance for Industry. The US Food and Drug Administration: Silver Spring, 2019. [2] EMA. Points to consider on multiplicity issues in clinical trials. European Medicines Agency: EMA, 2002. [3] EMA. Guideline on the investigation of subgroups in confirmatory clinical trials. European Medicines Agency: EMA, 2019. [4] ICH. ICH E5. Ethnic Factors in the Acceptability of foreign Clinical Data E5 (R1). ICH Harmonised Tripartite: ICH, 1998. [5] ICH. ICH E5. Implementation Working Group Questions & Answers (R1). ICH Harmonised Tripartite: ICH, 2006. [6] Wang S, Hung HMJ, O Neill RT. Genomic Classifier for Patient Enrichment: Misclassification and Type I Error Issues in Pharmacogenomics Noninferiority Trial. Stat Biopharm Res, 2011, 3: 310-319. [7] Temple RJ. Special study designs: early escape, enrichment, studies in non-responders. Communications in Statistics - Theory and Methods, 1994, 23: 499-531. [8] Taylor AL, Ziesche S, Yancy C, et al. Combination of isosorbide dinitrate and hydralazine in blacks with heart failure. N Engl J Med, 2004, 351: 2049-2057. [9] Temple R, Stockbridge NL. BiDil for heart failure in black patients: The U.S. Food and Drug Administration. Ann Intern Med, 2007, 146: 57-62. [10] Institute OM. Small Clinical Trials: Issues and Challenges. Washington, DC. The National Academies Press; 2001. [11] D'Agostino RB. The Delayed-Start Study Design. New Engl J Med, 2009, 361: 1304-1306. [12] Priscilla Velengtas, Penny Mohr, Messner DA. Making informed decisions: Assessing the strengths and weaknesses of study designs and analytic methods for comparative effectiveness research. National Pharmaceutical Council ed. Washington, DC; 2012. [13] Freidlin B, Korn EL. Biomarker enrichment strategies: matching trial design to biomarker credentials. Nat Rev Clin Oncol, 2014, 11: 81-90. [14] Wang SJ, Hung HM, O'Neill RT. Adaptive patient enrichment designs in therapeutic trials. Biom J, 2009, 51: 358-374. [15] Temple R. Enrichment of clinical study populations. Clin Pharmacol Ther, 2010, 88: 774-778. [16] Simon R. Clinical trial designs for evaluating the medical utility of prognostic and predictive biomarkers in oncology. Pers Med, 2010, 7: 33-47. [17] Wang SJ, O'Neill RT, Hung HM. Approaches to evaluation of treatment effect in randomized clinical trials with genomic subset. Pharm Stat, 2007, 6: 227-244. [18] Liu A, Liu C, Li Q, et al. A threshold sample-enrichment approach in a clinical trial with heterogeneous subpopulations. Clinical trials (London, England), 2010, 7: 537-545. [19] Jiang W, Freidlin B, Simon R. Biomarker-adaptive threshold design: a procedure for evaluating treatment with possible biomarker-defined subset effect. J Natl Cancer Inst, 2007, 99: 1036-1043. [20] D'Amico AV, Chen MH, Roehl KA, et al. Preoperative PSA velocity and the risk of death from prostate cancer after radical prostatectomy. N Engl J Med, 2004, 351: 125-135. [21] Fan C, Oh DS, Wessels L, et al. Concordance among Gene-Expression–Based Predictors for Breast Cancer. New Engl J Med, 2006, 355: 560-569. [22] Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: The Scandinavian Simvastatin Survival Study (4S). Lancet, 1994, 344: 1383-1389. [25] EMA. Qualification opinion of low hippocampal volume (atrophy) by MRI for use in regulatory clinical trials - in pre-dementia stage of Alzheimer’s disease. European Medicines Agency: EMA, 2011. [26] Amur S, LaVange L, Zineh I, et al. Biomarker Qualification: Toward a Multiple Stakeholder Framework for Biomarker Development, Regulatory Acceptance, and Utilization. Clin Pharmacol Ther, 2015, 98: 34-46. [27] FDA. Qualification of Biomarker–Plasma Fibrinogen in Studies Examining Exacerbations and/or All-Cause Mortality in Patients with Chronic Obstructive Pulmonary Disease. US Food and Drug Administration: Silver Spring, 2016. [28] FDA. Qualification of Biomarker–Total Kidney Volume in Studies for Treatment of Autosomal Dominant Polycystic Kidney Disease. US Food and Drug Administration: Silver Spring, 2016. [29] Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet, 2005, 365: 1687-1717. [30] Loo E, Khalili P, Beuhler K, et al. BRAF V600E Mutation Across Multiple Tumor Types: Correlation Between DNA-based Sequencing and Mutation-specific Immunohistochemistry. Appl Immunohistochem Mol Morphol, 2018, 26: 709-713. [32] Kowanetz M, Zou W, Gettinger SN, et al. Differential regulation of PD-L1 expression by immune and tumor cells in NSCLC and the response to treatment with atezolizumab (anti-PD-L1). Proc Natl Acad Sci USA, 2018, 115: E10119-E10126. [33] Havel JJ, Chowell D, Chan TA. The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nat Rev Cancer, 2019, 19: 133-150. [34] Schrock AB, Ouyang C, Sandhu J, et al. Tumor mutational burden is predictive of response to immune checkpoint inhibitors in MSI-high metastatic colorectal cancer. Ann Oncol 2019, 30: 1096-1103. [35] Hughes RA, Donofrio P, Bril V, et al. Intravenous immune globulin (10% caprylate-chromatography purified) for the treatment of chronic inflammatory demyelinating polyradiculoneuropathy (ICE study): a randomised placebo-controlled trial. Lancet Neurol, 2008, 7: 136-144. [36] Parkinson Study Group. A controlled, randomized, delayed-start study of rasagiline in early Parkinson disease. Arch Neurol, 2004, 61: 561-566. [37] Singh BN. Comparative efficacy and safety of bepridil and diltiazem in chronic stable angina pectoris refractory to diltiazem. The Bepridil Collaborative Study Group. Am J Cardiol, 1991, 68: 306-312. [38] Barker AD, Sigman CC, Kelloff GJ, et al. I-SPY 2: an adaptive breast cancer trial design in the setting of neoadjuvant chemotherapy. Clin Pharmacol Ther, 2009, 86: 97-100. 附录1: 词汇表 适应性富集设计(Adaptive Enrichment Design):按照预先制定的计划,根据临床试验数据的期中分析结果,在保证试验合理性和完整性的前提下,允许在试验过程中适应性地更新入排标准,选择最有可能从治疗中获益的受试者入组的自适应设计。 随机撤药设计(Randomized Withdrawal Design):在此类设计中,所有受试者都在最初的开放标签期间接受试验药物的治疗,之后对药物无应答的受试者退出试验,有应答的受试者(富集亚群)在试验第二阶段中随机接受试验药物或安慰剂。 异质性(Heterogeneity):在临床试验中,异质性体现在个体和群体两个水平,前者通常是指受试者间具有不同的特征,个体性质或状态的不同可能会导致不同的受试者对治疗有不同的应答;后者通常是指不同中心、种族、地域等受试者具有不同的特征,有可能导致不同受试者对治疗有不同的应答。 预测型富集(Predictive Enrichment):是指选择性地纳入可能会对治疗有应答的受试者的一种研究策略或设计,这些受试者具有共同的有预测意义的生物学和组织病理学特征,可以更敏感地显示试验药物的。 预后型富集(Prognostic Enrichment):是指选择性地纳入更可能发生终点事件(如死亡或疾病恶化)的受试者,从而降低为达到统计学显著疗效所需样本量的一种研究策略或设计。 附录2: 中英文对照表 中文 英文 靶向治疗 Target Therapy 病理生理学 Pathophysiology 蛋白质组学 Proteomics 单臂试验 Single-arm Trial 低风险人群 Low-risk Population 多重性 Multiplicity 非富集人群 Non-enriched Population 非劣效性试验 Non-inferiority Trial 分析集 Analysis Set 复合结局指标 Composite Endpoint 富集策略 Enrichment Strategies 富集人群 Enriched Population 高风险人群 High-risk Population 复合型富集策略 Mixed Enrichment Strategies 获益-风险比 Benefit-risk Ratio 基因组学 Genomics 基因突变 Gene Mutation 假设检验 Hypothesis Test 可推广性 Generalizability 灵敏度 Sensitivity 目标人群 Target Population 偏倚 Bias 确证性临床试验 Confirmatory Clinical Trial 筛检试验 Screening Test 生物标志物 Biomarkers 生物标志物阳性 Biomarkers Positive 生物标志物阴性 Biomarkers Negative 适应性富集策略 Adaptive Enrichment Strategies 受试者诊断特征 Receiver Operating Characteristic (ROC) 随机撤药 Randomized Withdrawal 特异度 Specificity 替代指标 Surrogate Marker 同质化富集策略 Reducing Heterogeneity Strategies 外部对照 External Control 亚组分析 Subgroup Analysis 亚组人群 Subpopulation I类错误 Type I Error 依从性 Compliance 优效性试验 Superiority Trial 预测型富集策略 Predictive Enrichment Strategies 预后型富集策略 Prognostic Enrichment Strategies 终点事件 Endpoint 肿瘤代谢物 Tumor Metabolite 主要疗效分析 Primary Efficacy Analysis 附录3: 富集设计的研究案例 示例1:预后型富集——心血管病研究 在心血管病研究中,选择高风险人群(如AMI、中风、极高的胆固醇水平、非常严重的CHF及接受血管成形术等)进行临床研究,能够获得更多的结局事件。斯堪的纳维亚辛伐他汀生存研究(4S)是一项降脂药物的试验,主要目的是评估辛伐他汀能否通过降低血清胆固醇改善冠心病患者的生存率。该研究为随机双盲安慰剂对照的多中心临床试验,招募了4444名患有心绞痛或先前有心肌梗死(MI)的患者,这些受试者都具有较高的总胆固醇(TC)水平。在平均5.4年的随访期内,辛伐他汀相对于安慰剂的心血管病死亡率能够得到显著降低(相对危险度RR为0.70,95% CI:0.58-0.85)。 示例2:预测型富集——黑色素瘤研究 BRAF激酶抑制剂是一种治疗黑色素瘤的靶向药物,BRAF基因第15外显子(V600E)可以作为预测型生物标志物。已知BRAF基因编码细胞质丝氨酸/苏氨酸激酶,该酶调节丝裂原活化蛋白激酶信号转导通路,控制包括细胞生长和分裂(增殖)在内的几个重要细胞功能。现已发现,BRAF V600E在多种肿瘤中发生突变,如黑色素瘤、大肠癌、甲状腺乳头状癌、毛细胞白血病(Hairy Cell Leukemia)和朗格汉斯细胞增生症等。一项黑色素瘤III期临床试验研究,入选了675例转移性或不可切除、BRAFV600E突变的受试者,分别给予BRAF激酶抑制剂维罗非尼或化疗药物达卡巴嗪,结果发现:给予维罗非尼靶向药治疗的受试者其应答率为48%,而使用达卡巴嗪化疗的受试者其应答率仅为5%;两者相比较,经维罗非尼治疗的受试者相对死亡风险降低了63%。 示例3:随机撤药设计——普瑞巴林用于治疗纤维性肌痛症的研究 一项研究普瑞巴林(Pregabalin)对治疗纤维性肌痛症受试者的疗效的临床试验使用了两阶段随机撤药设计,其目的是比较普瑞巴林相对于安慰剂在接受治疗到疗效丧失的时间上的差异(Time to Loss of Therapeutic Response,TLTR)。第一阶段是开放性试验,患有纤维性肌痛症受试者全部接受普瑞巴林治疗,并观察6周。其中,在1-3周,受试者接受递增剂量的普瑞巴林以决定其最佳剂量;在4-6周,受试者维持在此最佳剂量。第一阶段开放性治疗结束后,受试者必须具有至少50%以上的疼痛减轻、且在PGIC量表上的自我评价至少是“显著改善”才能进入第二阶段的双盲、安慰剂对照的试验。在入组的1051名受试者中,经第一阶段的治疗,符合以上条件进入第二阶段的有566人,其中287人被随机分配到安慰剂组、279人被分配到普瑞巴林组。经过第二阶段26周的治疗,两组间在治疗应答丧失时间(Time to Loss of Therapeutic Response,LTR)上有显著差异(p < 0.0001)。试验结束时,安慰剂组有61%(178)、普瑞巴林组有32%(90)达到了LTR。 示例4:预测型富集——MSI研究 微卫星不稳定性(MSI)是对免疫检查点抑制剂产生应答的生物标志物。PD-1/PD-L1通路是调节T细胞活化的信号通路,在肿瘤发生和进展中起重要作用。实际中,通常用免疫组化方法检测PD-L1蛋白的表达水平,将其作为预测标志物并选择高表达的受试者,但其对PD-1/PD-L1抑制剂的应答率仅为10-20%。然而,在高度微卫星不稳定型(MSI-HIGH)的肿瘤受试者中的应答率却能达到50%。基于此,FDA批准帕博利珠单抗适用于MSI-HIGH型或存在错配修复缺陷的结直肠癌和子宫内膜癌受试者的治疗。 附件2 : 《药物临床试验富集策略与设计指导原则(征求意见稿)》起草说明 为更精准的定义药物临床试验的目标人群,提高药物临床试验的研发效率,药品审评中心组织起草了《药物临床试验富集策略与设计指导原则(征求意见稿)》。现将有关情况说明如下: 临床试验的目的是在特定的目标人群中证明研究药物的有效性和安全性。如何选择对试验药物有应答或者敏感的人群,以更容易的证明药物的潜在作用是开展临床试验首先要考虑的问题。对于某些疾病,往往具有某种特征的人群从治疗中的获益较大,而其他人群则获益较小甚至不获益,对此可以使用富集策略。 在临床试验中,可以根据疾病领域、药物作用机理以及患者的应答情况等,前瞻性地利用患者的某些特征(如人口学、病理生理学、组织学、基因组学等特征)来确定临床试验的目标人群,从而使试验药物在该人群中获益-风险达到最大化。 本指导原则旨在明确药物临床试验富集策略的主要类型和设计方法,以期为工业界采用富集策略支持药物研发和注册上市提供科学可行的指导意见。 本指导原则自2019年11月正式启动,分别于2020年5-7月召开了三次线上专家研讨会,对指导原则初稿进行了充分的讨论和交流,并经药审中心内部征求意见与审核,形成征求意见稿。起草过程中参考了国际其他监管机构如美国FDA、欧盟EMA等制定的相关指南。 三、主要内容与说明 本指导原则从富集策略的定义、主要类型、适用范围、主要设计类型、结果解释等方面说明富集设计需要考虑的关键问题。对如何使用富集策略更精准的选择目标人群给出指导性建议。全文主要包括概述、富集策略与设计的适用性、常用的富集策略与设计、富集策略与设计的相关考虑、监管考虑以及附录等内容。 (一)概述 主要阐述了本指导原则制定的背景、目的和应用范围。 (二)富集策略与设计的适用性 主要阐述了根据疾病领域、药物作用机理以及患者的应答情况等,可选择不同的富集策略和设计。在对富集策略进行评价时,应从科学上的有效性、试验结果的可解释性和医疗实践中的可推广性等方面进行考虑。 (三)常用的富集策略与设计 阐述了几种的富集策略与设计的原理和方法、各自的优缺点、统计分析以及对结果的解释。主要包括同质化富集、预后型富集、预测型富集、复合型富集和适应性富集。根据临床试验所关注的主要问题,通过不同的富集策略和设计方法,选择对试验药物有应答或者敏感的亚组人群,以提高试验的效率。 (四)富集策略与设计的相关考虑 采用富集策略进行设计和统计分析时应当注意一些问题。本指导原则对筛检试验标志物检测方法的灵敏度和特异度、阳性人群和阴性人群的纳入的问题、入选人群和分析集、筛选富集人群对优效和非劣效试验的不同影响以及I类错误控制等问题进行了阐述。 (五)监管考虑 临床试验能否使用以及使用何种富集策略,取决于能否明确界定富集的患者人群,同时不应忽视非富集人群的疗效,以更全面地描述药物的获益-风险状况,使药物能够应用在更广泛的患者人群中。通常,在研究开始之前,申办方应预先确定富集策略和研究设计并与监管机构沟通。 (六)附录 附录部分提供了参考文献、词汇表、中英文词汇对照、富集设计的研究案例。附录 参与制订《药物临床试验富集策略与设计指导原则 (征求意见稿)》的专家名单 主要执笔人:陈杰、李康、李新旭、辛晓娜 外部专家:殷悦 三方学术协调委员会:陈平雁、王骏、狄佳宁 (其余按姓氏笔划顺序): 王秋珍、王勇、尹平、田正隆、孙凤宇、闫波、李康、李若冰、 李新旭、何崑、陈刚、陈杰、陈峰、辛晓娜、欧春泉、赵耐青、 贺佳、郭翔、唐智敏、曾新、谭铭 秘书:吴莹、段重阳返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |