单抗III期临床试验失败案例及原因分析 |
您所在的位置:网站首页 › 临床研究trae › 单抗III期临床试验失败案例及原因分析 |
单抗III期临床试验失败案例及原因分析
|
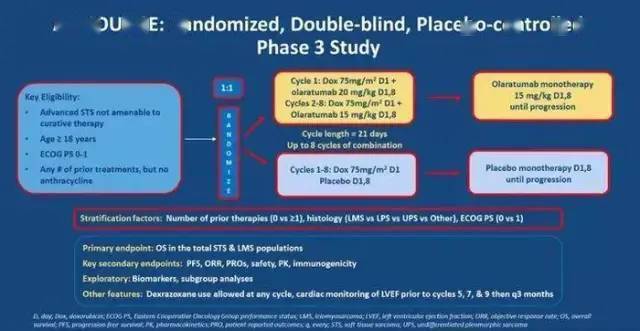
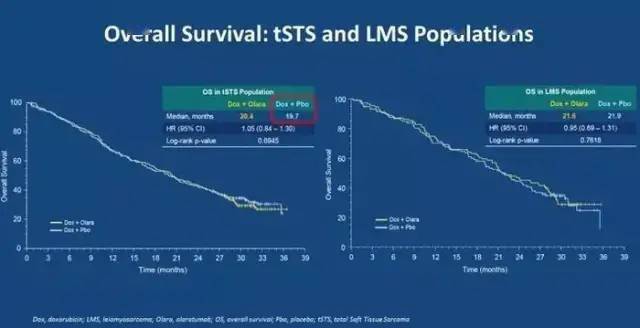
但是,II期临床研究的结果却未能在III期重现。2019年1月III期研究结果公布,研究设计及结果见下图,Olaratumab在软组织肉瘤中OS为20.4个月,而多柔比星为19.7个月。PFS 为5.4个月,多柔比星为6.8个月;ORR为14%, 多柔比星为18.3%。与II期结果不一样,它未能证实OS,PFS延长,也未能证实ORR更高。 基于此结果,礼来在全球范围内撤市该药。
失败的原因何在?分析如下:1)II期和III期研究设计和实施上存在差别。II期为开放设计,无安慰剂对照;而III期为双盲安慰剂对照;首要终点前者为PFS,后者为OS;前者无预设的亚组分析,而后者了STS和LMS的结局;前者为美国10个中心的研究,后者为110个中心的国际研究;前者无负荷剂量,后者的负荷剂量为20mg/m2等。2)软组织瘤是高度异质性的疾病,各种病理类型在发生部位,比如平滑肌纤维,脂肪组织,筋膜,淋巴和血管等多种组织,有的比较惰性的,而有的反应性比较高,转化细胞类型和组织病理学特征等方面具有鲜明的异质性。II期和III期入组的患者在病理亚型上存在区别。选择的亚型过多,有的有10多例,有的只有1到2例,这也是导致疗效不同的原因;3)Olaratumab联合协同作用机制不清晰,它与多柔比星联合,也许对于某些亚型有作用,但是对于其他亚型也许没有作用;4)多柔比星为基础的化疗药物,或者说作为对照,它的作用也可能有提高 5)作用机制和生物标记物尚未得到验证。真实世界的数据也显示疗效并不理想。以有限的数据以获得优先审评,是存在风险的。这就是它撤市的原因。
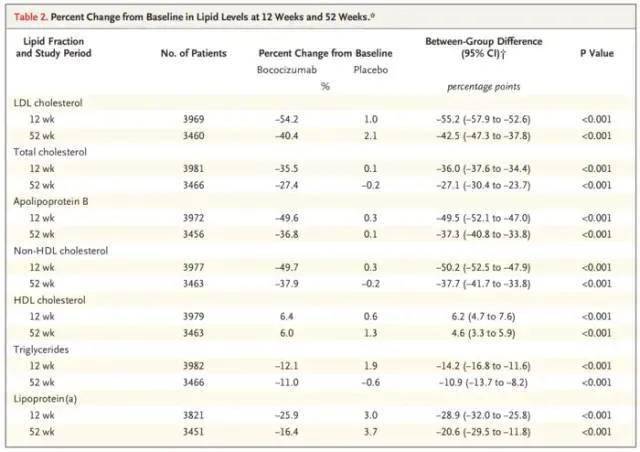
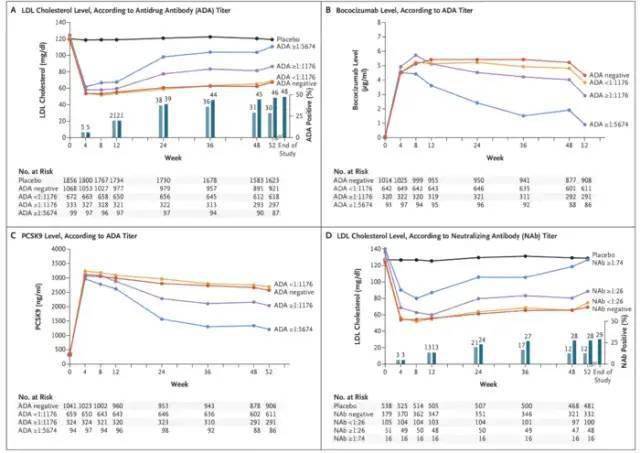
市场方面,安进和Regeneron已有的两个新上市的PCSK-9单抗,作为第三个上市的同类药物Bococizumab必须有明显优势才有市场前景,但是,除免疫原性,它每两周给药1次也不具优势,竞品是每月给药1次。作为后来者,几乎没有任何优势而言,终止是最优选择。不过,这个终止来得过迟,6项III期床(包括CVOT研究),一共入组了大约27000人,耗时耗力耗钱。问题是为何到多个III期都结束后才发现抗体的问题?是否忽视了它的严重性?为何不能早发现,早终止? 研究临床试验失败有很多原因,包括难以避免的,以及通过严格的科学把控可以避免的失败。1. 由于缺乏足够的科学进展或证据而导致的失败是难以避免的,其中包括:1)缺乏可预测的临床前体内和体外有关安全性的转化医学模型,特别是在肝脏毒性和神经毒性方面。2)缺乏可预测的临床前体内和体外有效性模型,特别是在神经科学和肿瘤(实体瘤)方面。3)对于疾病复杂的病因没有充分的了解。举个例子,阿尔茨海默病,beta-淀粉样斑块以及Tau蛋白被认为与阿尔茨海默病相关。尽管Bapineuzumab等的III期临床研究显示可以降低beta-淀粉样斑块,但是未能改善临床结局。因此,beta-淀粉样斑块增加和神经纤维缠结可能不是认知功能下降的原因,而只是与其相关。再比如心血管疾病的研究药物胆固醇酯转运蛋白抑制剂(CETP)在临床II期和III期研究中发现其可以增加HDL,但是未能改善心血管结局,因此,HDL降低并不是高脂血症的主要原因。这些被认为与疾病相关的生物标志物,都未能预测临床结局。2. 通过严格的,原则性的科学层面把控,是可以避免的失败。这包括:1)III期临床的候选药物的剂量以及受试者选择不佳。由II期临床中受试者剂量暴露与临床反应的关系没有充分建立,在III期临床中由于剂量不足或过高而导致失败;由于III期临床的患者群选择不当,只有部分受试者有效,从而稀释了药物的有效性,如Olaratumab;缺乏为III期临床研究选择正确人群以及研究设计的基于模型的荟萃分析和临床试验模拟;2)由于在II期临床研究过程中对照组的样本量不足,导致假阳性结果,因此在III期研究中结果没能复制。这包括,II期临床研究的样本量较小,特别是在研究终点较为主观的,安慰剂的作用较大的疾病,比如抑郁, 系统性红斑狼疮(SLE)以及风湿性关节炎(RA);3)在II期临床研究中过度的依赖未验证的替代终点或生物标志物终点,从而无法预测III期研究的结局。4)对异常的有效性和安全性数据分析不充分。比如辉瑞的PCSK9单抗,尽管Fab段的CDR区与PCSK-9结合的部位有3%的序列是鼠源,但对I期和II期的抗体生成的信号没有充分的分析,迅速并机会同时开展了六个III期。产品本身有缺陷,即使有强大的销售能力,也无法使产品在临床中得到认可。肝脏毒性是后期临床研究失败的重要原因。目前的方法是检测ALT,AST和胆红素水平。但是这些肝酶水平的增加不足以预示肝脏毒性。如TAK-875-GPR-40激动剂,在303例的II期临床研究中,只有1例受试者出现肝酶异常,但是III期临床研究对肝脏毒性使用Hy’s法则来评估,发现了严重的肝脏毒性,从而导致开发终止。 减少III期临床试验的风险,有时候是可能的,但有时候是无法避免的。我们可以做的是减少或最小化那些可以避免的错误。需深入的了解研究资料,靶点,临床前数据,早期数据和安全性等。合理的开展I期和II期临床研究,客观的分析所获得的数据,SMART的设计,选择合适的病人,剂量,首要终点,关注安全性包括免疫原性。此外,高效高质量的开展临床试验也可以降低失败的风险。 参考资料: 1. Lancet. 2016 July 30; 388(10043): 488–497. 2. Olaratumab phase III study. ASCO 2019 3. N Engl J Med . 2017 Apr 20;376(16):1517-1526. 4. 陈晓媛2020年同写意《临床试验失败案例》 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |