基因编辑技术CRISPR的发展简史:从发现到爆炸 |
您所在的位置:网站首页 › 中国基因研究第一人是谁 › 基因编辑技术CRISPR的发展简史:从发现到爆炸 |
基因编辑技术CRISPR的发展简史:从发现到爆炸
|
CRISPR能在细菌的免疫功能中起作用在2007首次得到实验证实。Horvath研究组发现嗜热链球菌被病毒入侵后整合了来自噬菌体基因组新的间隔区序列,同样的病毒再次入侵时细菌就有了抗性,使其免遭攻击。同时人为地去除或添加特定的间隔区序列,会影响细菌的抗性表型。因此,他们认为CRISPR及cas基因一起为嗜热链球菌提供了对噬菌体的抗性作用,同时抗性的特异性取决于CRISPR中的间隔区序列,细菌的这种免疫性是可以遗传的。至此,虽然科学家并不清楚CRISPR/Cas抵抗病毒的具体机制,但他们开始逐渐揭开其神秘的面纱。 2008年,Oost实验室揭示了宿主细胞中CRISPR的间隔序列如何在cas蛋白的协助下介导发挥抗病毒作用。他们发现在CRISPR转录后,cas蛋白会形成一个称为Cascade的复合物,裂解每个重复单元中的CRISPR RNA前体(pre-crRNA),但裂解产物都保留了间隔序列。在解旋酶cas3的作用下,成熟的CRISPR RNA(crRNA)发挥小向导RNA(small guide RNA)的角色,促使Cascade干预病毒的增殖。2009年,Mojica团队指出前间隔序列临近的PAM序列为原核生物中CRISPR/Cas发挥免疫识别提供了靶标。 2011年,Charpentier研究组通过对人类病原体化脓性链球菌的差异化RNA测序,揭示了反式编码crRNA(tracrRNA)参与pre-crRNA的加工成熟过程。他们指出,tracrRNA通过24个核苷酸与pre-crRNA中的重复序列互补配对,在保守的内源性RNA酶III和CRISPR相关的Csn1蛋白的参与下指导pre-cr RNA的成熟过程,这些组分对保护化脓性链球菌免受噬菌体DNA的入侵必不可少,研究揭示了crRNA成熟的新途径。 以上我们一直在介绍CRISPR/Cas的发现及细菌、古细菌如何利用该系统来沉默外来核酸以抵御病毒及质粒的入侵。CRISPR/Cas作为基因编辑系统被应用最早开始于2012年两位女神的强强联合,她们分别是来自加州大学伯克利分校的结构生物学家詹妮弗·杜德纳(Jennifer Doudna)和瑞典于默奥大学的埃马纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)。她们通过体外实验证明:成熟的crRNA通过碱基互补配对与tracrRNA形成特殊的双链RNA结构,指导cas9蛋白在目标DNA上引起双链断裂。在与crRNA指导序列互补的位点,cas9蛋白的HNH核酸酶结构域切割crRNA的互补链,而cas9蛋白RuvC样结构域切割非互补链。当双tracrRNA:crRNA被嵌合到一条RNA时,同样可以指导cas9切割双链DNA。她们的研究证明,在双链RNA指导下切割双链DNA断裂的内切酶家族并揭示了CRISPR/Cas系统在RNA指导下进行基因编辑的巨大潜力。
►CRISPR/Cas系统发现历程中的主要贡献者 之后就一发不可收拾,紧接着是2013年初的两篇Science和一篇Cell文章,它们分别由来自于哈佛大学医学院的George Church、麻省理工学院博德研究所的张锋以及加州大学旧金山分校系统及合成生物学中心的Lei S. Qi(目前就职于斯坦福大学)实验室,这三篇文章都将CRISPR/Cas系统成功应用到哺乳动物细胞中。其中Church研究组设计了II型CRISPR/Cas系统,在人类细胞中设计特定的gRNA。对于内源性AAVS1基因座,他们成功获得了293T细胞中10%至25%,K562细胞中13%至8%以及诱导多能干细胞中2%至4%的靶向率。他们同时表明这个过程依赖于CRISPR组件,是特定的序列;在同时引入多个gRNA时,可以实现对目标基因座的多重编辑。张锋实验室证实了cas9可以在小RNA的指导下在人类及小鼠细胞中对内源基因座实现精确切割,同时他们将cas9改造为缺口酶促进同源修复。Qi与同事则将II型CRISPR/Cas系统中的cas9蛋白改造成失去核酸内切酶活性的dCas9,将其与gRNA共表达,产生一种DNA识别复合物使其特异性地干扰转录延伸,RNA聚合酶或转录因子与DNA的结合达到抑制目标基因表达的目的。他们将其称为CRISPRi,实现了对大肠杆菌中基因的有效抑制,且没有明显的脱靶效应。而且可以实现同时抑制多个基因,他们表明CRISPRi也适用于哺乳动物细胞。很快人们利用CRISPR/Cas系统实现了对斑马鱼、真菌及细菌的基因编辑。2013年5月,Jaenisch研究组利用CRISPR/Cas介导的基因工程技术制造了在多个基因上含有多重突变的小鼠,极大地促进了体内多基因的功能学研究。随后,人们实现了对果蝇、线虫、大鼠、猪、羊、以及水稻、小麦、高粱等多种生物的基因编辑。
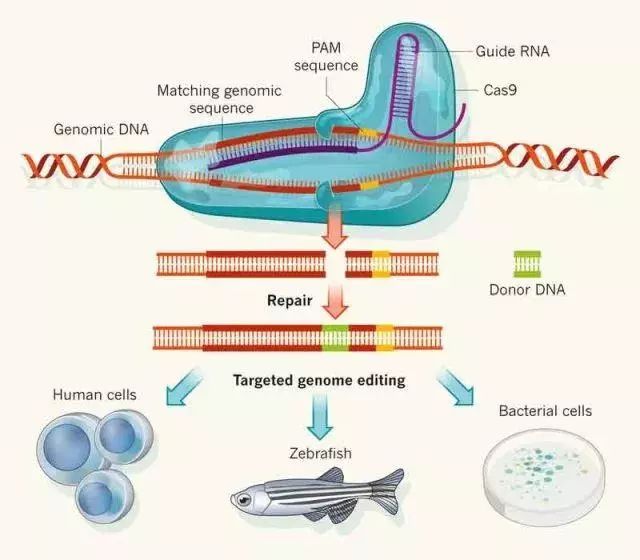
►基因编辑技术的基本原理,图片来自origene.com 距开始利用CRISPR/Cas进行基因编辑不到一年时间里,人们就实现了用该系统来校正遗传疾病。2013年12月,李劲松研究组和Hans Clevers研究组利用CRISPR/Cas9系统分别校正了小鼠白内障及人干细胞中一种与囊肿性纤维化相关联的基因缺陷。同时,研究者通过向人类细胞转染慢病毒包装的sgRNA库,实现了对基因组范围的功能性筛选。2015年4月,黄军就和团队首次修饰人类胚胎DNA,为治疗一种在中国南方儿童中常见的遗传病——地中海贫血症提供了可能。 随着对CRISPR系统研究的不断深入,也暴露了一定的缺陷和局限性,如严重的脱靶效应。2015年9月,张锋研究组报道了一种不同于Cas9的新型2类CRISPR效应因子Cpf1。他们的研究证明,Cpf1是一种不依赖tracrRNA,由单个RNA介导的核酸内切酶。Cas9是在同一个位置同时剪切DNA分子的双链,形成的是平末端;而Cpf1剪切后形成是两个不同长度的链,被称之为黏性末端。同时Cpf1能够识别富含胸腺嘧啶(T)的PAM序列,可以扩展CRISPR的编辑范围。 已知的许多遗传疾病由点突变引起,然而目前纠正点突变的方法存在效率低或引起随机缺失或插入等缺陷。2016年4月,David R. Liu研究组报道了一种碱基编辑的新方法。他们将胞嘧啶脱氨酶与CRISPR/Cas9进行融合,在gRNA的指导下,不引起DNA双链断裂,直接实现胞嘧啶(C)到尿嘧啶(U)的转变,而DNA复制进一步使得U被T代替,从而实现C→T (or G→A)的转换。这种碱基编辑器可有效纠正多种与人类疾病相关的点突变。他们还发展了第二、第三代碱基编辑技术,进一步提高碱基编辑效率。在此基础上,上海科技大学陈佳研究组与合作者共同开发了一种增强型碱基编辑器。他们发现,将含有尿嘧啶DNA糖基化酶抑制剂(UGI)的质粒与sgRNA/BE3共同转染293FT细胞,经深度测序分析,与单独转染sgRNA/BE3相比,共转染的方法减低了错配频率并提高了C-到T-的替换效率。他们还发现UGI的表达水平与C-到T-的碱基替换效率成正相关。为了提高实验的方便性,研究者还将多个重复UGI与BE共表达在同一载体,与靶向不同基因座的多个sgRNA共同转染293FT细胞,结果表明这种增强型碱基编辑器大大提高了编辑效率。 2016年6月,张锋研究组发现一种来自纤毛菌(Leptotrichia shahii)的效应因子C2c2(现被称为cas13a),具有RNA介导的RNA酶功能。体外生化分析显示C2c2可在单个crRNA指导下剪切靶向单链RNA。细菌内,C2c2可被用来敲低特异性的mRNA,RNA酶活性依赖于HEPN结构域,C2c2是第一个被发现的靶向RNA的CRISPR效应因子。 2016年10月,第一个由CRISPR/Cas9编辑进行的临床治疗实验由Lu团队完成,研究者分离患有转移性非小细胞肺癌病人血液中的免疫细胞,特异性的敲除PD-1基因,对细胞扩增培养后输回患者体内以期抵抗癌症。 2017年10月,David R. Liu团队将编码tRNA腺嘌呤脱氨酶(TadA)的基因引入大肠杆菌内,经历了漫长的7代筛选后,开发出了一款全新的“碱基编辑器”,将进化后的TadA与CRISPR/Cas9系统融合,在不引起DNA链断裂的情况下实现了A•T到G•C的转换,且在人体细胞中,编辑效率超过了50%。这样就实现了C•G 到 T•A和A•T 到G•C的高效编辑,为多种遗传疾病的治疗提供了有效工具。 重大里程碑:美“魔剪”抗癌首例人体实验将在宾大进行!当年的太空竞赛正在 CRISPR 应用上重演,中美医疗竞争号角已吹响 数十年来,人类从未停止过与癌症的抗争,血、泪、汗,记录着每一份努力。但这从不是某单个人的厮杀,或是哪一个民族的孤军奋战,而是全人类共同的征程。而今,抗癌大战即将再次打响,这次,近年来大火的基因编辑技术 CRISPR 将会助我们一臂之力。
来自美国宾夕法尼亚大学(University of Pennsylvania)的医疗工作者们此刻正在为人类临床试验的开展做最后的准备,只要万事俱备,项目就会全面启动,此次临床试验主要针对多发性骨髓瘤(Multiple Myeloma)、滑膜肉瘤与黏液样脂肪肉瘤(Synovial Sarcoma, SS;Myxoid/Round Cell Liposarcoma, MRCL)、黑色素瘤(Melanoma)的患者,而这也将成为美国首次使用 CRISPR 治疗癌症的尝试,也是除中国之外,CRISPR 在医疗领域的再次登场。 姗姗来迟的初次登场 美国东部时间本月 15 日,宾夕法尼亚大学将该项目公示在美国国家卫生研究所(National Institutes of Health,NIH)的临床试验(https://clinicaltrials.gov/show/NCT03399448)信息网站上,对试验的具体细节进行描述,本次临床试验按照疾病类型将分为三个组同时进行,计划共将招募 18 名 18 岁以上患者,I 期的试验周期为 5 年,目前受试者招募还未开启。
图 |该项目的网页信息 实际上,早在 2016 年 6 月,美国国立卫生研究院(NIH)就已经对宾大的研究项目大开绿灯,但直到今天,吵吵嚷嚷一年多,研究人员们仍在不停的准备中,没有完全的把握,谁都不敢拿别人的性命做豪赌。更严肃的是,任何一个生命的逝去都可能让一个热门技术经历从天堂到地狱。 “我们目前正处于 I 期试验开始的最后准备阶段,但具体的开始时间还不确定,”宾大的发言人如是说。
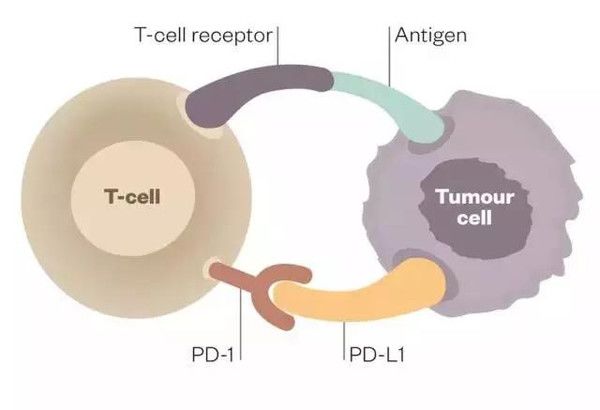
图 |Edward Stadtmauer 医生 该项研究由 Edward Stadtmauer 医生领衔,通过对人体免疫细胞(T 细胞)修饰编辑,使其成为癌细胞的“克星”,识别并攻击肿瘤细胞。为了增强治疗效果,来自宾夕法尼亚大学的研究者们首先在患者体外使用基因编辑技术 CRISPR 编辑了 T 细胞中的几个关键基因,使其成为无所畏惧的抗癌“战士”,随后在实验室中培养增殖,最终注射回患者体内。 被删除的一段序列是用来合成免疫检查点抑制剂 PD-1(programmed death 1,程序性死亡受体 1)的基因,PD-1 是一种重要的免疫抑制分子,为 CD28 超家族成员。以 PD-1 为靶点的免疫调节在抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等方面均有重要的意义。
图 | 一袋编辑过的人类 T 细胞 PD-L1(programmed cell death-Ligand 1,程序性死亡受体-配体 1)则是 PD-1 的配体,正常情形下免疫系统会对聚集在淋巴结或脾脏的外来抗原产生反应,促进具有抗原特异性的 T 细胞增殖。而当 PD-1 与 PD-L1 结合,抑制性的信号将会被传导,最终导致 T 细胞增殖的减缓。 肿瘤细胞逃避 T 细胞摧毁的一种途径是通过在它表面产生 PD-L1,当免疫细胞 T 细胞表面的 PD-1 识别 PD-L1 后,可以传导抑制性信号,T 细胞就不能发现肿瘤细胞和向肿瘤细胞发出攻击信号。
因而,当 T 细胞的 PD-1 表达被人为破坏,也就意味着免疫细胞里容易被“策反”的忠臣被剔除了,识别肿瘤变得“快、准、狠”,T 细胞变成“智勇双全”的神奇战士。 另一项“破坏”工作是针对免疫细胞的 T 细胞受体(T cell receptor, TCR, TCRα, TCRβ)的,T 细胞受体是 T 细胞表面的特异性受体,负责识别由主要组织相容性复合体(MHC)所呈递的抗原。同时,研究者们也使用慢病毒载体向 T 细胞中插入一种 T 细胞受体-NY-ESO-1,增强其对肿瘤的识别能力。 对于该项临床试验,团队的 I 期目标是确定单次注射的安全剂量,并评估制造基因修饰 T 细胞的操作可行性。同时,也将监测患者在六个月内达到缓解的百分率,存活率及其他指标,预计 I 期将会有 5 年时间。 中美欧科学家们的 CRISPR 应用竞赛 事实上,中国科学家们才是“第一群吃螃蟹的人”。早在 2016 年 10 月 28 日,来自四川大学的医疗团队就已经开展了人体首例基因编辑(基于 CRISPR)的临床试验,该研究由四川大学华西医院肿瘤科主任卢铀带领,通过从转移性非小细胞肺癌患者血液中提取免疫细胞,利用 CRISPR 技术让免疫细胞中负责编码 PD-1 蛋白的基因失去活性,随后在实验室进行培养扩增,达到一定数量后再重新注入患者体内。此试验共有 10 名患者参与,在治疗中,医生根据患者健康条件,分别选择 2-4 次注射,该 I 期的临床试验的主要关注点同样在于患者安全性及存活率。
图 | 卢铀教授 近年来,全球医学界对中国科学家尝试基因编辑治疗疾病应用的关注确实在增加,因为我们的确领先了一小步,尤其是在使用 CRISPR技术编辑胚胎上。目前,全球已有的四例胚胎编辑实验,中国科学家均有参与。 2015 年,来自中山大学的黄军就教授带领团队首次发表编辑人类胚胎的相关论文,宣布他们在实验室中使用CRISPR/Cas9系统,将胚胎中地中海贫血症相关基因敲除,完成世界上“首例胚胎编辑”实验。但事实上由于镶嵌现象和脱靶效应,整个胚胎井没有被完全编辑,同时以此种方式出生的孩子可能面临未知或是无法承受的风险,因而,严格意义上来讲,这次胚胎编辑并不能算是成功。
2016 年3月,世界上第二例人类胚胎编辑实验同样由中国团队完成。来自广州医科大学附属第三医院的范勇教授利用 CRISPR/Cas系统对人类受精卵进行基因编辑,以抵制艾滋病毒感染。2017 年,广州医科大学附属第三医院刘见桥教授带领团队再一次完成了“世界首次”一将 CRISPR初次应用于人类二倍体胚胎,在胚胎层面对携带遗传突变基因的胚胎进行修复。 2017年8月,《 Nature》杂志发文介绍了美国首例基因编辑人类胚胎的研究,该项研究由来自于俄勒冈健康与科学大学的 Shoukhratb Mitallpov团队完成,团队中同样有中国科学家的身影。他们通过 CRISPR/Cas9技术锁定并移除了42 个胚胎内肥厚型心肌病有关的变异基因。
尽管将 CRISPR 技术应用到胚胎编辑上仍充满争议,但是,各国的科学家并不会因此停止探索其应用边界的脚步。事实上,在 CRISPR 技术发明之前,许多研究人员已经看见了基因编辑在治疗各类疾病中不可限量的前景。而随着CRISPR 技术的引入,这种更为简单、高效、准确的基因编辑技术将使基因疗法进入临床阶段的时间大大提前。 而欧洲自然也希望在 CRISPR 的疾病应用上分一杯羹。预计今年晚些时候,欧洲也将开展其首个 CRISPR 临床试验,同样,他们也将选择体外修饰增殖后注射回患者体内的方法。 “医疗竞争的号角已然吹响,类似当年的美苏太空竞赛,只不过这次是在生物医疗领域的争夺。这种竞争之所以重要,是因为良性竞争会不断提升技术和终端产品的可靠性”,美国肿瘤细胞免疫疗法的先驱者,同时也是一个重大基因疗法科研计划的科学顾问的卡尔·朱恩教授表示。
图丨George Church(图片来自DT君) 在DT君此前的一次独家专访中,哈佛大学著名教授 George Church 说:“我倒不觉得“军备竞赛”是个恰当的比喻,我认为更像是当年的‘电子产业革命’,具体说来就是加州的电子产业与日韩等国的竞争。只要有人通过创新领先一步,其他人就要奋起直追,这其实更多的是一种相互促进的合作机制。” George Church 还表示,无论如何,中美两国都将成为全球基因技术的领军者。“世界上其他国家和地区相比就比较“落后”了。欧洲人由于太害怕基因改造生物(GMO)而裹足不前,其他国家取得的进展也有限。中美两国我认为在未来更多的会是合作而不是竞争”,他说。 总而言之,看似平静的湖面已经吹起阵阵涟漪,在这场关于应用 CRISPR 征服癌症等疾病的大战中,中美欧中谁将领先一步,我们拭目以待。 历史性进展!CRISPR与干细胞联姻:单基因开启普通细胞逆转为干细胞之路!
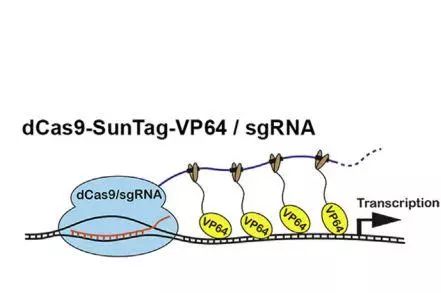
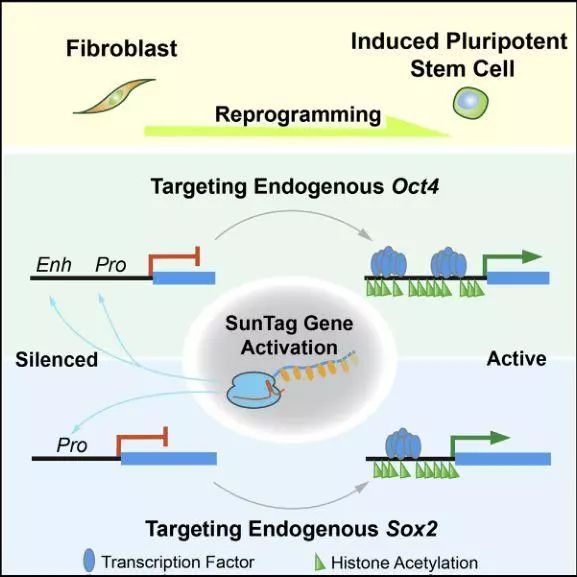
文章中激活特定基因的CRISPR系统 干细胞是摇篮,孕育了其他各种功能的细胞。那么如何获取和制造大量的干细胞呢?以前我们会通过转录因子和一些化学物质诱导普通细胞转变为干细胞。然而,今天,我们看到了干细胞领域的重大突破:单个基因即可实现普通细胞逆转为干细胞! 多能干细胞可以转化为体内的任何细胞类型。因此,它们是目前无法治愈的疾病——如心力衰竭、帕金森病和失明症的关键治疗资源。同时他们也可以作为重要的模型进行药物的实验。 目前诱导普通细胞转化为干细胞的方法主要有2种:第一种是通过转录因子的添加实现细胞关键信号的开闭,从而实现普通细胞的逆袭,而这个突破也让发现者荣登了诺贝尔奖的宝座;而另一种则是利用一些化学的分子组合实现普通细胞转化为干细胞。 而在《Cell Stem Cell》上面的这篇文章则揭示了诱导普通细胞转化为干细胞的第3种方法!这篇名为“CRISPR-Based Chromatin Remodeling of the Endogenous Oct4 or Sox2 Locus Enables Reprogramming to Pluripotency”的文章,揭示了CRISPR可以激活细胞中的两个特定基因,从而实现普通细胞的逆袭!
文章网址:http://www.cell.com/cell-stem-cell/fulltext/S1934-5909(17)30501-5 技术的发展推动的往往不是一个领域的发展,而是多领域的共同进步。CRISPR和干细胞的联姻,让我们看到了不一样的世界。 在此之前的研究中,研究人员已经确定了干细胞表达的两个关键基因:Sox2和Oct4。这两个基因和获得诺贝尔奖的转录因子相似,都是诱导干细胞分化和关闭的基因。而在进一步的研究中,研究人员发现:只要对Sox2和Oct4基因中任何一个基因进行激活(或关闭),就可以实现普通细胞逆袭之路,最终转化为干细胞!
研究的主要作者丁胜博士说道:“在研究最初始的时候,我们只是尝试性的进行研究,确认是否有可能。然而实验结果大大出乎了我们的意料——单基因实现普通细胞逆转成干细胞确实可行!” 当然,基因是一个牵一发而动全身的过程,至于为什么拨弄这一根弦就能奏出美妙乐曲的原因,还有待我们探索。 文章来源:知识分子、DeepTech深科技、转化医学网返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |