传奇生物为何成为国内首家CART细胞治疗上市公司 原文发表于微信公众号“端粒投资”。2020年6月5日, 传奇生物 在纳斯达克上市,股票代码NASDAQ: LEGN,每股... |
您所在的位置:网站首页 › 中国cart费用 › 传奇生物为何成为国内首家CART细胞治疗上市公司 原文发表于微信公众号“端粒投资”。2020年6月5日, 传奇生物 在纳斯达克上市,股票代码NASDAQ: LEGN,每股... |
传奇生物为何成为国内首家CART细胞治疗上市公司 原文发表于微信公众号“端粒投资”。2020年6月5日, 传奇生物 在纳斯达克上市,股票代码NASDAQ: LEGN,每股...
|
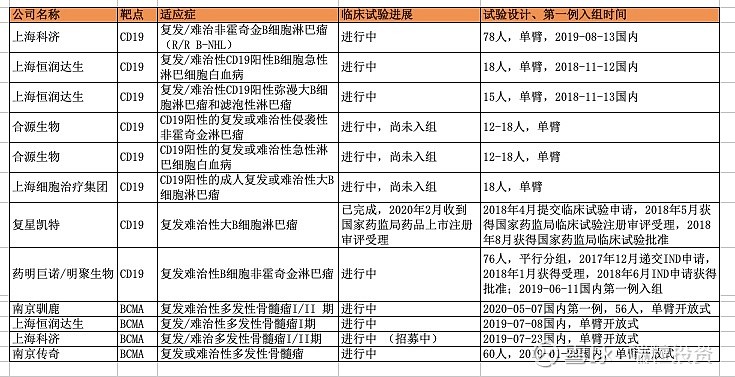
来源:雪球App,作者: 端粒投资,(https://xueqiu.com/3761099683/152190801) 原文发表于微信公众号“端粒投资”。 2020年6月5日,传奇生物在纳斯达克上市,股票代码NASDAQ: LEGN,每股ADS定价23美元,普通股:ADS的比例为2:1,预计融资约4.238亿美元。上市当日,股票上涨60%左右,收盘价37美元。 传奇生物成为中国CART细胞治疗公司第一家上市公司。有点出乎意料,本来市场等着药明巨诺、复星凯特这些公司先完成IPO,没想到传奇成为了IPO“传奇”。 根据公告,传奇上市的时间表很快。从3月9日交表到6月5日挂牌上市,不到3个月时间,可谓神速。 2020年3月9日,传奇生物公告已经向SEC秘密提交IPO文件F-1。 2020年4月1日,传奇生物公告完成A轮优先股融资,融资额1.505亿美元,投资机构为 Hudson Bay Capital Management LP, Johnson & Johnson Innovation - JJDC, Inc., Lilly AsiaVentures, Vivo Capital, RA Capital Management和其他知名机构。考虑到公司马上上市,A轮也可以认为是pre-IPO。如今的资本市场,叫什么轮次已经没那么重要了。 2020年6月5日,完成定价,上市发行,Morgan Stanley, J.P. Morgan和Jefferies 担任联合book-running managers。 2020年6月9日,完成上市发行IPO。 那么传奇生物为什么能成为国内CART第一个IPO的公司?为何选择美股而没有选择港股18A? 一. 传奇成为中国CART第一家上市公司原因 首先,公司发展策略清晰、临床进展不错,后续详解。如果公司质量不好,大摩也不会出手做book runner,大牌机构也不会抢着在IPO前突击入股。 其次,选择美股而没有选择港股。市场传言药明巨诺已经联系港交所上市,如果传奇再选择港股,容易撞车。 并且,传奇声称总部是美国新泽西,是美国公司。还有强生的大力支持,新入职的CFO是美林知名生物分析师黄颖。是华尔街喜欢的profile。 从CDE的临床试验数据可以看到,国内大部分公司做的还是CD19为靶点的CART,南京传奇选择的是BCMA靶点。尽管复星凯特的国内临床试验进展最快,但是IPO速度南京传奇成了第一。
二. 传奇生物快速发展原因 根据招股书披露,传奇生物成立于2015年,概念形成2014年,从港股上市公司金斯瑞GenScript分拆spin-off。 第一,选取了BCMA靶点,而非拥挤的CD19靶点。在国内选择CD19的好处显而易见,国外诺华和kite凯特已经于2017年拿到了FDA批准,有国外的成功批准在国内批会更好通过,毕竟T细胞治疗这么先进的治疗方式门槛高、风险高。 为了快速拿到国内第一个证,聪明的创业者和投资人们都在想策略。药明第一家与国外公司合作,选择了当时风头正盛的Juno合资成立药明巨诺,复星紧随其后选择与kite合作成立复星凯特。没想到Juno虽然最早做临床试验但一直没有拿到证,反倒是诺华拿到了第一个证、kite拿到了第二个证,复星凯特由此反超。 根据复星披露,复星凯特从 Kite Pharma 引进、获得在中国大陆、香港特别行政区和澳门特别行政区的技术及商业化权利,截至 2020 年 1 月,复星凯特对该产品累计研发投入约为人民币 47,400 万元(含专利和技术许可费用,未经审计)。 BCMA目前全球还没有拿到证的。进展快的是纳斯达克上市公司Bluebird,BCMA多发性骨髓瘤临床已到3期。
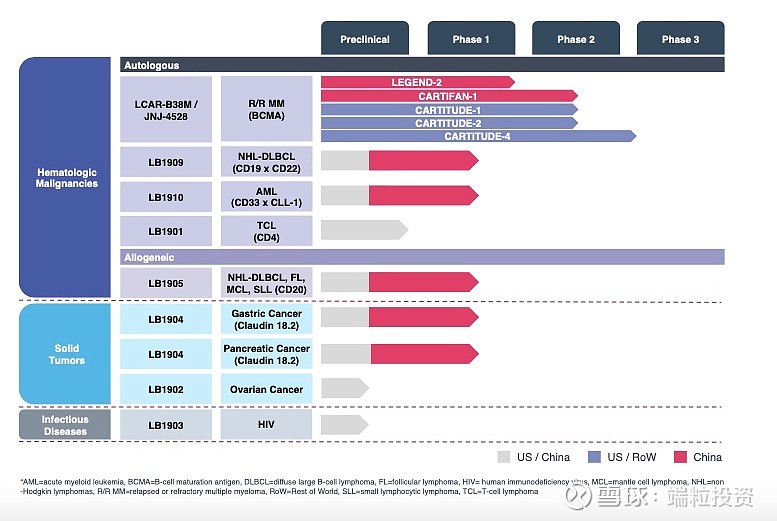
南京传奇选择了BCMA,细分靶点进展是国内最快的,这就是策略选择智慧。如果加上强生合作支持,说不定可能赶超Bluebird。 第二,与Jassen杨森(强生)强力合作。2017年12月,传奇与杨森就LCAR-B38M/JNJ-4528签订全球开发和商业合作协议。根据协议, (1)杨森将负责LCAR-B38M/JNJ-4528的全球临床试验, (2)传奇负责大中华区的监管、定价、销售,杨森负责大中华区外全球其他市场的监管、定价、销售。 (3)除大中华区外,两家共同承担开发、生产、商业成本和税前收益/损失,分配比例为传奇70%、杨森30%。 传奇由此得到的收益包括 (1)upfront fee 3.5亿美元,已支付 (2)四个阶段的milestone payment共计1.1亿美元,已支付 (3)未来还可以收到manufacturing milestone 1.25亿美元,以及未来开发、监管、销售milestones费用11.15亿美元。 其中,1.1亿美元四个阶段的收入主要来自以下四个里程碑,2018年12月收到2500万、2019年6月收到3000万、2020年1月收到3000万,分别对应临床试验的病例数,2019年6月收到2500万、对应ORR至少50%的临床数据。 未来11.15亿美元收入对应1.05亿美元未来开发里程碑、8亿美元监管批准、2.1亿美元销售里程碑。 与药明、复星需要支付国外公司license fee相反,传奇与强生的合作是大厂支持传奇创业,目前已经收到4.6亿美元,未来还可能收到12.4亿美元,共计17亿美元。不失为一种聪明策略。当然,有人会觉得把大中华区外的市场交给大厂有点可惜,决策选择总是有得有失,看怎么想。大厂的经验除了资金实力强,在临床试验方面相当有经验,那可是一个个blockbuster药拼出来的know-how经验。 以CD19的CART临床试验为例,Juno因中间临床试验出问题受到了很大影响,反倒是诺华因为临床试验经验丰富后来居上,第一个拿到了FDA批准,这就是大厂的能力和经验所在。 与强生合作后,传奇的临床试验确实进展快速。目前的pipeline进展如下。国外试验进展速度快于国内试验。这也是公司选择美股上市的原因之一,可以直接与Bluebird比较。
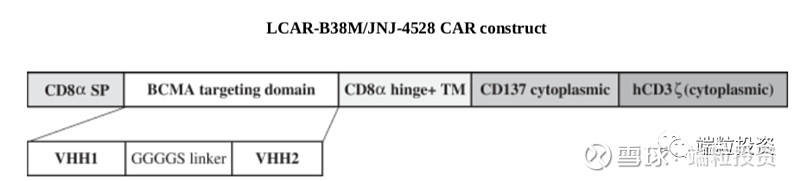
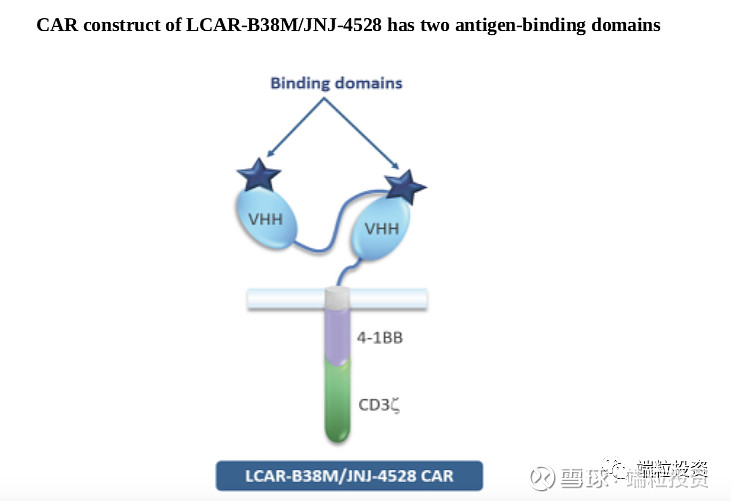
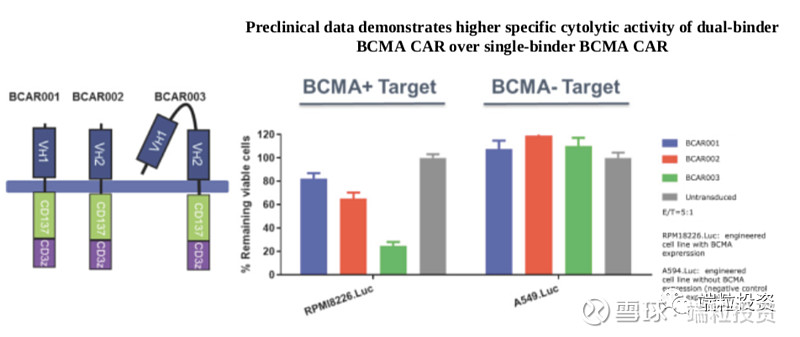
2019年12月,公司发布来自国内4个临床试验中心、74个病人的数据,平均25-26个月的follow-up, ORR(overall response rate)比例80%,CR(complete response)比例74-82%,mOS(median overall survival)36.1月。美国、日本已经完成Phase 2入组。Phase 1b的所有29个病人ORR为100%(这数据也太漂亮了)。到2020年4月,29个病人中的25个,也就是86%为sCR (stringent complete response), median follow-up为11.5月。公司预计2020年年中得到phase 2数据,同时将向FDA申请BLA (Biologicals License Application), 向EMA申请MAA(market authorization application)。 2019年底,公司有650人,105位有PhD或者MD学位,其中336名为研发人员。其中,美国158人、亚太479人、爱尔兰8人。 三. CART行业概述 T细胞作为免疫系统的重要组成部分,负责保护机体抵御感染性病原、癌症细胞。正常情况下,通过T细胞受体,T细胞可以识别并消灭癌症细胞。癌症细胞可发展出逃逸T细胞检查机制,肿瘤免疫治疗的策略就是提高免疫机制消灭癌症细胞。 过继性细胞治疗Adoptive cell therapy, or ACT是肿瘤免疫的一种策略,大多数采用自体免疫细胞,将其扩增,用特殊的生长因子、细胞因子、趋化因子或者抗原刺激,通过基因工程达到识别和消灭癌细胞的目的。 有两种常用的工程化ACT,CAR-T和TCR-T。CAR受体融合单克隆抗体的特异性和T细胞的细胞毒性和检查功能,结合到肿瘤细胞表面特异高表达蛋白,激活T细胞。CD19是淋巴癌细胞高表达的抗原,因此以CD19为靶点的Kymriah和Yescarta于2017年获得FDA批准。 Kymriah:诺华+宾夕法尼亚大学 First-in-class首个CART细胞免疫疗法新药 2017年8月30日获得FDA批准 难治性/复发性B细胞急性淋巴细胞白血病ALL、非霍奇金淋巴瘤NHL CAR:CD-19抗体 剂量: 10^6 -10^8 CAR-positive viable T cells 定价:47.5万美元 安全性:细胞因子风暴CRS 2017-2019年销售收入分别为600万、7600万、2.78亿美元,2018-2019年完整销售年度收入增长达达3.66倍 扩展到200个治疗中心、20个国家 Yescarta:Kite公司,2017年被Gilead以119亿美元收购 第二个获批的CART药物 2017年10月19日获得FDA批准 难治性/复发性非霍奇金淋巴瘤NHL CAR:CD-19抗体 剂量: 10^6 -10^8 CAR-positive viable T cells 定价:37.3万美元 安全性:细胞因子风暴CRS 2018-2019年销售收入分别为2.64亿、4.56亿美元,2018-2019年完整销售年度收入增长达1.73倍 CART药物研发的挑战主要有四点。 (1)肿瘤抗原靶点选择。靶点应该是肿瘤细胞表面能被CART细胞识别,正常细胞表达量低、肿瘤细胞表达量高、不能脱落或者内化。 (2)设计出理想的CAR结构。亲和力强、有灵活性,过度激活T细胞会造成严重的副反应细胞因子风暴CRS。 (3)临床前到临床的转化。动物很难完全模拟人体的免疫系统、肿瘤微环境、抗原分布等,因此从preclinical到clinical有很大的挑战性。 (4)生产复杂性。自体CART需要从患者身上提取T细胞再扩增、打回体内,过程长、很难有规模经济、不同个体细胞的活性不同。 多发性骨髓瘤MM占全球血液肿瘤比重10%、恶性血液瘤死亡率的20%,死亡率居高。尽管有多种治疗MM的方案,但患者易出现复发、从而成为难治性疾病,relapsed/refractory, 简称r/r。目前MM的治疗方法包括单克隆抗体、蛋白酶体抑制剂、免疫调节剂等,2018年全球市场规模约180亿美元。目前治疗方案的5年生存率约为52%。2018年美国MM新发病例3.2万、死亡1.28万例;全球预计2018年新发MM病例16万例。 B-cell maturation antigen,简称BCMA,B细胞成熟抗原。BCMA通常在B细胞表达,在一些恶性血液瘤中高表达,BCMA在多发性骨髓瘤MM中的表达量比正常细胞高上百上千倍,因此可被当做特异靶点。传奇生物的CART采用单域抗体single-domain antibodies,从驼llamas构建CAR,两个结合区域VHH1和VHH2与T细胞共刺激区域4-IBB蛋白(CD137)和CD3 zeta链相连,可以结合BCMA的两个表位epitopes。因此亲和力更高,比单结合点有更高的特异细胞毒性。
四.管理团队和股权结构 公司2014年成立,CEO Xu Yuan博士2018年3月才加入。她是南京大学生物化学本科、马里兰大学生物化学博士,加州大学病毒和基因编辑博士后。先后在基因泰克、葛兰素史克、Chiron、安进、诺华、吉利德、诺华工作。Base为年薪47万美元,可以在5年时间内满足条件前提下、以1美元每股的价格行权购买440万股股票。按照目前ADS为40美元、每股20美元计,股票价值约8400万美元。 新任CFO Huang Ying博士于2019年7月加入公司。中科大少年班、哥伦比亚大学生物有机化学博士。曾在先灵葆雅从事心血管和神经药物研发,之后先后在Wells Fargo、Credit Sussie,Gleacher、Barclays、BofA从事生物制药上市公司分析师工作。Base为年薪45万美元,可以在5年时间内满足条件前提下、以1.5美元每股的价格行权购买100万股股票。按照目前ADS为40美元、每股20美元计,股票价值约1800万美元。 背后大佬是章方良博士,传奇生物董事会主席、金斯瑞共同创始人。成都地质学院本科、南京大学硕士、杜克大学生物化学博士,1995-2002年在先灵葆雅工作,2002年合作创立金斯瑞,2015年分拆传奇生物。 上市前,公司股权结构为金斯瑞76.9%、AquaPoint 13.7%、创始人章方良15.2%(包括其在AquaPoint中的股份)。
五. 财务报表和投资机构
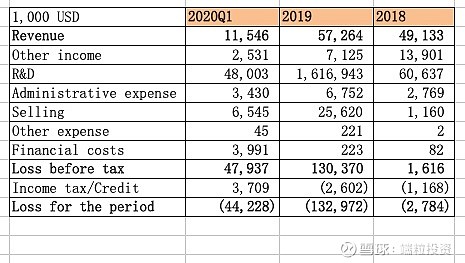
公司2018、2019年用于BCMA的研发费用分别为4490万美元、1.157亿美元,其他项目的研发支出分别为1570万美元、4630万美元。截止到2020年一季度,公司用于研发的总支出预计约2.797亿美元。 作为在临床阶段的生物制药公司,公司每年都有收入,并且持续增长,算是难得的。 2020年4月1日,传奇生物公告完成A轮优先股融资,融资额1.505亿美元,投资机构为 Hudson Bay Capital Management LP, Johnson & Johnson Innovation - JJDC, Inc., Lilly Asia Ventures, Vivo Capital, RA Capital Management和其他知名机构,融资每股价格7.792美元,折合ADS为15.584美元;按照39美元ADS价格,已经稳获翻倍收益,基本上算是送钱给投资机构了。虽然有180天lock-up锁定期,预计火线入股的投资机构都会赚得盆满钵满。 参考文献 各大公司网站、年报、招股书 CDE数据 雪球 |
【本文地址】
今日新闻 |
推荐新闻 |