FDA窄治疗指数药物目录及生物等效性指导原则介绍与分析 |
您所在的位置:网站首页 › 丙戊酸钠片 › FDA窄治疗指数药物目录及生物等效性指导原则介绍与分析 |
FDA窄治疗指数药物目录及生物等效性指导原则介绍与分析
|
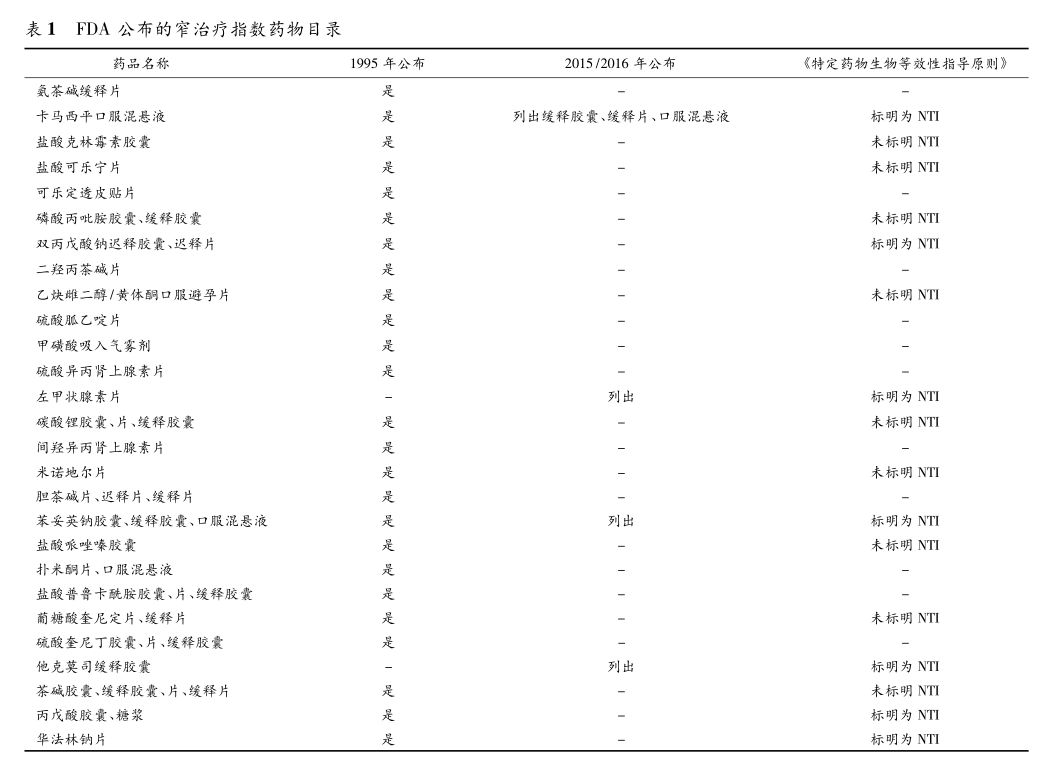
1 方法 笔者将着重介绍美国FDA多次发布的窄治疗指数药物药品名单,结合FDA特定药物的生物等效性指导原则进行分析,并对部分品种从试验设计、试验方案、受试者选择、检测物质、药动学参数、生物学统计方法、生物等效性豁免等方面进行介绍分析。 2 结果 2.1 美国FDA多次发布窄治疗指数药物名单 FDA下属药品审评和研究中心(CDER)于1995年11月发布的速释口服固体制剂的扩大规模和上市后变更指南的附录中公布了包括25个窄治疗指数药物的目录,见表1。2015年和2016年《监管科学报告:窄治疗指数药物》中公布了卡马西平、苯妥英钠、左甲状腺素、他克莫司等4种药品为窄治疗指数药物。与1995年公布的名单相比,左甲状腺素片和苯妥英钠缓释胶囊均为新增,见表1。虽然FDA在《以药动学为终点评价指标的仿制药生物等效性研究指导原则(草案)》中对仿制药BE研究的思路更清晰、具体,但是关于窄治疗指数药物的BE研究方案仍然不够明确。自2010年发布日起,FDA持续更新《特定药物的生物等效性指导原则》药物的品种和内容,并且在2012年以后发布的特定药物的生物等效性指导原则中,对涉及因治疗窄窗而需要特殊BE研究设计的品种进行了标注,并以《华法林钠生物等效性指导原则》为参阅标准对窄治疗指数药物的生物等效性试验作了较为详细说明。
我们对上述26个药品与FDA《特定药物的生物等效性指导原则》逐一对比,结果如下:①FDA《特定药物的生物等效性指导原则》明确表明卡马西平口服混悬液(还包括缓释胶囊、缓释片),双丙戊酸钠迟释微丸胶囊、缓释片、迟释片,左甲状腺素片,苯妥英钠胶囊、缓释胶囊、口服混悬液,他克莫司缓释胶囊,丙戊酸胶囊、糖浆,华法林钠片等7种药品为NTI药物,并以《华法林钠生物等效性指导原则》为参阅标准对窄治疗指数药物的生物等效性试验作了较为详细说明;②盐酸克林霉素胶囊,盐酸可乐宁片,磷酸丙吡胺胶囊,乙炔雌二醇/黄体酮口服避孕片,碳酸锂胶囊、片、缓释胶囊,米诺地尔片,盐酸哌唑嗪胶囊,葡糖酸奎尼定片、缓释片,茶碱胶囊、缓释胶囊、片、缓释片等9种药品在FDA《特定药物的生物等效性指导原则》未标明为NTI药物,生物等效性试验按常规药品进行描述;③FDA《特定药物的生物等效性指导原则》未提供氨茶碱缓释片,可乐定透皮贴片,二羟丙茶碱片,硫酸胍乙啶片,甲磺酸吸入气雾剂,硫酸异丙肾上腺素片,间羟异丙肾上腺素片,胆茶碱片、迟释片、缓释片,扑米酮片、口服混悬液,盐酸普鲁卡酰胺胶囊、片、缓释胶囊,硫酸奎尼丁胶囊、片、缓释胶囊等11种药品的生物等效性指导原则。此外,FDA《特定药物的生物等效性指导原则》标明孢素胶囊、地高辛片、西罗莫司片、苯妥英咀嚼片及混悬液等品种为NTI药物(文献),见表2。
2.2 生物等效性试验设计 笔者以FDA《特定药物的生物等效性指导原则》标明的部分窄治疗指数药物品种为例阐述该类药物的生物等效性试验设计有关内容。具体品种为文中前述的卡马西平口服混悬液(还包括缓释胶囊、缓释片)等7种药品,见表2。此外,需要说明的是如我们前文所述左甲状腺素钠、西罗莫司及华法林钠等3种药品同时属于长半衰期药物,在设计生物等效性试验时需考虑其长半衰期因素。 2.3 生物等效性试验类型 FDA通常推荐需要进行空腹和餐后体内生物等效性试验,但对于口服常释制剂,当参比制剂说明书中明确说明该药物仅可空腹服用(饭前1h或饭后2h服用)时,则不考虑进行餐后试验。 FDA《特定药物的生物等效性指导原则》中窄治疗指数药物的推荐试验类型主要如下:①空腹和餐后体内生物等效性试验:大部分窄治疗指数药物需要进行空腹和餐后体内生物等效性试验;②空腹体内生物等效性试验:部分药物只推荐空腹体内生物等效性试验,如左甲状腺素钠片。不过同时指出,在有条件的情况下,可增加左甲状腺素钠片餐后试验;③撒布性药物生物等效性研究:部分药物除需要常规空腹和餐后体内生物等效性试验外,还需进行“空腹,撒布性药物生物等效性研究”,包括卡马西平缓释胶囊、双丙戊酸迟释微丸胶囊等。 2.4 生物等效性试验设计方案 治疗指数是衡量药物安全度的指标之一。FDA《特定药物的生物等效性指导原则》推荐的窄治疗指数药物等效性试验设计主要为全重复交叉试验,包括:单次给药、双处理、两序列、四周期、完全重复交叉体内试验,包括卡马西平、环孢素、地高辛、苯妥英、苯妥英钠、双丙戊酸钠、丙戊酸等;单次给药、四向完全重复交叉体内试验,如左甲状腺素钠、西罗莫司、他克莫司、华法林钠等;单次给药、四周期全重复交叉体内试验,如依维莫司。重复试验设计的优势在于其比双向交叉试验所用的受试者更少。FDA建议重复设计生物等效性研究使用以下两个序列:ABAB(受试药品-参比药品-受试药品-参比药品)和BABA(参比药品-受试药品-参比药品-受试药品)。 FDA《特定药物的生物等效性指导原则》以华法林钠片为例,较为详细阐述了NTI药物受试制剂与参比制剂的WSV计算方法、生物等效限要求、统计方法和使用的SAS程序编码。2010年4月,美国食品药品管理局(FDA)咨询委员会会议上大多数委员认为,对于NTI药物,90%CI落在80.00%~125.00%的生物等效性判断标准是不够的,对于NTI药物,由于剂量或血药浓度的微小变化就可能导致严重的治疗失败和/或严重的不良反应,因此其生物等效性判断标准应适当缩窄。当参比制剂个体内变异系数大于21%时,受试制剂与参比制剂药动学参数(AUC,ρmax)的几何均数比值的90%CI不超过80.00%~125.00%;当参比制剂个体内变异系数小于21%时,应根据参比制剂个体内变异系数的大小,成比例地缩窄90%CI,例如当参比制剂个体内变异系数为10%时,90%CI则为90.00%~111.11%,《中国药典》2015年版第四部也进行了类似的规定。 2.5 受试者选择 FDA对生物等效性试验受试者的选择一般应符合以下要求:年龄在18岁以上(含18岁);应涵盖一般人群的特征,包括年龄、性别和种族;如果药物拟用于两种性别,那么研究入选的男性和女性应占相似的比例;如果药物主要适用于老年人群,那么入选受试者应尽可能多地选择老年人(60岁以上的人);入选受试者的例数应足以使生物等效性评价具有足够的统计学效力,但并不要求所划分的亚组也满足统计学要求(一般不鼓励划分亚组进行统计分析)。 特定药物的生物等效性指导原则》对大部分窄治疗指数药物的女性受试者做了进一步的规定,规定受试者为健康男性和非孕女性;规定受试者为健康男性和女性(对女性不作特殊规定)的品种仅有苯妥英和苯妥英钠。此外,还对部分药品作出进一步的规定:如丙戊酸和双丙戊酸钠生物等效性试验前,受试者须做肝功能检查。 2.6 生物等效性试验豁免 FDA《特定药物的生物等效性指导原则》涉及的生物等效性试验豁免的情况主要包括3种:药物剂型相同,但规格不同,其活性成分和非活性成分的比例与已进行过BE试验的规格相似的情况下,根据溶出试验和最大规格BE试验可以申请一个或多个较小规格的BE试验。在FDA颁布的2015年版《基于生物药剂学分类系统的口服固体速释制剂BA/BE豁免原则(草案)》和2010年版相比,增加了BCS3类的BA/BE豁免,并规定对于BCS1类和3类的药物,只要处方中的其他辅料成分不显著影响口服固体常释制剂中活性药物成分(API)的吸收,则可申请生物等效性豁免。一些属于药效研究实施方案(Drug Efficacy Study Implementation,DESI)的有效药物,尚未发现已知或疑似的生物等效性问题,FDA不推荐进行生物等效性试验。 2005年FDA发布的《基于生物药剂学分类系统的口服固体速释制剂体内生物利用度和生物等效性研究的豁免》中明确提出基于BCS的生物等效豁免原则不适用于窄治疗指数药物。FDA《特定药物的生物等效性指导原则》窄治疗指数药物涉及的生物等效性试验豁免的情况主要为药物剂型相同,但规格不同,其活性成分和非活性成分的比例与已进行过BE试验的规格相似的情况下,根据溶出试验和最大规格BE试验可以申请一个或多个较小规格的BE试验。在我们翻译的FDA《特定药物的生物等效性指导原则》中提出的可申请豁免其低规格窄治疗指数药物品种为卡马西平缓释胶囊、缓释片,双丙戊酸钠缓释片、迟释片,左甲状腺素片,苯妥英钠缓释胶囊(300mg规格),他克莫司缓释胶囊,丙戊酸胶囊、糖浆,华法林钠片等。此外,FDA《特定药物的生物等效性指导原则》明确提出以下窄治疗指数药物不适合申请豁免,包括卡马西平口服混悬液,双丙戊酸钠迟释微丸胶囊,苯妥英钠缓释胶囊(100mg规格),苯妥英咀嚼片及混悬液,丙戊酸胶囊等。 2.7 检测物质 FDA一般推荐测定原形药物,而不是代谢产物。原因是代谢产物的药-时曲线主要反映代谢物的生成、分布和消除,而原形药物的药-时曲线比代谢产物更灵敏地反映制剂的变化。FDA同时规定,如果由从原形药物产生的主要代谢产物满足以下两点,则可作为生物等效性试验的检测物质:代谢产物基本上产生于进入机体循环系统以前,如首过效应、肠壁细胞内、肠道内代谢等。代谢产物显著影响药物的安全性和有效性。表2中列出了FDA《特定药物的生物等效性指导原则》要求检测代谢物和其他非原形药检测物质的部分窄治疗指数药物品种。 2.8 参比制剂选择 参比制剂选择是生物等效性试验的关键点之一。为了避免由于参比制剂使用的不同而可能导致的各仿制品之间发生显著的差异,FDA对于参比制剂的选择很明确,在橙皮书的处方药及非处方药目录中,FDA规定了参比药品目录。在参比目录中对每个品种的参比药品都提供了明确的信息,并且提供了特定药厂和特定规格等信息。故此,在FDA《特定药物的生物等效性指导原则》中对参比制剂的信息未做重复描述。 3 结语 窄治疗指数药物的确定及生物等效性研究问题复杂,美国、欧盟、加拿大、日本等都国家及组织对NTI药物人体生物等效性试验的相关要求也有一定差异。目前,国内尚无专门的窄治疗指数药物目录及生物等效性研究指导原则,因此仿制药质量与疗效一致性评价工作中涉及窄治疗指数药物生物等效性研究需要更加深入的研讨。笔者就FDA关于窄治疗指数药物目录及生物等效性的体内试验作分析和介绍,希望对我国仿制药质量与疗效一致性评价工作的顺利开展提供借鉴和帮助。 参考文献(略)返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |