第五单元 化学方程式单元复习~(附单元思维导图) |
您所在的位置:网站首页 › 丙二酸化学方程式 › 第五单元 化学方程式单元复习~(附单元思维导图) |
第五单元 化学方程式单元复习~(附单元思维导图)
|
,今天大家分享第五单元化学方程式的内容,这一单元就要求各位同学能正确书写化学方程式了,主要查等号两边的每种原子个数使之相等,另外就是要能根据反应物、生成物的质量比关系进行简单方程式的计算~具体请看~~~ 【知识网络】
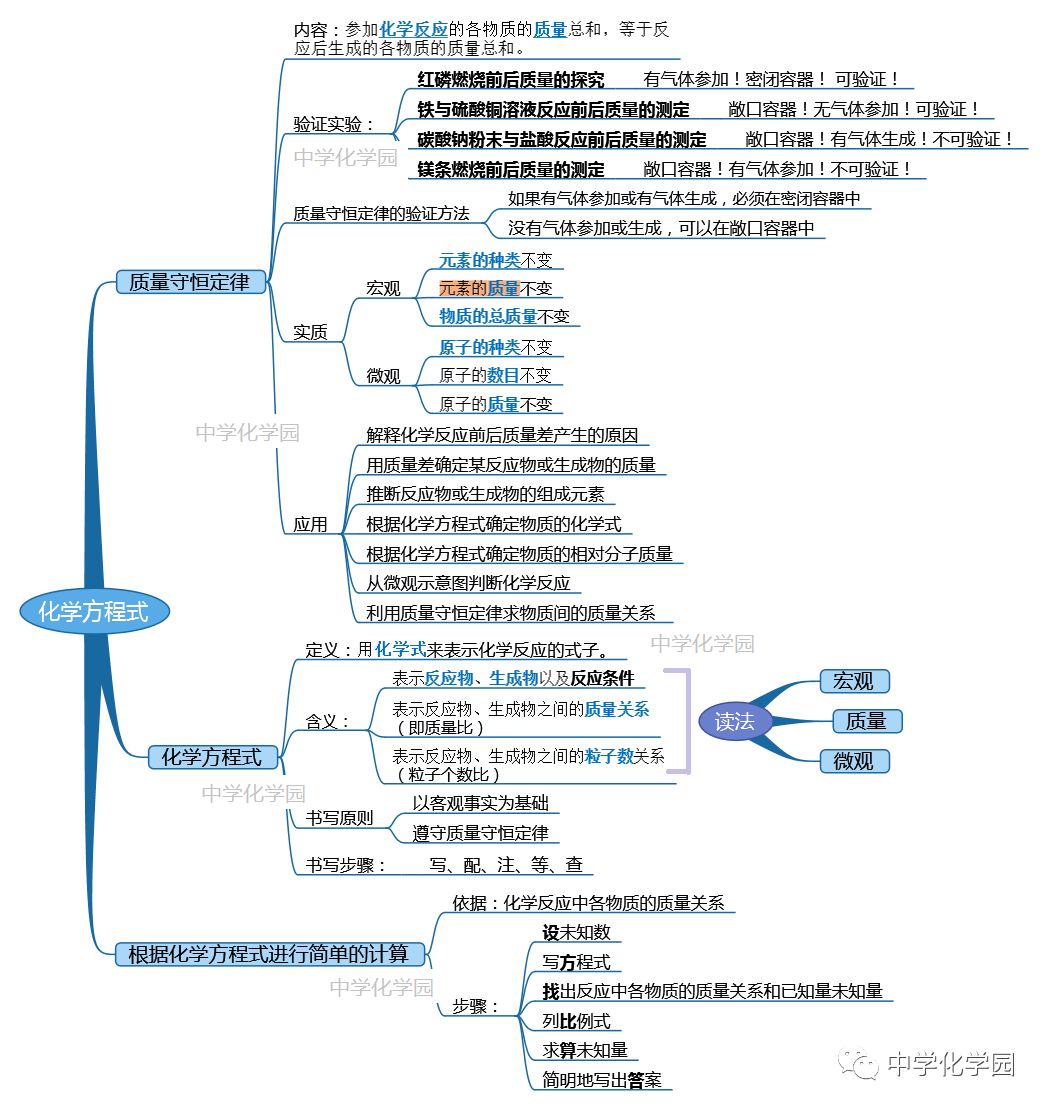
【典型习题】 一、质量守恒定律的实验验证和微观实质 1.下列叙述与质量守恒定律矛盾的是() ①参加反应各物质质量总和等于生成物的质量总和 ②铁在氧气中燃烧后,生成物的质量大于参加反应的铁的质量 ③高锰酸钾分解后,生成物二氧化锰的质量比高锰酸钾的质量小 ④3.2 克硫和3.2 克氧气化合,生成3.2 克二氧化硫 A.①④ B.②③ C.②③④ D.④ 2.参加反应的各物质质量总和等于反应后生成的各物质质量总和,是因为() A.反应后物质的种类没有变化 B.反应后元素的种类没有变化 C.反应后原子的种类、数目和质量没有变化 D.反应后分子的种类、数目和质量没有变化 3.下列叙述中正确的是() A.因为“质量守恒”,所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等 B.镁带在空气中燃烧后,生成物的质量比镁带的质量增加了 C.100 克酒精和100 克水混合在一起,质量等于200 克,符合质量守恒定律 D.氢气和氧气形成的混合物的质量等于其反应后生成水的质量 4.下列实验能够直接用于验证质量守恒定律的是()
由此可知,当有气体参加反应或有气体生成时,该反应必须在容器内进行才能验证质量守恒定律. 5.如图分别为甲乙两名同学验证质量守恒定律的装置,完成下列问题:
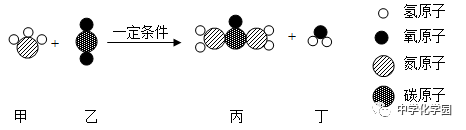
(1)若用乙图完成实验,将橡皮塞的玻璃管灼烧至红热后,迅速塞紧橡皮塞,之后观察到的现象是;白磷燃烧的化学方程式为; 实验中底部要铺一层细沙,作用是; 乙实验中玻璃管的作用是; (2)白磷燃烧结束后,冷却到室温,观察到天平,从而验证了化学反应前后,物质的总质量(填“不变”或“变”)。 (3)与甲相比,乙设计实验的优点有。 【答案】白磷燃烧产生大量白烟,气球先变大后变瘪;方程式略;防止锥形瓶底炸裂;引燃白磷,导气;仍然平衡;不变;密闭性好,有利于环保,胶塞不易弹出。 二、质量守恒定律的应用 【例题1】下列有关“守恒”的叙述中,正确的是( ) A.镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等 B.在反应3Cu+8HNO3═3Cu(NO3)2+2X↑+4H2O中的X的化学式是NO2 C.加热15.8gKMnO4,充分反应后,剩余固体的质量变为14.2g,则生成氧气1.6g D.某可燃物燃烧后生成的产物中有CO2、CO和SO2,则该物质一定含有碳、硫、氧元素 【答案】C【解析】C、加热15.8gKMnO4,充分反应后,剩余固体的质量变为14.2g,则生成氧气质量为:15.8g﹣14.2g=1.6g,该选项说法正确;故选:C. 【例题2】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。关于此反应下列认识不正确的是() 物质 甲 乙 丙 丁 反应前质量/g 1 20 15 2 反应后质量/g m 29 0 8 A.m 的值是1 B.甲可能是该反应的催化剂 C.该反应是分解反应D.反应中乙、丁的质量比是29:8 【例题3】(2016年广西省玉林市、防城港市)如图为甲和乙两种物质反应的微观示意图,下列说法错误的是( )
A.该反应不是化合反应 B.反应前后元素的种类没有发生改变 C.原子在化学变化中不可分 D.参加反应的甲和乙的分子个数比为1:1 【答案】D【解析】由反应的微观示意图可知该反应表示2NH3+CO2=CO(NH2)2+H2O, A.该反应的生成物是两种物质,不是化合反应,正确;B.由图可知,该反应过程中原子和种类及个数都没有发生变化,元素的种类也没有发生变化,正确;C.由微粒的变化可知,原子在化学变化中不可分,正确;D.由上图可知,参加反应的甲和乙的分子个数比为2:1,错误。 【练习】 1.有30 克高锰酸钾加热一段时间后,称得剩余固体的质量为27.5 克,则制得氧气的质量为() A.2.5 克B.3.2 克C.3.03 克D.9.6 克 2.铜片与浓硝酸可以发生如下反应:Cu+4HNO3=Cu(NO3)2+2X↑+2H2O对该反应的下列说法中正确的是( ) A.生成物X的化学式为H2 B.反应中N元素化合价改变的原子与N元素化合价不变的原子的个数比为1:1 C.浓硝酸属于纯净物 D.反应物Cu与生成物H2O的质量比为32:9 【答案】B. 3.请运用“守恒”的思想回答下列问题. (1)将24.5g氯酸钾跟6g二氧化锰混合后充分加热,冷却后称得剩余固体质量为20.9g,则生成氧气的质量为g; (2)飞船常利用反应2Na2O2+2CO2═2X+O2来提供氧气,根据推出X的化学式为Na2CO3. 【解析】(1)已知将24.5g氯酸钾跟6g二氧化锰混合后充分加热,冷却后称得剩余固体质量为20.9g,则生成氧气的质量=24.5g+6g﹣20.9g=9.6g;(2)答案为:(1)9.6;(2)化学反应前后原子的种类和数目不变. 4.为防止硝酸厂产生的氮氧化物污染环境,通常用NaOH 溶液吸收这些氮氧化物,反应的化学方程式为:NO+NOx+2NaOH=2NaNO2+H2O,方程式中x 的值是() A.1 B.2 C.3 D.任意值 5.火力发电厂的燃料主要是煤,煤燃烧排放的SO2、NO2 等污染物不仅污染空气,还会形成酸雨。湖南邵阳某发电厂处理NO2 的反应原理为CH4+2NO2=CO2+X+2H2O,则X 的化学式是( ) A.C B.N2 C.CO D.O2 6.(桂林)某纯净物M微热就能分解生成NH3、H2O 和CO2,由此还不能得出的结论是() A.M 不稳定B.M 是化合物C.M 中含有水D.M 由四种元素组成 7.将16gA和足量B混合加热,A与B发生化学反应,16gA完全反应后生成12gC和8gD,则参加反应的A与B的质量比是( ) A.1:1 B.2:1 C.3:1 D.4:1 【解析】16gA完全反应后生成12gC和8gD,由质量守恒定律可知,参加反应的B的质量为12g+8g﹣16g=4g,故参加反应的A和B的质量比是16g:4g=4:1.故选D. 8.在一个密闭容器内有M、N、X、Y 四种物质,在一定条件下反应一段时间后,测得反应前后各物质的质量如下: 物质 M N X Y 反应前质量/g 8 11 18 10 反应后质量/g 8 3 2 下列可能表示容器中化学变化的表达式是( ) A.X+Y=M+N B.X+Y=N C.N=M+X+Y D.X+Y+M=N 21.偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该化学方程式为C2H8N2+2N2O4═2X↑+3N2↑+4H2O↑,下列说法正确的是( ) A.X的化学式为CO B.偏二甲肼中碳的质量分数为40% C.该反应属于分解反应 D.生成N2和H2O的质量比为14:9 【答案】B. 三、化学方程式 1.人在剧烈运动后,血液中产生较多的乳酸(化学式为C3H6O3),使肌肉酸痛。由于乳酸与吸入的氧气反应而生成二氧化碳和水,使肌肉的酸痛感消失。表示此反应的化学方程式书写正确的是() A.C3H6O3+3O2=3CO2+3H2O B.C3H6O3+O2=CO2+H2O C.C3H6O3+3O2=CO2↑+3H2O D.2C3H6O3+6O2=6CO2+6H2O 2.ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。请回答下列问题: (1)ClO2的名称为; (2)据图所示写出制取ClO2的化学方程式为; 【答案】(1)二氧化氯(2)2NaClO2+Cl2=2NaCl+2ClO2 3.航天飞机用金属铝和高氯酸铵(NH4ClO4)的混合物体为固体燃料。加热铝粉使其被氧化放出大量的热,使混合物中的高氯酸铵分解,同时生成四种气体,两种是空气中的主要成分,一种气体是氯气,还有一种是常见的氧化物,因而产生巨大的推动力。试写出其中涉及到的化学方程式。 (1)铝粉被氧气氧化发生化合反应; (2)高氯酸铵受热分解。 【答案】(1)略(2)2NH4ClO4N2↑+2O2↑+Cl2↑+4H2O 四、利用化学方程式进行简单的计算
【变式1】用加热KMnO4的方法制取氧气,若需要制取2 瓶氧气(总质量为0.64g),则至少需要分解KMnO4的质量为克。 【变式2】含过氧化氢6.8 克的溶液,在二氧化锰的作用下,完全分解,求产生氧气的质量是多少克?(写过程) 【变式3】在实验室里,可用加热高锰酸钾的方法制取氧气。 ⑴写出高锰酸钾受热时发生分解反应的化学方程式; ⑵由高锰酸钾的化学式计算氧元素的质量分数时,计算式为:; ⑶如果158g 高锰酸钾受热时分解生成氧气的质量为x ,则生成氧气的比例式为。 ⑷已知158g 高锰酸钾中含有氧元素的质量为64g,如果加热分解158g 高锰酸钾,生成氧气的质量 为(选填“大于”、“小于”或“等于”)64g。 ~返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |