《自然》子刊:最火抗衰老“神药”或促癌?科学研究发现,补充NAD+会促进衰老细胞的分泌表现,刺激癌细胞生长 |
您所在的位置:网站首页 › 不老神药nad › 《自然》子刊:最火抗衰老“神药”或促癌?科学研究发现,补充NAD+会促进衰老细胞的分泌表现,刺激癌细胞生长 |
《自然》子刊:最火抗衰老“神药”或促癌?科学研究发现,补充NAD+会促进衰老细胞的分泌表现,刺激癌细胞生长
|
《自然》子刊:最火抗衰老“神药”或促癌?科学研究发现,补充NAD+会促进衰老细胞的分泌表现,刺激癌细胞生长
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。 长生不老这个愿望,自古就萦绕在人们心头。雄才大略如秦皇汉武,也都为这事交了不少“智商税”。 目前的“不老药”,除了梅奥诊所的一系列衰老细胞清除剂外,最火热的恐怕就是各种NAD+的补充剂了。像澳洲某S开头的“抗衰老神药”,在某宝上都要600大洋一瓶了。 不过这东西乱吃也是可能出事的。近日,美国Wistar研究所的Timothy Nacarelli和Rugang Zhang等研究发现,NAD+代谢控制了衰老细胞的促炎分泌,补充NAD+有可能会促进衰老细胞分泌炎性因子,刺激肿瘤细胞生长。相关研究发表在Nature Cell Biology上[1]。
NAD+全称烟酰胺腺嘌呤二核苷酸,是人体内一种重要的辅酶,也是跟衰老关系密切的一种物质。在衰老的小鼠和秀丽隐杆线虫中,NAD+的水平都下降了[2],人体试验中也有类似发现[3]。这也让科学家们想到,或许补充NAD+是一种对抗衰老的有效方法。 确实,在酵母、线虫、果蝇和小鼠的试验中,补充NAD+前体物质烟酰胺单核苷酸(NMN)或烟酰胺核糖(NR),延缓了这些试验动物的衰老,延长了它们的寿命[4-7]。相关的人体试验也在进行中[8]。 这些动物试验的结果,让各种NAD+补充剂纷纷打着抗衰老的旗号,以保健品或营养补充剂的名义进入了市场。但相关的临床研究,却只有一些小规模、短期的安全性证据[9]。而且,肿瘤组织中,NAD+的生物合成也经常会上调[10],这又让补充NAD+蒙上了一层致癌的疑云。
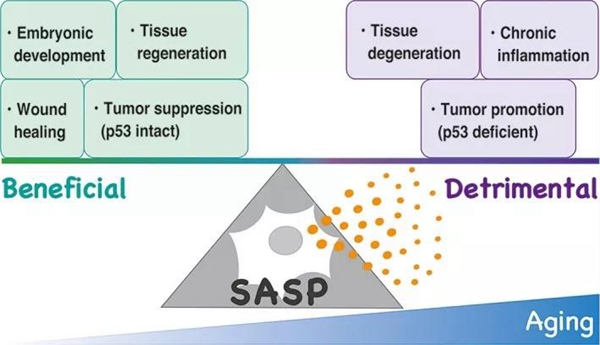
细胞衰老这个机制,本身就有防癌的意义[11]。当细胞在不断的复制分裂后,染色体两端的端粒不断缩短,直到不能再保护染色体时,就会失去增殖分裂能力,进入衰老的状态,被称为复制衰老(RS)[12]。这一方面避免了细胞的无限增殖,另一方面也规避了失去端粒保护的DNA在复制中产生大量突变。 此外,一些癌基因的激活,也会导致细胞衰老(被称为癌基因诱导的衰老,OIS),避免其进一步发展成恶性肿瘤[13]。 不过,人体中这个衰老防癌的机制也不是十分完善。衰老的细胞虽说自己一般不能癌变了(有少数衰老了的细胞能“渡劫”成功),却还会分泌各种炎性细胞因子、生长因子和蛋白酶,促进癌症发展,被称为衰老相关分泌表型(SASP)[14]。
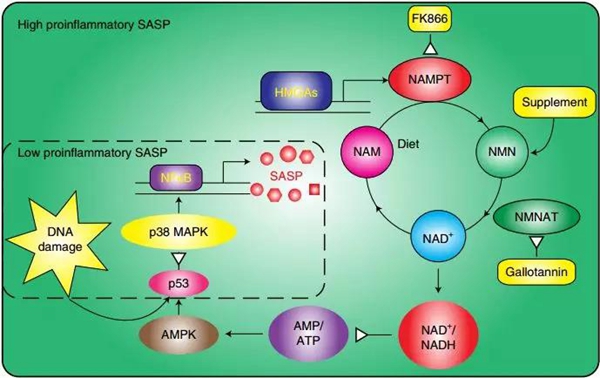
在细胞衰老的过程中,一种叫做HMGA的蛋白起了关键作用[15],不过在肿瘤中,HMGA也经常高表达,还跟预后不良有关[16]。或许,HMGA就是调控SASP的关键。研究人员对其中的机制进行了研究。 HMGA是一种DNA结合蛋白,可增强它所结合的基因的表达。研究人员通过激活癌基因Ras诱导了细胞衰老,然后对HMGA所结合DNA片段进行测序。研究人员发现,在细胞衰老的过程中,HMGA的靶基因是烟酰胺磷酸核糖转移酶(NAMPT)。在OIS细胞中,研究人员也确实发现了NAMPT的表达上调。而这个NAMPT,正是人体中,NAD+补救合成的一个关键限速酶。 而且,研究人员发现,衰老细胞中,NAMPT的上调,与各种促炎因子表达的上调是同步的。而敲降或抑制NAMPT,都可以抑制促炎SASP。正是NAMPT促进了衰老细胞分泌各种炎性因子!
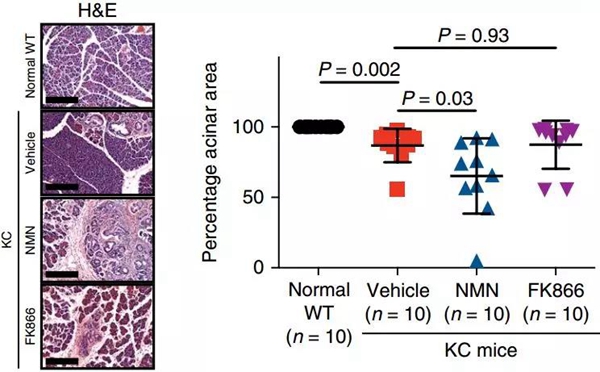
NAD+相关的代谢途径 考虑到NAMPT在NAD+补救合成中的作用,研究人员猜测,NAMPT是通过提高衰老细胞中的NAD+水平,来促进SASP的。 研究人员发现,在OIS细胞中,NAD+/NADH比值和NAD+水平都升高了,但如果抑制了NAMPT,它们又都会减低。而向培养基中添加NAD+前体物质NMN,则可以恢复抑制NAMPT引起的NAD+/NADH比值和NAD+水平降低,解除对SASP的抑制。 为进一步验证衰老细胞、NAD+代谢和肿瘤之间的关系,研究人员把OIS细胞和癌细胞放在一起进行了共培养。OIS细胞的存在大大刺激了癌细胞的生长,而这种生长刺激作用,可以通过抑制NAMPT而抑制。 而在自发性胰腺癌小鼠模型中,补充NMN也导致了胰腺中炎性因子和免疫细胞浸润增加,正常腺泡面积减少,癌前病变和恶性病变增加。 补充NMN增强了胰腺中的炎性环境,促进了胰腺癌的发展!
补充NMN降低了正常腺泡的面积,FK866是NAMPT的抑制剂 论文通讯作者Rugang Zhang表示:“我们的数据显示,NAD+水平影响衰老细胞的分泌活动,可能会促进肿瘤的进展。有充分的证据表明,细胞NAD+浓度在衰老过程中下降,NAD+补充剂可能能预防衰老和年龄相关疾病。我们的研究结果可能对这一研究领域产生深远影响。” 想要补充NAD+抗衰老,还是等相关临床研究的结果出来,确定好补充剂量再说吧。要是真吃出了癌症,可就是得不偿失了。 参考文献: 1. NACARELLI T, LAU L, FUKUMOTO T, et al. NAD+ metabolism governs the proinflammatory senescence-associated secretome[J]. Nature Cell Biology, 201. 2. Mouchiroud L, Houtkooper R H, Moullan N, et al. The NAD+/sirtuin pathway modulates longevity through activation of mitochondrial UPR and FOXO signaling[J]. Cell, 2013, 154(2): 430-441. 3. Zhu X H, Lu M, Lee B Y, et al. In vivo NAD assay reveals the intracellular NAD contents and redox state in healthy human brain and their age dependences[J]. Proceedings of the National Academy of Sciences, 2015, 112(9): 2876-2881. 4. Belenky P, Racette F G, Bogan K L, et al. Nicotinamide riboside promotes Sir2 silencing and extends lifespan via Nrk and Urh1/Pnp1/Meu1 pathways to NAD+[J]. Cell, 2007, 129(3): 473-484. 5. Fang E F, Kassahun H, Croteau D L, et al. NAD+ replenishment improves lifespan and healthspan in ataxia telangiectasia models via mitophagy and DNA repair[J]. Cell metabolism, 2016, 24(4): 566-581. 6. Balan V, Miller G S, Kaplun L, et al. Life span extension and neuronal cell protection by Drosophila nicotinamidase[J]. Journal of Biological Chemistry, 2008, 283(41): 27810-27819. 7. Yoshino J, Mills K F, Yoon M J, et al. Nicotinamide mononucleotide, a key NAD+ intermediate, treats the pathophysiology of diet-and age-induced diabetes in mice[J]. Cell metabolism, 2011, 14(4): 528-536. 8. Tsubota K. The first human clinical study for NMN has started in Japan[J]. 2016. 9. MARTENS C R, DENMAN B A, MAZZO M R, et al. Chronic nicotinamide riboside supplementation is well-tolerated and elevates NAD(+) in healthy middle-aged and older adults[J]. Nat Commun, 2018, 9(1): 1286. 10. Garten A, Schuster S, Penke M, et al. Physiological and pathophysiological roles of NAMPT and NAD metabolism[J]. Nature Reviews Endocrinology, 2015, 11(9): 535. 11. Sager R. Senescence as a mode of tumor suppression[J]. Environmental health perspectives, 1991, 93: 59-62. 12. Hayflick L, Moorhead P S. The serial cultivation of human diploid cell strains[J]. Experimental cell research, 1961, 25(3): 585-621. 13. Campisi J. Aging, cellular senescence, and cancer[J]. Annual review of physiology, 2013, 75: 685-705. 14. Coppé J P, Patil C K, Rodier F, et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor[J]. PLoS biology, 2008, 6(12): e301. 15. Narita M, Narita M, Krizhanovsky V, et al. A novel role for high-mobility group a proteins in cellular senescence and heterochromatin formation[J]. Cell, 2006, 126(3): 503-514. 16. Sumter T F, Xian L, Huso T, et al. The high mobility group A1 (HMGA1) transcriptome in cancer and development[J]. Current molecular medicine, 2016, 16(4): 353-393. 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】
今日新闻 |
推荐新闻 |