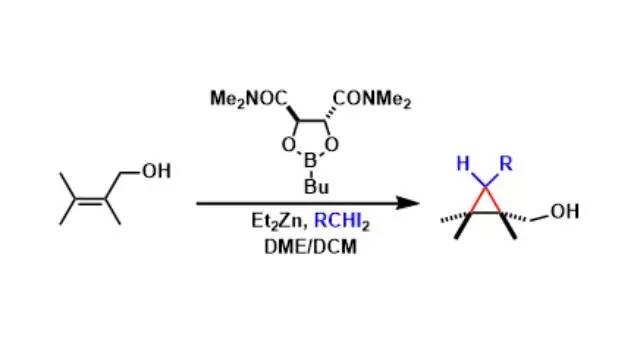
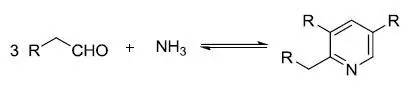
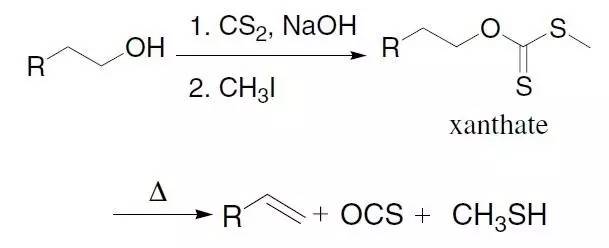
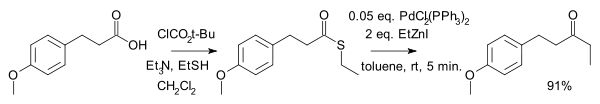
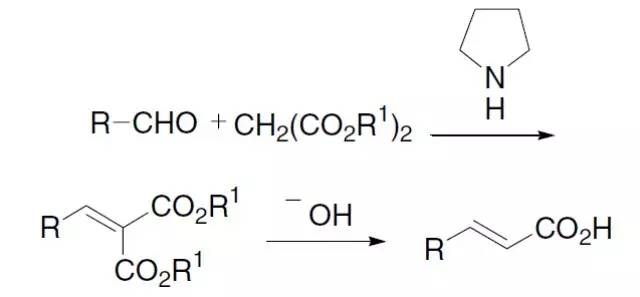
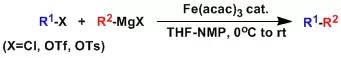
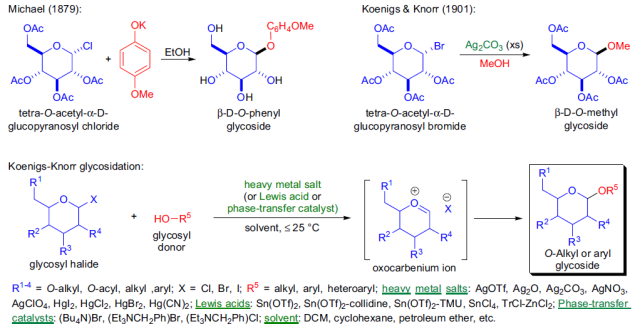
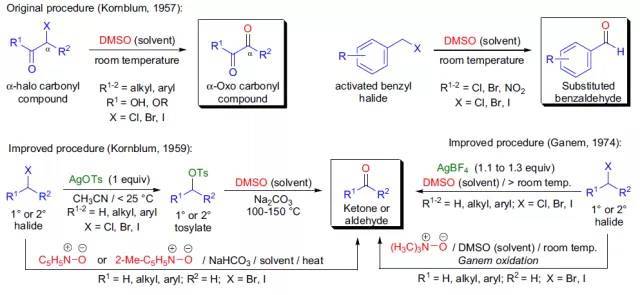
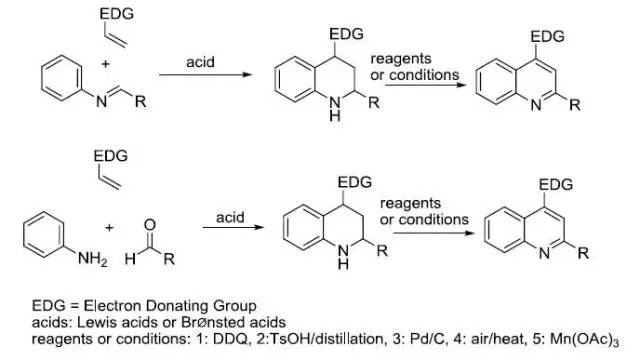
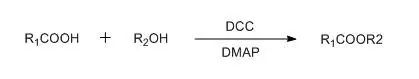
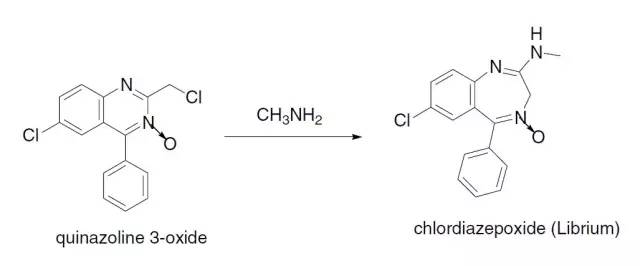
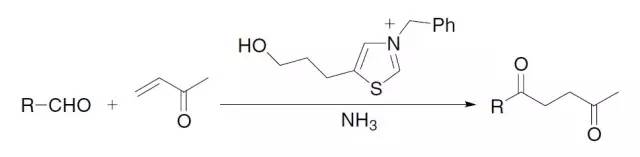
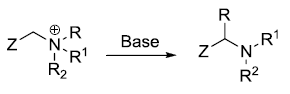
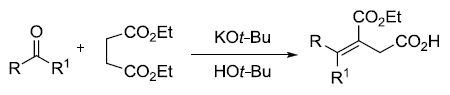
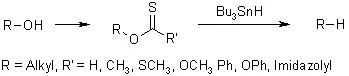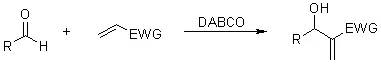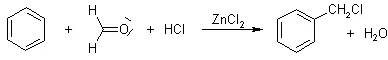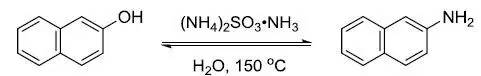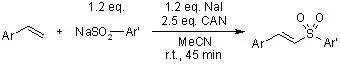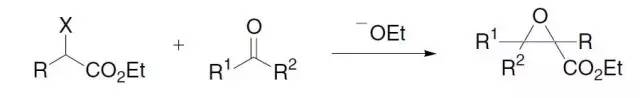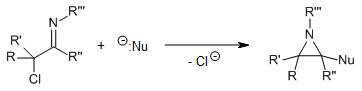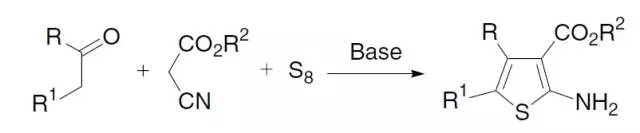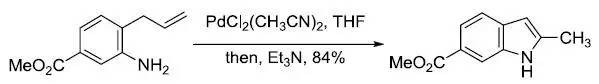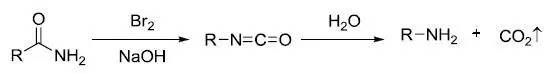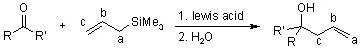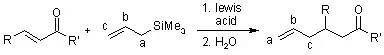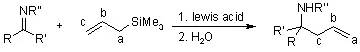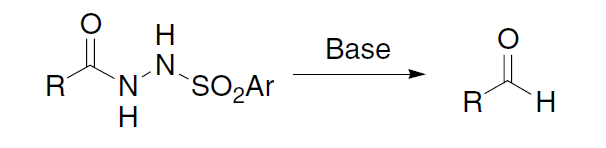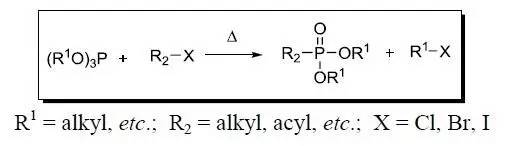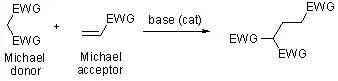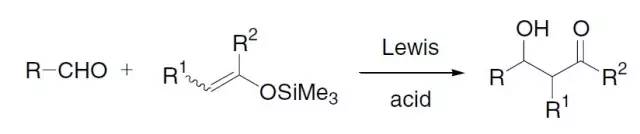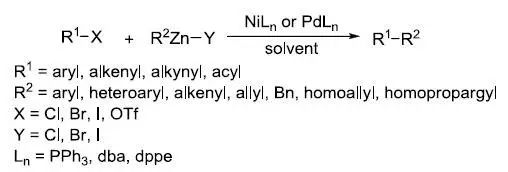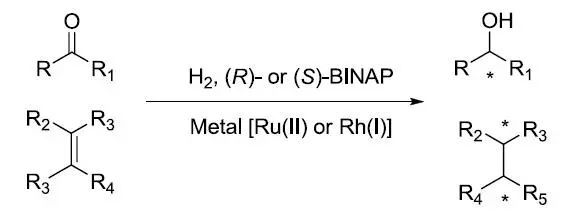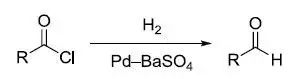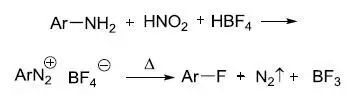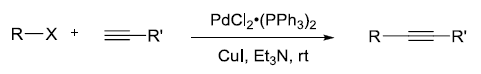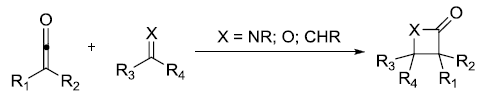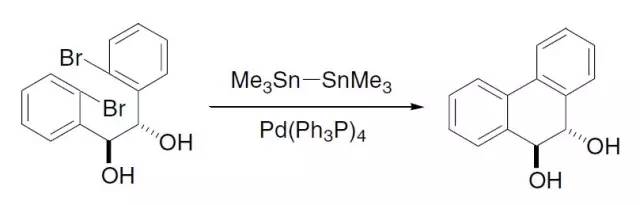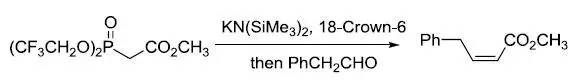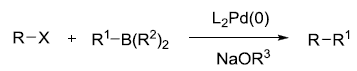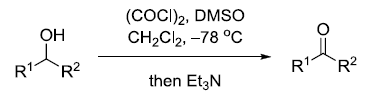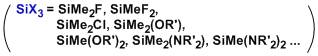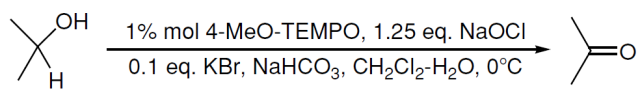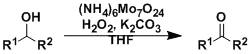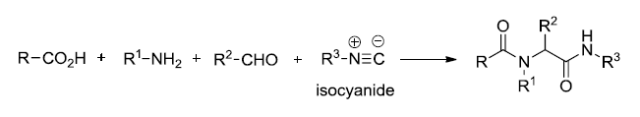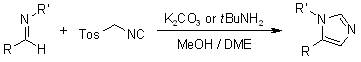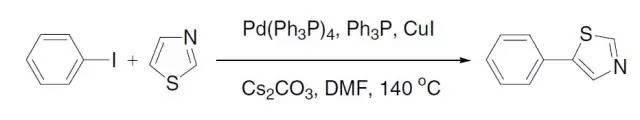人名反应及常见反应(全) |
您所在的位置:网站首页 › 丁二酰亚胺为什么是亚胺 › 人名反应及常见反应(全) |
人名反应及常见反应(全)
|
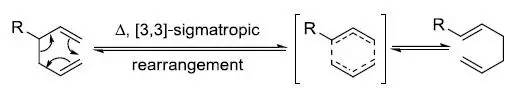
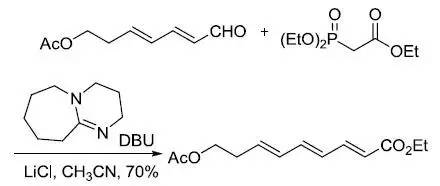
[2,3]-Wittig重排
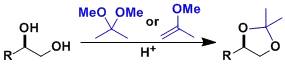
1,2-1,3-二元醇的保护Protection of 1,2-1,3-diol
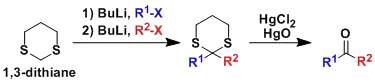
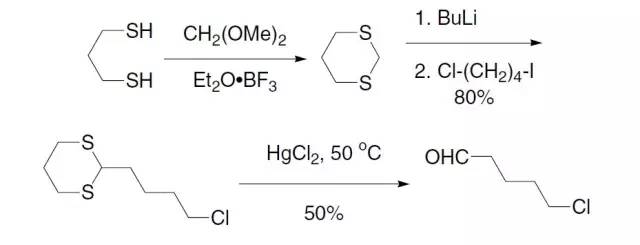
一般我们会把1,2-二醇或是1,3-二醇很容易的变成五元环或是六元环的形态从而把它们保护起来。 1,3-二噻烷1,3-Dithiane
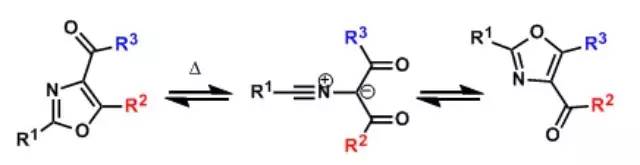
1,3-偶极环加成反应(1,3-DipolarCycloaddition)
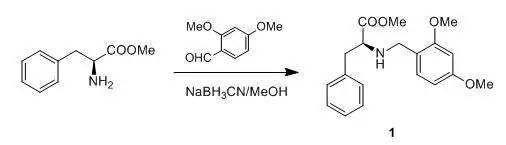
2,4-二甲氧基苄基保护胺基
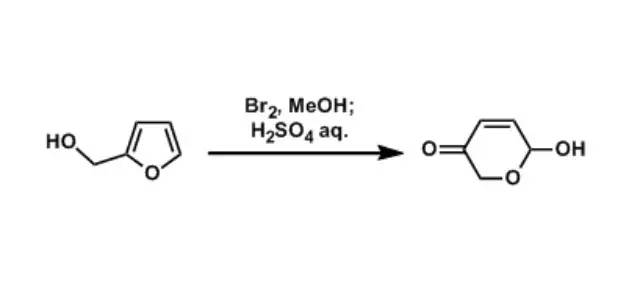
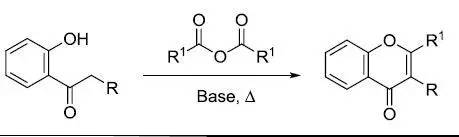
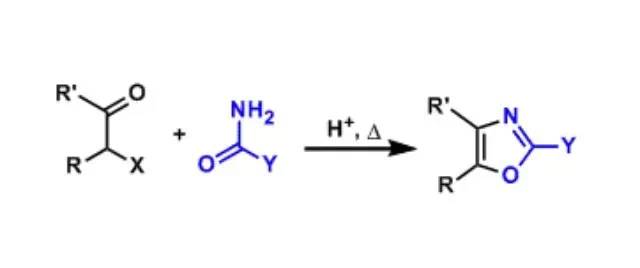
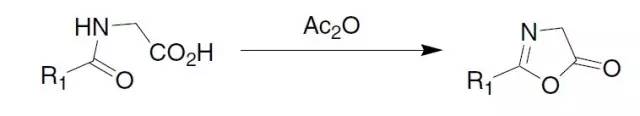
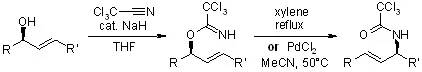
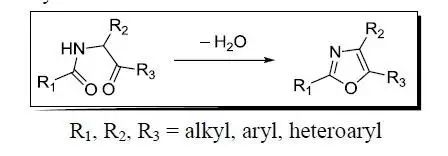
Achmatowicz反应(AchmatowiczReaction)
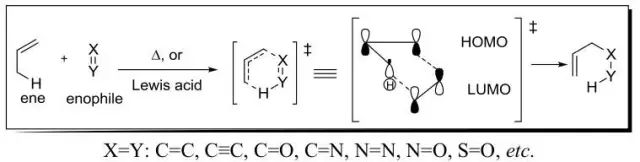
Alder烯反应
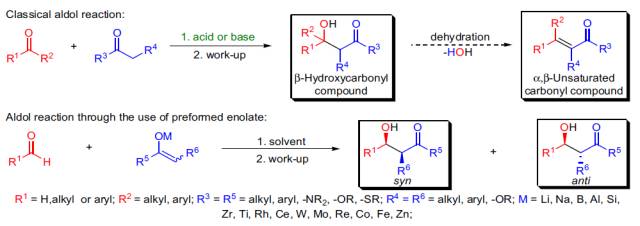
Aldol-交叉羟醛缩合反应CrossAldol Reaction
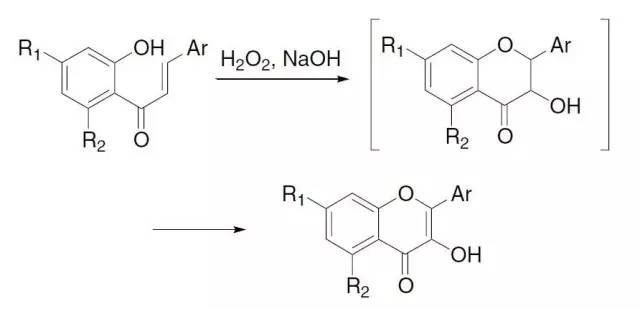
Algar-Flynn-Oyamada氧化反应
在碱和双氧水存在下,将2’-羟基查尔酮(2’-hydroxychalcones)转化为2-芳基-3-羟基-4H-1苯并呋喃-4-酮(黄酮醇,flavonols)。
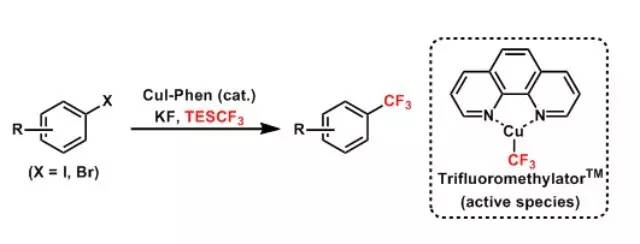
在碱性条件下邻羟基芳基酮和芳基甲酸酐反应制备黄酮和异黄酮的反应。反应机理和Kostanecki 类似。 Amadori重排反应 酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。 Amii三氟甲基化(AmiiTrifluoromethylation)
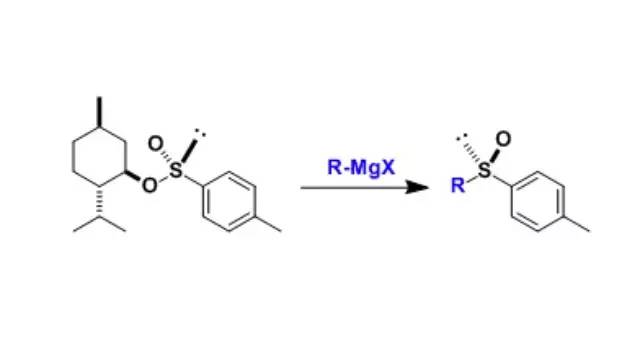
薄荷亚砜在烷基锂或者Grignard试剂的作用下,得到手性亚砜的合成手法。 Appel反应 三苯基膦,四卤化碳 (CCl4, CBr4) 与醇在温和的条件下转化为相应结构的卤代烷烃被称为appel反应。此反应的产率一般会很高。 Arndt–Eistert同系化反应
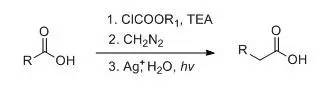
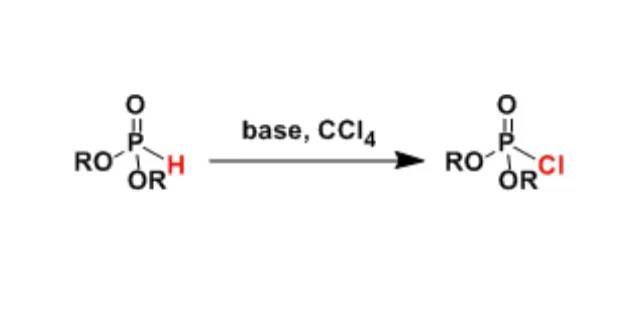
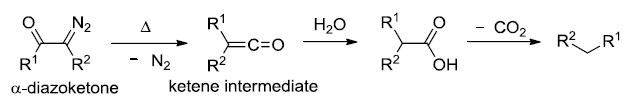
羧酸经过重氮甲烷处理得到多一个碳的同系物的反应。 Atherton-Todd反应(Atherton-ToddReaction)
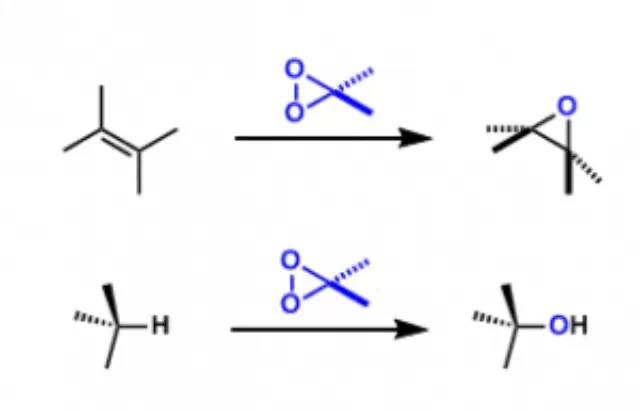
Baeyer–Villiger氧化 过氧化物氧化醛酮得到酯的反应。 Baker-Venkataraman重排 碱催化下邻酰氧基芳基酮重排得到相应的芳基β-二酮的反应被称为Baker-Venkataraman重排
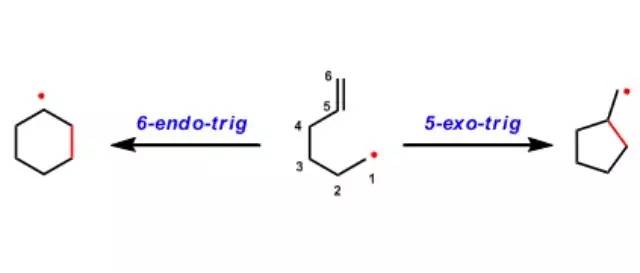
分子内关环反应的难易程度与关环部位的轨道相互作用息息相关。Baldwin法则就是用来总结这些规律的一个法则。同时该法则可适用范围很广,包括亲核、亲电、自由基环化反应。
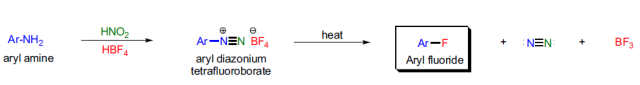
四氟硼酸盐的芳香重氮盐(ArN2+BF4-)热分解得到芳香氟化物的反应称为Balz-Schiemann反应 Bamberger重排
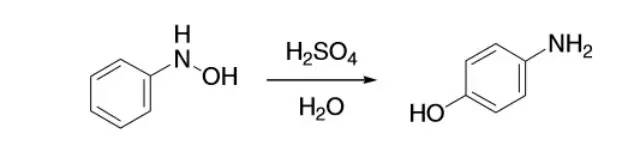
N-苯基羟胺在酸作用下重排为4-氨基苯酚的反应。 BAMFORD-STEVENS-SHAPIRO烯化反应
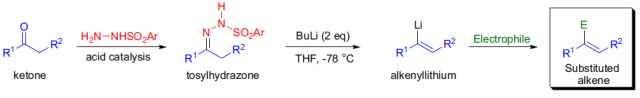
在碱催化下醛酮的苯磺酰基腙分解生成烯的反应称为Bamford-Stevens反应。当使用有机锂作为碱时发生的反应被叫做Shapiro反应。 Baran试剂
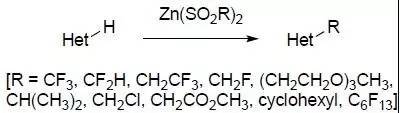
Baran试剂,二烷基亚磺酸锌盐,可以直接对杂环芳烃C-H键进行官能团化。现在很多Baran试剂都可以买到。 Barbier反应 在有机金属试剂存在下,羰基化合物可以迅速与其反应,这类反应被称为Barbier反应。 Bargellini反应
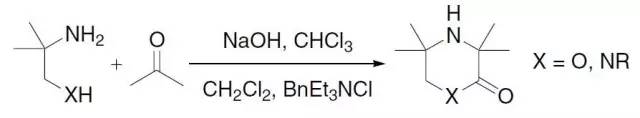
由酮(如丙酮)和2-氨基-2-甲基-1-丙醇或1,2-二氨基丙烷在氯仿和氢氧化钠存在下反应制备取代吗啡啉酮或哌啶酮的反应。 Barluenga试剂(Barluenga’sReagent)
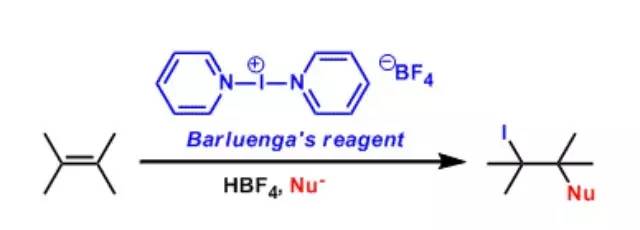
bis(pyridine)iodonium(I) tetrafluoroborate俗称Barluenga试剂,该试剂被用作亲电子碘化试剂,在亲电碘化反应中经常被用到。该试剂可以通过在负载于硅胶上的四氟硼酸银条件下,以碘与吡啶作为底物反应制备而成 Bartoli吲哚合成反应 由邻取代硝基苯和乙烯基格氏试剂制备7-取代吲哚的反应。该方法常用于制备7位取代的吲哚类衍生物。
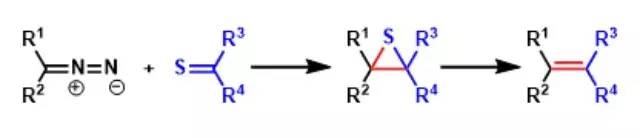
重氮化合物与硫酮反应得到多取代烯烃的合成手法。 Barton-McCombie脱羟基反应
将醇转化为硫代羰基中间体,然后自由基断裂得到醇的脱羟基产物的反应。 Barton-Zard吡咯合成法(Barton-ZardPyrrole Synthesis)
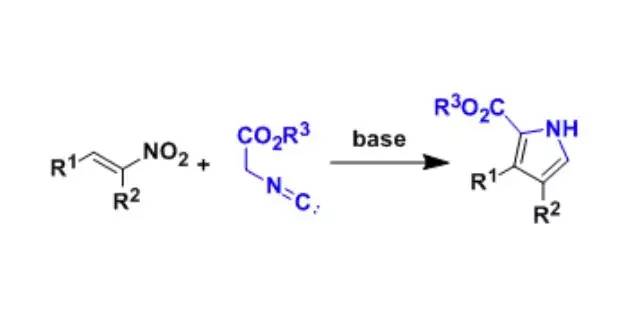
通过硝基烯烃与α-异腈酸酯之间的所和反应得到吡咯环衍生物的手法。
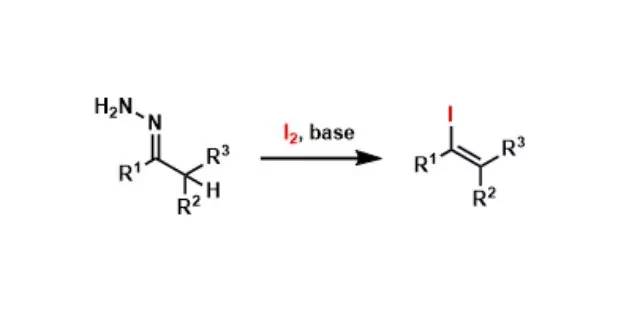
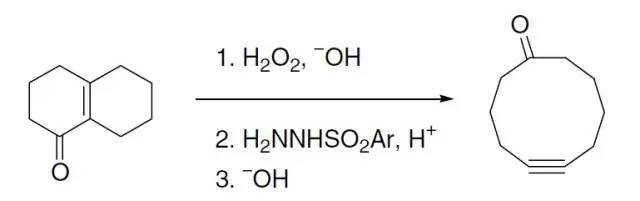
该反应常被称为Hydrazone iodination反应。
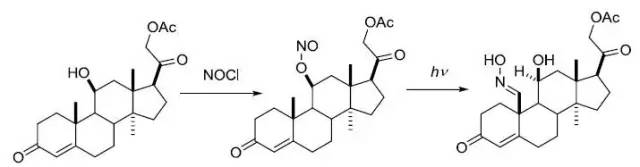
光解亚硝酸酯得到δ-肟醇的反应。
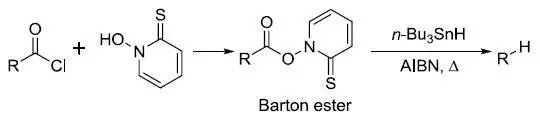
羧酸转化为Barton酯,然后进行自由基脱羧的反应。 Batcho–Leimgruber吲哚合成反应
邻硝基甲苯类化合物和甲酰胺缩醛(如DMFDMA)缩合得到trans-β-二烷基胺基-2-硝基苯乙烯,接着还原得到吲哚类化合物的反应。 Baylis-Hillman反应
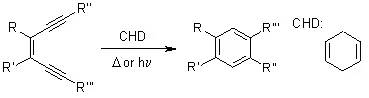
活性烯烃和醛在三级胺(如 DABCO = 1,4-Diazabicyclo[2.2.2]octane)的催化下发生的偶联反应被称为Baylis-Hillman 反应。 BBr3裂解醚反应 BBr3是一种温和、优良的醚的去甲基化试剂,并且不影响分子中的酯基和双键,在许多天然产物的全合成中常使用它。一般使用CH2Cl2, benzene, pentane作为溶剂,在-78 ℃到室温下进行。有一点需注意,当底物分子中杂原子数多时,应增加BBr3量。使用BBr3有一个最大的缺点是BBr3对空气敏感,使用时会冒出大量气雾;并在加水后处理时常出现大量的络合物,此时最好使用其它的方法,否则后处理艰难并导致收率下降。BI3, BCl3的使用如同BBr3。 肟在酸催化下重排得到酰胺的反应。 Beirut反应 在碱性条件下由苯并呋咱氧化物制备喹喔啉-1,4-二氧化物的反应。 Benzoin安息香缩合(安息香Condensation) 氰基催化芳香甲醛缩合得到安息香类物的反应。 Bergman芳环化反应
烯二炔类化合物在H• 供体(如1,4-环己二烯)存在下通过热或光诱导环化构建取代苯环的反应。
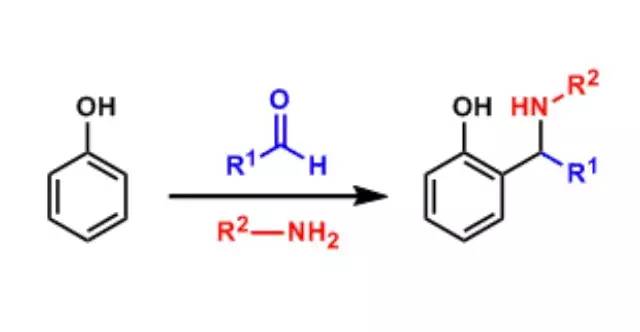
酚与芳香醛和伯胺作用得到 α-氨基苯甲酚类。这个反应可以视为苯酚的Mannich反应。 Biginelli反应
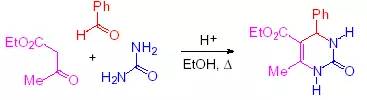
此反应是酸催化的三组分反应,醛,ß-酮酯和脲反应生成二氢嘧啶酮。二氢嘧啶酮是一种非常有用的医药中间体。
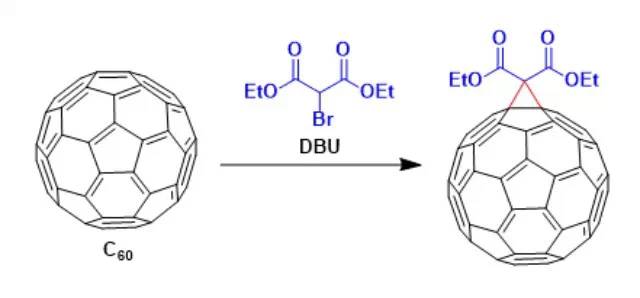
C60 与溴代丙二酸酯在碱(如氢化钠、DBU)存在下加成为单一的 6-6 闭环产物的反应。 Birch还原反应
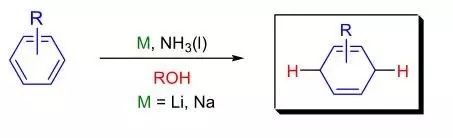
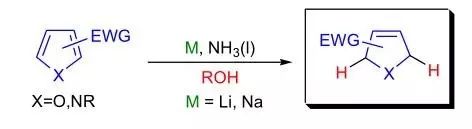
芳香环通过碱金属(Li, Na, K)液氨溶液在醇存在下进行1,4-位还原得到非共轭的环己二烯或其他不饱和杂环的反应被称为Birch还原反应。 Bischler–Möhlau吲哚合成反应
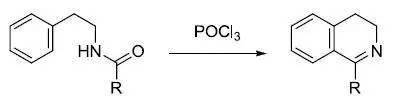
α-芳胺基酮和过量的芳香胺环化得到2-芳基吲哚的反应。 Bischler–Napieralski反应, Bischler-Napieralski异喹啉合成反应
β-苯乙胺在三氯氧磷中回流得到二氢喹啉的反应。
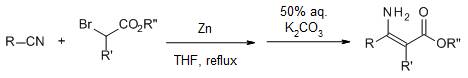
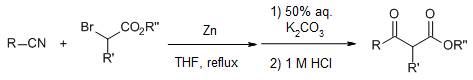
α-卤代酯先和锌反应得到有机锌中间体,接着和腈反应得到β-烯胺酯或β-酮酯(两个产物和后处理的条件有关)的反应。 Blanc反应
此反应和Friedel-Crafts烷基化反应类似,由芳烃和醛,在HCl和ZnCl2存在下反应得到氯甲基芳烃(如基于聚苯乙烯的Merrifield树脂的合成) Blanc环化(BlancCyclization)
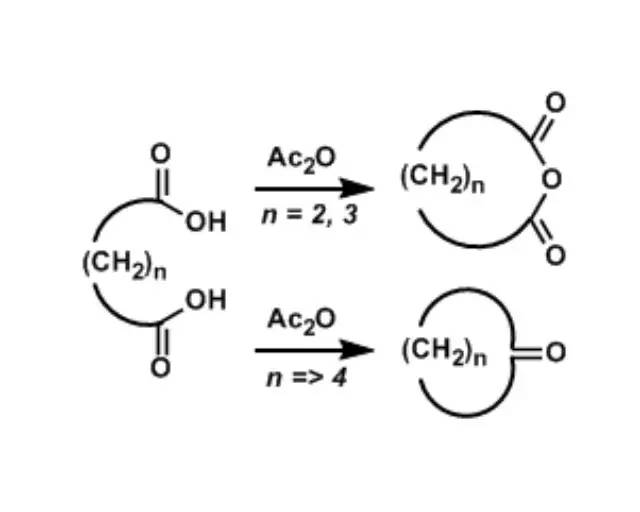
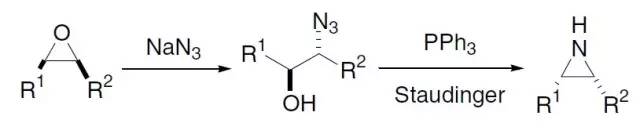
二羧酸在无水醋酸酐的作用下加热,进行环化的反应。 Blum–Ittah氮杂环丙烷合成反应
通过叠氮化钠将环氧化合物开环,经过三苯基膦还原叠氮醇中间体得到氮杂环丙烷的反应。 Bode多肽合成(Bode Peptide Synthesis)
α-酮酸与羟基胺混合得到肽键(酰胺)的反应。 Boekelheide反应
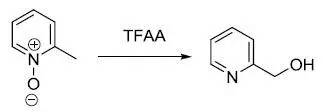
2-甲基吡啶氮氧化物用三氟乙酸酐或乙酸酐处理得到2-羟甲基吡啶的反应。 Boger吡啶合成反应
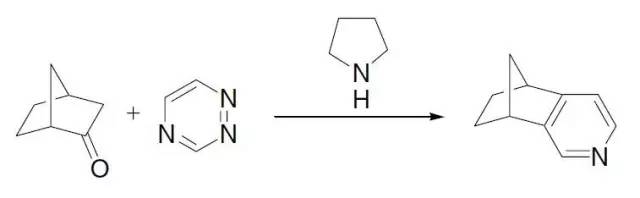
1,2,4-三氮唑和亲二烯体(如烯胺)通过杂原子D-A加成脱去N2得到吡啶的反应。 Borch还原胺化反应 胺和羰基化合物缩合得到亚胺,然后通过还原剂(常用的有NaCNBH3,NaBH(OAc)3 等)还原生成相应的胺的反应。 Borsche–Drechsel环化反应
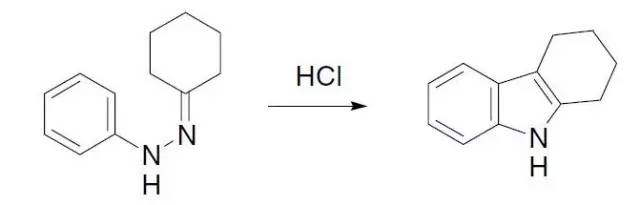
由环己酮苯腙在酸性条件下制备四氢咔唑的反应。反应机理同Fisher吲哚合成反应。 Boulton–Katritzky重排
加热条件下五元杂环重排和与其相连的三原子链重新生成新的五元环的反应。 Bouveault醛合成反应
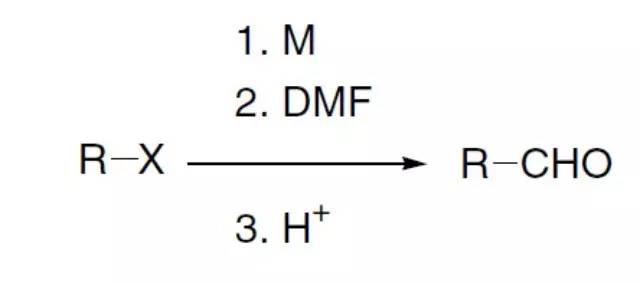
烷基或芳基卤代烃通过金属(M = Li,Mg, Na, and K)化与DMF加成,得到相应的醛的反应。 Boyer-Schmidt-Aube重排(Boyer-Schmidt-Aube Rearrangement)
叠氮与羰基化合物在路易斯酸的存在家发生重排,最终形成相同碳数酰胺的反应。
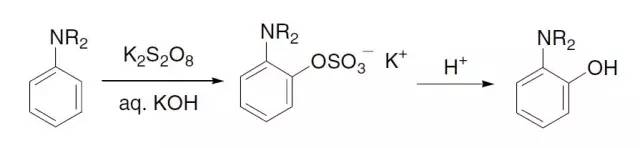
利用过硫酸钾氧化苯胺在邻位引入酚羟基的反应。 Bradsher反应
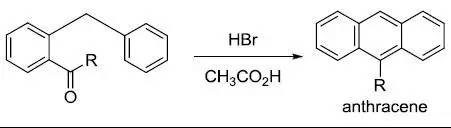
分子内的Bradsher环化反应是指在酸催化下邻酰基二芳基甲烷进行芳香环化脱氢生成蒽的反应。 Bredereck噁唑合成法(BredereckOxazole Synthesis)
α-卤代酮与甲酰胺(或脲)合成噁唑的手法。用硫代酰胺代替甲酰胺,可以得到噻唑类产物。 Bredereck试剂
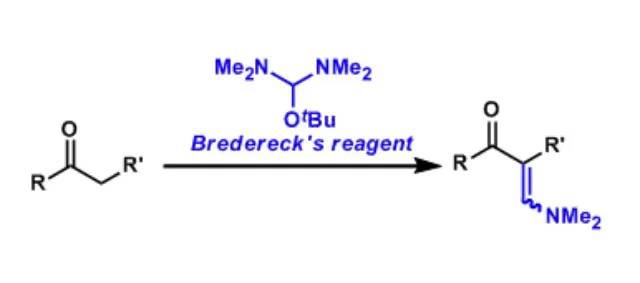
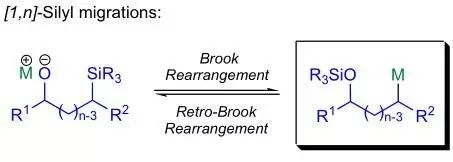
tert-Butoxy-bis(dimethylamino)methane通常被叫做Bredereck试剂、该试剂用于羰基的α-烯次甲基胺基化反应。 Brook重排反应
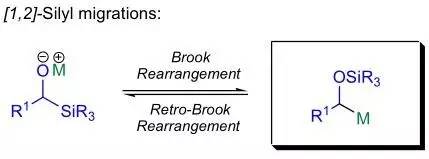
该反应是1958年加拿大的化学家Brook发现报道的。α-硅基氧负离子通过生成一个五配位硅中间体重排得到α-硅氧基碳负离子的反应称为[1,2]-Brook重排,或[1,2]-硅基迁移。后来发现此类硅迁移反应普遍存在,因此[1,n]-硅基由碳原子迁移到氧原子的反应统称为Brook重排。 Brown硼氢化氧化反应 硼烷对烯烃进行协同顺式加成得到有机硼加成产物,然后在碱性条件下氧化得到醇的反应。
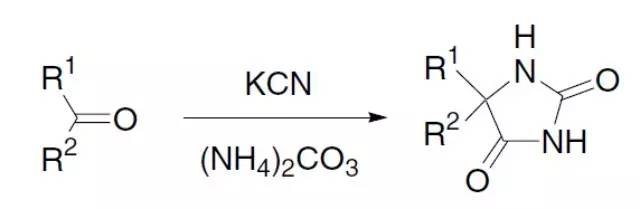
由羰基化合物、氰化钾(KCN)和碳酸铵[(NH4)2CO3]或者氰醇和碳酸铵制备乙内酰脲的反应被称为Bucherer–Bergs反应。此反应属于多组分反应(MCR)。 Bucherer反应
利用亚硫酸铵将β-萘酚转化为β-萘胺的反应。 Büchner扩环反应
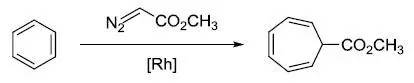
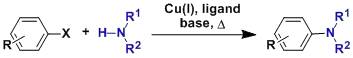
苯环在铑催化剂催化下和重氮乙酸酯反应得到环庚-2,4,6-三烯甲酸酯的反应 Buchwald_Hartwig反应 Buchwald–Hartwig芳胺化反应是非常常用的由芳基卤代物或芳基磺酸酯制备芳胺的反应。 Burgess试剂 Burgess试剂,即N-(三乙基铵磺酰)氨基甲酸甲酯,是一个氨基甲酸酯类的内盐,用作有机化学中的脱水剂。 Burke硼酸试剂
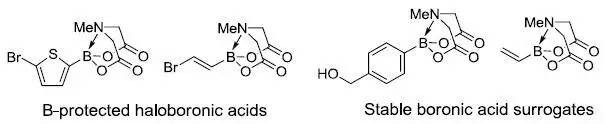
硼保护的卤代硼酸类Burke硼酸试剂在迭代交叉偶联反应中用很广的应用。 Burton三氟甲基化(BurtonTrifluoromethylation)
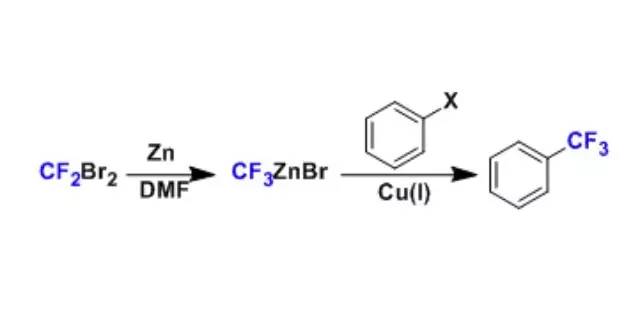
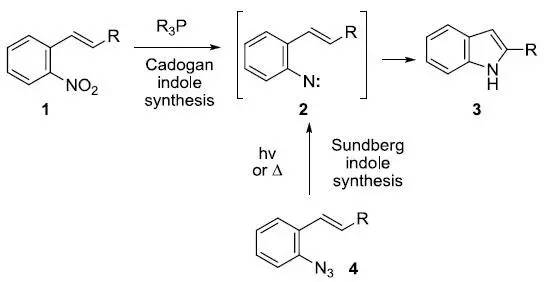
该反应是用于在芳香环上导入三氟甲基。 端基炔通过与一价铜反应生成炔铜化合物,然后和炔基卤化物反应生成非对称性二炔的反应。 Cadogan–Sundberg吲哚合成
Cadogan反应是指邻硝基苯乙烯1或邻硝基芪类化合物和亚磷酸三酯或三烷基膦反应生成氮宾2,接着环化生成吲哚3的反应。 Camps喹啉合成(CampsQuinoline Synthesis)
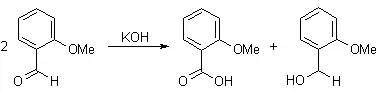
邻酰氨基苯乙酮在氢氧化钠的醇溶液存在下发生环化,生成羟基喹啉的反应。 Cannizzaro反应
在浓碱条件下,不能进行烯醇化异构的醛发生氧化还原歧化反应得到相应的醇和酸的反应。 CAN制备芳基砜
CAN,硝酸铈铵,Cerium (IV) ammonium nitrate ((NH4)2Ce(NO3)6),是一种单电子强氧化剂,可用于亲电自由基对烯烃的氧化加成反应。 Carroll重排
此反应是克莱森重排反应的变体,β- 酮酸烯丙酯通过阴离子辅助克莱森重排后脱羰基得到γ,δ- 不饱和酮的反应。 Castro–Stephens偶联反应(Castro-Stephens Coupling) 炔化亚铜与芳卤发生交叉偶联,生成二取代炔及卤化亚铜。 Catellani 反应(CatellaniReaction)
Catellani反应是多组分(3-component reaction)偶联反应中的一种。该反应中,在降冰片烯(Norbornene)与Pd共同催化作用下,首先发生Heck反应,然后活化邻位苯环上的H,最后与卤代烷烃进行C-C偶联得到最终产物。 Chan–Lam C–X偶联反应
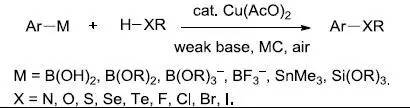
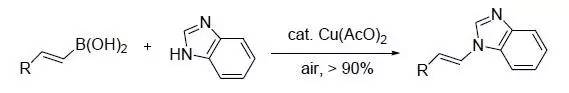
含有NH/OH/SH基团的底物在弱碱条件下,在空气中通过醋酸铜催化,与有机硼酸化合物氧化交叉偶联进行芳基,烯基和烷基化的反应。 Chan炔还原反应
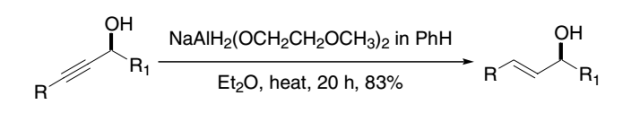
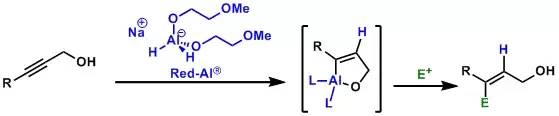
利用红铝(sodium bis(2-methoxyethoxy)aluminum hydride)或氢化铝锂立体选择性地将炔丙醇还原为E-烯丙醇的反应。 Chapman rearrangement
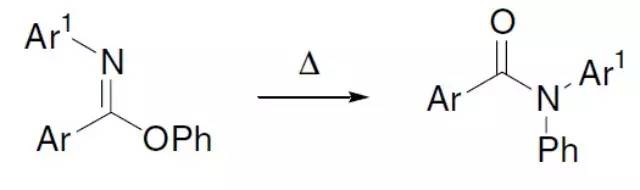
O-芳基亚胺酸酯的芳基热重排得到酰胺。 Charette不对称环丙烷化(CharetteAsymmetric Cyclopropanation)
该反应添加了手性硼酸酯进行的不对称的Simmons-Smith环丙烷化反应。 Chichibabin吡啶合成反应
醛和氨缩合制备吡啶的反应。 Chugaev消除反应
黄原酸酯热消除得到烯烃的反应。 C-H催化氧化反应(CatalyticC-H Oxidation) Ciamician–Dennstedt重排
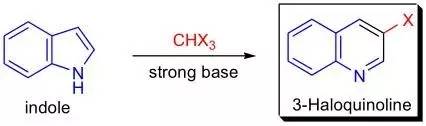
吡咯在强碱条件下与卤仿(CHX 3 where X = Cl, Br, I)反应重排生成3-卤代吡啶的反应。 Claisen克莱森缩合
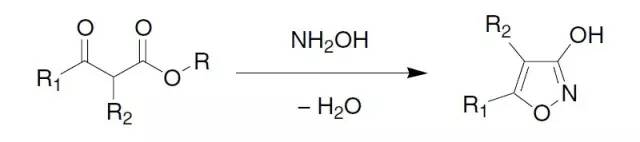
碱催化下酯缩合得到β-酮酯的反应。 Claisen异恶唑合成
β-酮基酯和羟胺环化得到3-羟基-异恶唑(3-异恶唑酚)。 Claisen重排反应
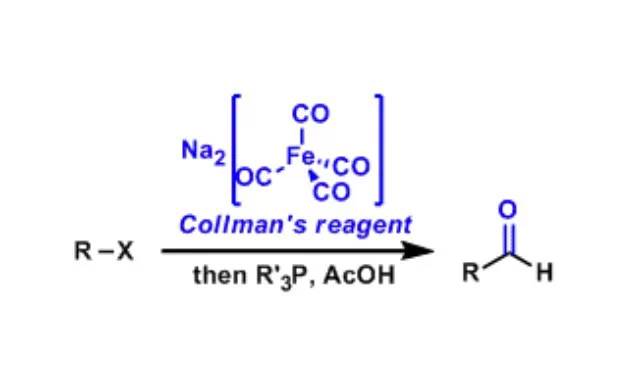
Claisen重排反应是由Rainer Ludwig Claisen在1912年发现,是第一个被发现的[3,3]-σ迁移重排。此反应是强力生成碳碳键的反应,加热烯丙基烯基醚通过[3,3]-σ迁移重排生成γ,δ-不饱和羰基化合物的反应。 Click Chemistry Azide-Alkyne Cycloaddition Collman试剂(Collman’sReagent)
Disodium Iron Tetracarbonyl,也就是四羰基铁酸二钠Na2[Fe(CO)4]俗称Collman试剂。 Combes喹啉合成反应
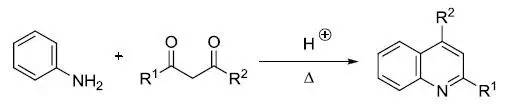
酸催化下苯胺和β-二酮缩合得到喹啉的反应 Conia-烯反应(Conia–EneReaction)
烯醇与烯烃或者炔烃进行的分子内环化反应的总称。 Conrad–Limpach反应
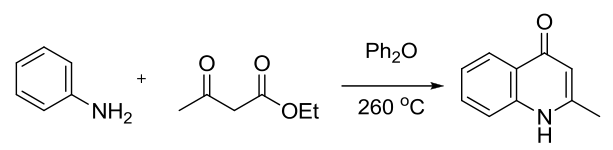
在热催化或酸催化下,苯胺和β-酮酸酯缩合得到喹啉-4-酮的反应。 Cope消除反应
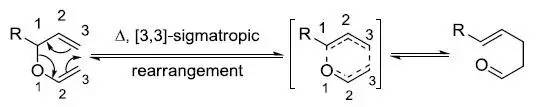
三级胺的氮氧化物热消除得到烯烃和N-羟基胺的反应。 Cope重排反应
反应属于[3,3]-σ单电子迁移重排,反应过程协同进行,反应可逆。机理同克莱森重排。 Corey-Bakshi-Shibata还原 利用硼烷和手性恶唑硼烷催化剂(CBS catalyst)对映异构选择性的还原酮得到相应的手性醇。
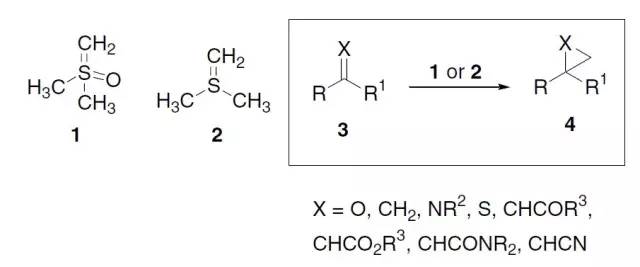
Corey-Chaykovsky反应是指鋶叶立德 [如二甲基亚砜亚甲基叶立德 1(Corey叶立德)或二甲基鋶亚甲基叶立德 2],与亲电体3,(如羰基,烯烃,亚胺,或硫代羰基)反应得到4,如环氧乙烷,环丙烷,氮丙啶,或环硫丙烷的反应。
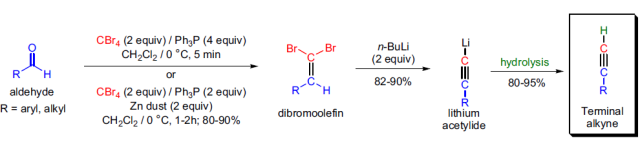
醛与四溴化碳和三苯基膦反应,发生一碳同系化生成二溴烯烃,然后再用正丁基锂处理而得到末端炔烃的反应称为Corey-Fuchs炔合成反应。 Corey-Gilman-Ganem氧化反应(Corey-Gilman-Ganem Oxidation)
利用二氧化锰与氰离子体系在温和条件下选择性氧化α,β-不饱和醛到对应羧酸酯的手法。 Corey-Kim氧化反应
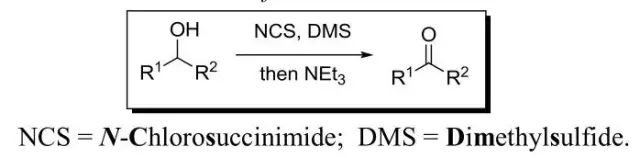
醇在N-氯代丁二酰亚胺(NCS)和二甲硫醚(Me2S,DMS)的作用下,再经碱处理可得相应的醛酮的反应。 Corey–Nicolaou大环内酯化反应 ω-羟基酸或更长链的羟基酸通过2,2’-吡啶二硫化物处理得到大环内酯的反应。 Corey–Seebach反应
二噻烷作为亲核试剂,反应生成增加一个羰基的产物,此反应是著名的极性反转的例子。
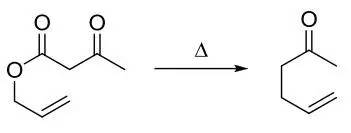
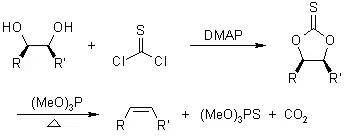
此反应将1,2-二醇转化为烯。环状硫代碳酸酯由二醇和硫光气或硫代羰基二咪唑反应得到,继续和亚磷酸三甲酯反应順式消除得到烯烃。 Cr(η6-arene)(CO)3络合物(Cr(η6-arene)(CO)3 Complex) Crabbe联烯合成(CrabbeAllene Synthesis)
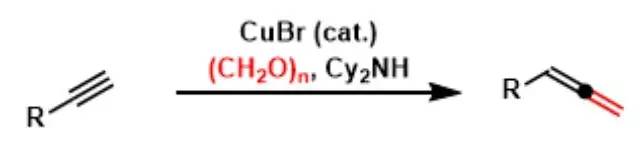
在铜金属催化剂、多聚甲醛、高位阻2级胺(二环己胺、二异丙胺等)存在下,把末端炔烃转换成联烯的手法。 Criegee臭氧化反应 臭氧先对烯烃进行1,3-偶极环加成得到初级臭氧化物,重排得到 两性离子过氧化物,再一次1,3-偶极环加成生成最终的臭氧化物。
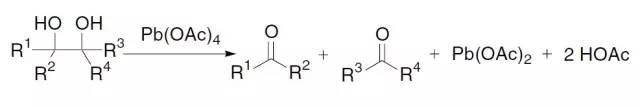
利用Pb(OAc)4【lead tetraacetate (LTA)】氧化邻二醇得到相应的两个羰基化合物。
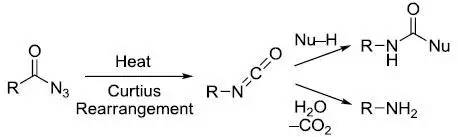
酰基叠氮加热进行1,2-C-N迁移并放出氮气,生成异氰酸酯的反应被称为Curtius重排。 Dakin-West反应 将α-氨基酸和醋酸酐在碱性条件(吡啶)下反应通过噁唑啉(氨基酸内酯)中间体生成α-乙酰基氨基甲基酮并放出二氧化碳的反应。 Dakin氧化反应 碱性条件下芳基醛酮通过过氧化氢氧化得到酚的反应。 Danheiser成环反应
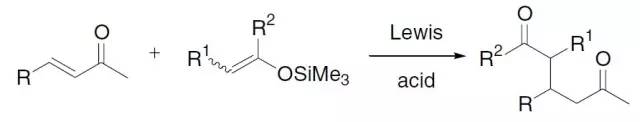
α,β-不饱和酮和三甲基硅基丙二烯衍生物在路易斯酸催化下得到三甲基硅基环戊烯的反应。 Danishefsky-Kitahara双烯化反应(Danishefsky-Kitahara Diene)
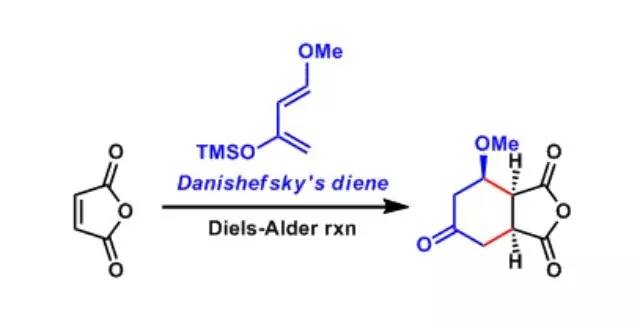
siloxydiene俗称Danishefsky(北原)双烯,是一种有机硅化合物。其系统名称是反-1-甲氧基-3-(三甲基硅氧基)-1,3-丁二烯。该双烯由于有两个供电取代基,所以HOMO的能级比较高,很容易与缺电子底物发生Diels-Alder反应或杂环Diels-Alder反应 Darzens缩水甘油酸酯缩合
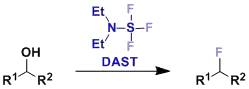
α-卤代酯在碱催化下和羰基化合物反应制备α,β-环氧酸酯(glycidic esters缩水甘油酸酯)的反应。 DAST
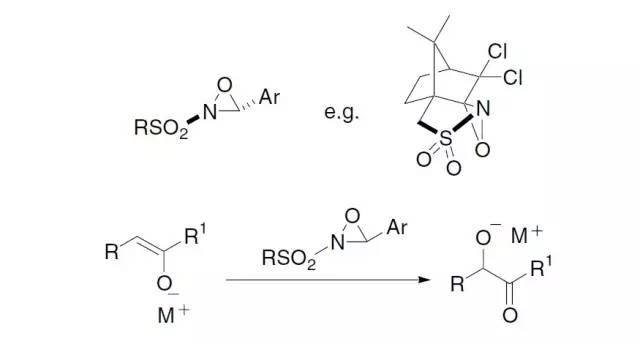
Davis氧化反应 本反应能使羰基和酯基的α位在温和条件下被氧化。手性 N-磺酰基氧杂吖丙啶可以不对称引入羟基。
用2-sulfonyloxaziridine ( N-磺酰基氧杂吖丙啶,戴维斯试剂)处理烯基氧负离子,羰基和酯基的α位能在温和条件下被氧化。用樟脑磺酸衍生物之类的具有光学活性的oxaziridine能实现不对称氧化。 De Kimpe氮杂环丙烷的合成
α-氯代亚胺和亲核试剂(如,氢负离子,氰基或格氏试剂)反应制备氮杂环丙烷类化合物的反应。 de Mayo反应
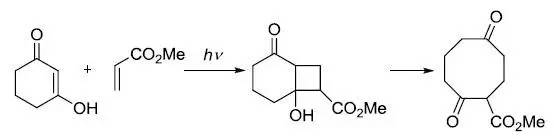
烯酮和烯烃进行[2 + 2]-光化学环加成后,进行反-羟醛缩合得到1,5-二酮的反应。
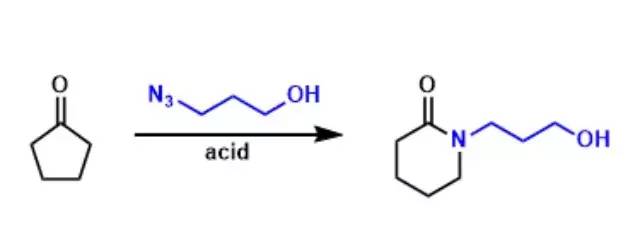
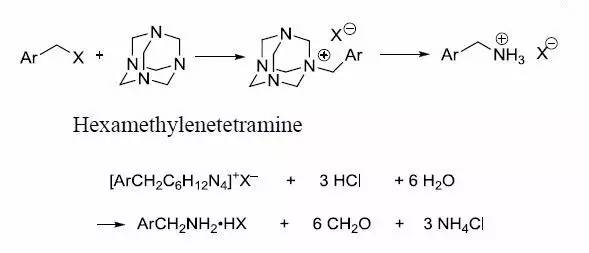
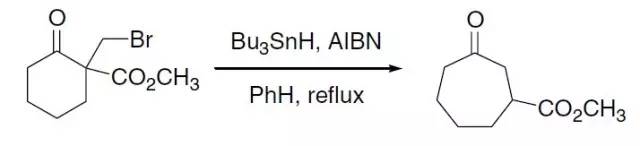
烷基卤代物和六亚甲基四胺反应得到铵盐,接着用HCl乙醇溶液酸解得到伯胺的反应。 Demjanov重排 一级胺通过重氮化和C-C键迁移得到醇的反应。 Dess-Martin高碘烷氧化 利用三乙酰氧基高碘烷将醇氧化为相应的羰基化合物的反应。
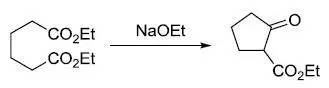
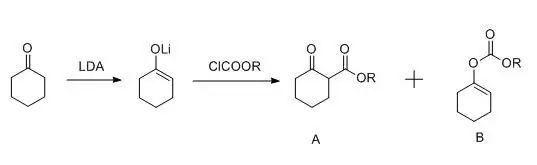
二酯在碱作用下发生分子内缩合生成β-酮酯的反应,即分子内的Claisen缩合反应。 Diels-Alder反应
狄尔斯–阿尔德反应是[4+2]环加成反应中最具代表的,由共轭双烯与亲双烯体构建环己烯骨架的经典反应。反应有良好的立体、位置选择性。 Diels-Alder-不对称Diels-Alder反应(AsymmetricDiels-Alder Reaction) Dimroth重排反应
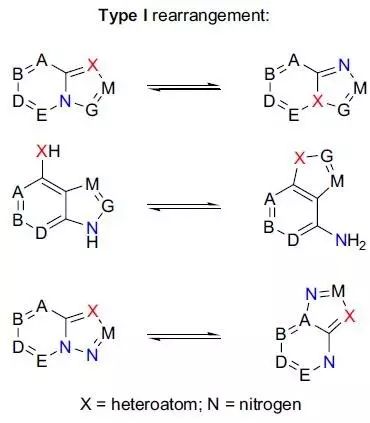
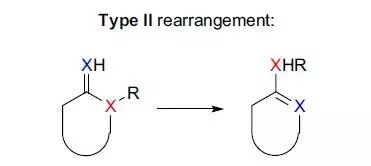
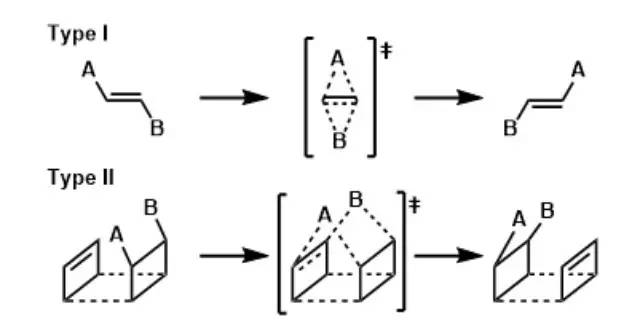
杂环化合物的环内或环外杂原子和其取代基之间通过开环-关环交换位置异构化的反应被称为Dimroth重排。 Di-π-methane重排(Di-π-methaneRearrangement)
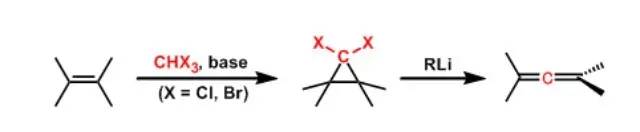
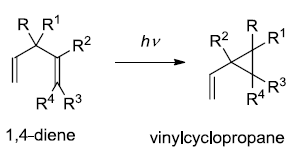
在光照射下二烯发生重排,得到乙烯基环丙烷的反应。 Doering-LaFlamme丙二烯合成(Doering-LaFlamme Allene Synthesis)
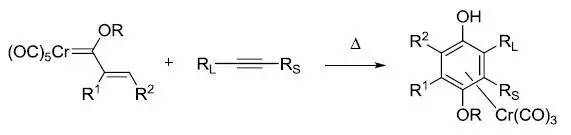
1,1-二卤代环丙烷在烷基锂作用下,形成卡宾后引起重排反应,得到丙二烯的反应。 Dötz反应
此反应也被称为 Dötz 苯环化反应,烯基烷氧基五羰基合铬卡宾络合物(Fischer 卡宾)和炔反应生成Cr(CO)3络合的对苯二酚的反应。 Dowd-Beckwith扩环反应
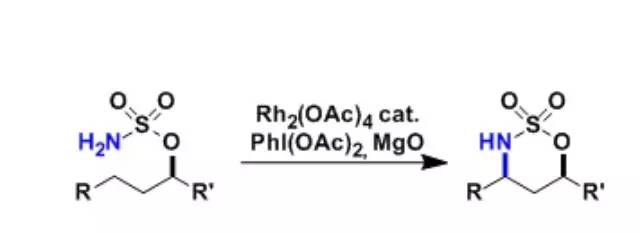
2-卤甲基环烷酮自由基辅助扩环反应。 Du Bois胺基化(DuBois Amination)
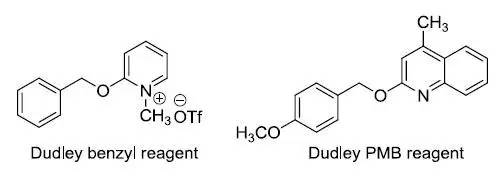
利用二价Rh催化剂在反应体系中形成金属氮宾进行的C-H活化胺基化反应的手法。 Dudley reagent
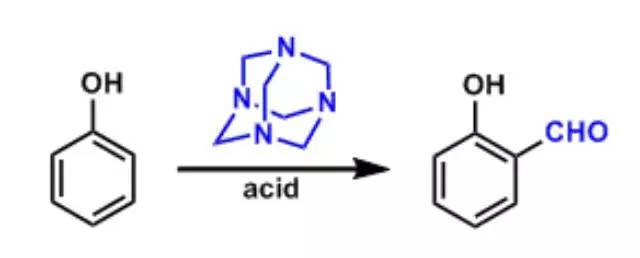
Dudley试剂可以在温和条件下保护醇得到相应的苄基或PMB醚。 Duff反应
活泼的芳香族化合物(如酚)与六亚甲四胺反应生成亚胺中间体,继而水解成醛。 Dyotropic重排反应(dyotropicrearrangement)
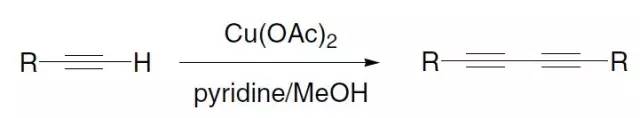
如标题图所示,两个σ键发生协同性的组合变化进行的重排反应被称为dyotropic rearrangement。 Eglinton偶联
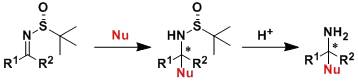
端基炔在化学计量(或过量)的Cu(OAc)2的催化下进行氧化偶联的反应。此反应是Glaser偶联反应的一个变体。 Elbs氧化 此反应也被称为Elbs过硫酸盐氧化,此反应与Boyland–Sims类似只是底物由苯胺变为苯酚,机理也与其类似。 Ellman亚胺(Ellman’sImine)
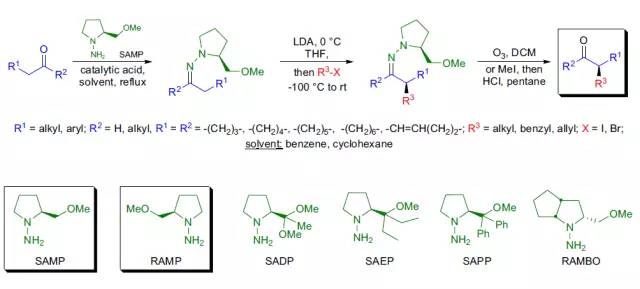
手性叔丁基磺酰胺是一个优质的不对称辅助剂。 Enders SAMP/RAMP腙烷基化反应
通过醛酮的SAMP/RAMP腙对其进行不对称烷基化的反应被称为Enders SAMP/RAMP腙烷基化反应。 Erlenmeyer-Plöchl azlactone synthesis*
在乙酸酐存在下酰基甘氨酸发生分子内缩合得到5-恶唑酮(吖内酯)。 Eschenmoser–Claisen酰胺缩酮重排
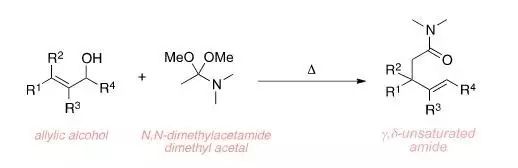
烯丙醇类化合物和N,N-二甲基乙酰胺二缩酮在加热条件下重排得到γ,δ-不饱和酰胺的反应。由于Eschenmoser是基于Meerwein对于酰胺交换的研究而发现此反应,此反应也被称为Meerwein–Eschenmoser–Claisen重排。 Eschenmoser-Tanabe裂解反应
α,β-环氧酮通过α,β-环氧磺酰腙中间体裂解为酮和炔的反应。 Eschenmoser偶联(EschenmoserCoupling)
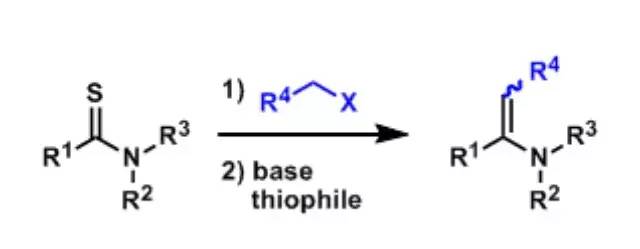
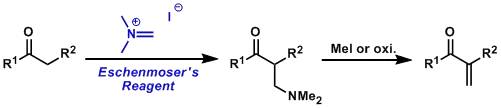
硫代酰胺通过烷基化生成vinylogous amides或者聚氨酯的手法。 Eschenmoser亚甲基化(EschenmoserMethylenation)
Eschenmoser试剂被用于在羰基α位导入氨甲基。如果再把氨基消除离去,最终可以得到亚甲基基团。同时,该试剂也是市售品。 Eschenmoser盐
Eschenmoser盐,N,N-二甲基亚甲基碘化铵,是一种很强的二甲基胺甲基化试剂。 Eschweiler-Clarke反应(Eschweiler-Clarke Reaction) 该反应是一级或二级胺通过与甲酸和甲醛反应后在氨基N上进行的N-甲基化的反应。 Evans羟醛缩合反应 Favorskii重排 可以烯醇化的α-卤代酮在烷氧基,羟基或胺催化下重排分别生成酯,羧酸或酰胺的反应。 环状底物的Favorskii重排 Feist–Bénary呋喃合成反应 在碱性条件下,由α-卤代酮和β-酮酸酯反应制备呋喃的反应。常用的催化剂有胺或吡啶。 Ferrier碳环化反应
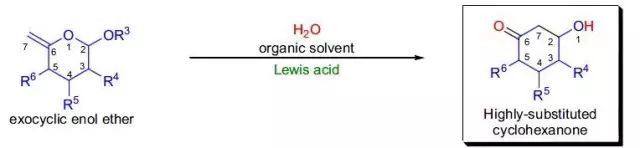
路易斯酸催化下一锅法高效地将5,6-不饱和呋喃糖转化为取代环己酮类化合物的反应。 Ferrier重排反应
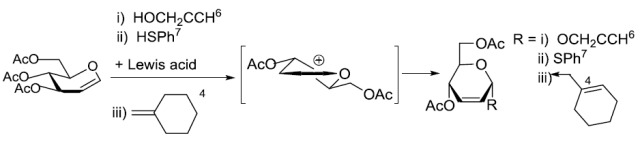
在Lewis酸催化下O-取代的烯糖衍生物通过烯丙位重排与O-, S-, C- N-, P-和卤代亲核试剂反应得到2,3-不饱和糖苷类化合物的反应。 Fétizon氧化剂
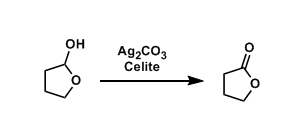
Fétizon氧化剂,以Celite为载体的碳酸银(I),该试剂是一种十分温和的氧化试剂,适用于对酸和碱都敏感的化合物的氧化 Fiesselmann噻吩合成
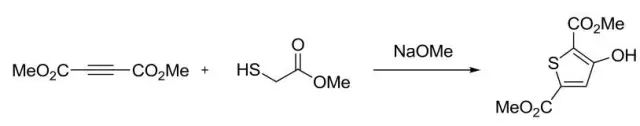
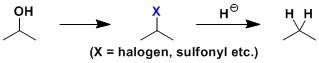
巯基乙酸衍生物和α,β-炔酸酯在碱性条件下缩合得到3-羟基-2-噻吩甲酸衍生物的反应。 Finkelstein反应 伯卤代烷或伯醇磺酸酯与金属卤代物(e.g. KF, KI)通过SN2 反应得到另一种卤代物的反应。
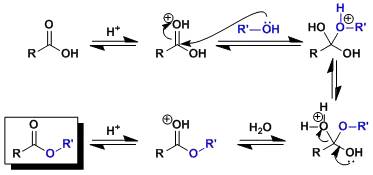
Fischer-Speier酯化反应(费歇尔Esterification)
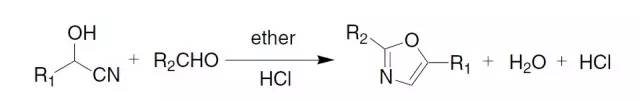
费歇尔酯化反应其实是最经典的酯化反应 Fischer恶唑合成
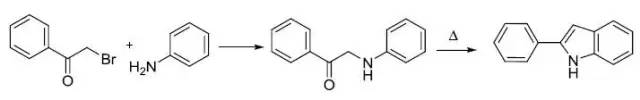
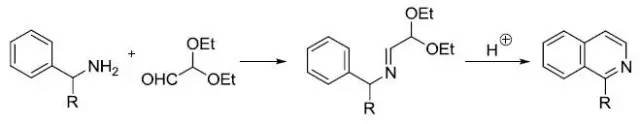
当量的醛氰醇和芳基醛在乙醚溶液中干燥的HCl催化下缩合得到恶唑的反应。 Fischer吲哚合成反应 费舍尔吲哚合成是一种简单快速的由醛或酮和芳基联氨出发的环化生成多取代吲哚的合成方法。 Fleming-Kumada oxidation
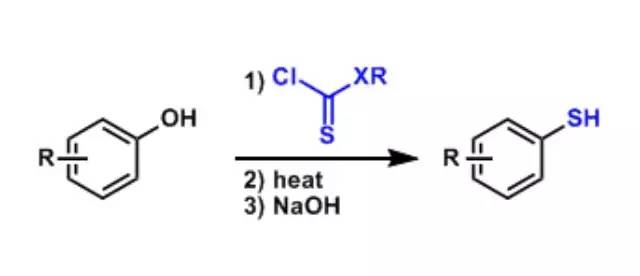
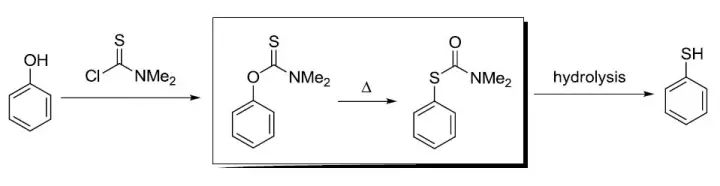
利用过氧酸将烷基硅化合物立体选择性的氧化为相应的醇。 Freunderberg-Schonberg硫酚合成
苯酚在硫代氨基甲酸酯化或者硫代碳酸化后,经过加热重排与水解合成硫酚的手法(具体参照反应机理)。
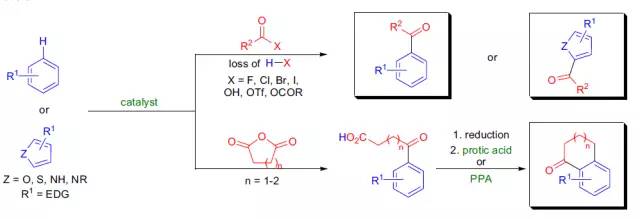
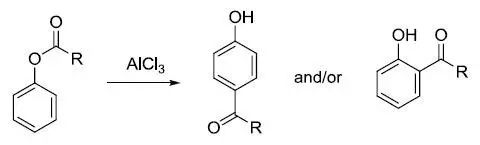
在Lewis酸催化下利用酰卤或酸酐在芳基或脂肪基底物上引入酮基的反应称为Friedel-Crafts酰基化反应。 Friedlaender反应 此反应是指邻胺基醛或酮与另一分子有α-亚甲基的酮反应得到喹啉的反应。 Friedländer喹啉合成反应 此反应是指邻胺基芳基醛或酮与另一分子有α-亚甲基的酮反应得到喹啉的反应。 Fries重排
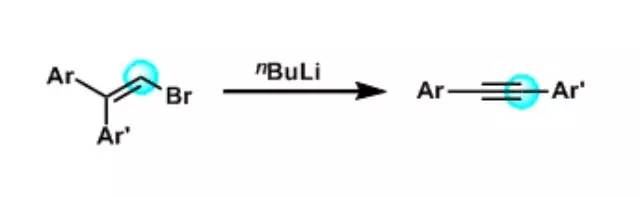
Lewis酸催化下酚酯或酚酰胺重排得到 2-或 4-酮基苯酚的反应。 Fritsch–Buttenberg–Wiechell重排反应
1,1′-二芳基-2-溴代烯烃在强碱(BuLi,RO- 等)作用下发生α消除、通过卡宾重排形成1,2-二芳基炔烃的反应。 ()
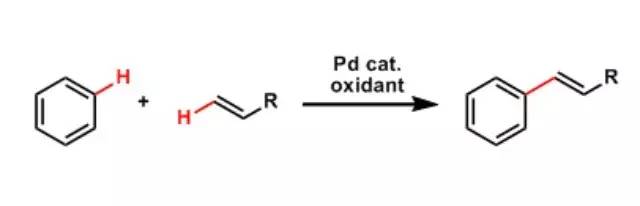
Pd催化剂存在下,对无修饰的苯环进行的直接的烯烃化偶联反应。 Fukuyama胺合成反应
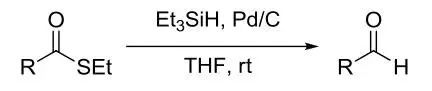
伯胺先和苯磺酰氯反应生成硝基苯磺酰胺,然后烷基化合成仲胺磺酰胺,脱保护得到仲胺的合成法称为Fukuyama胺合成反应。 Fukuyama还原反应
Pd/C催化下利用三乙基硅烷还原硫代酸酯生成醛的反应。 Fukuyama偶联反应 有机锌化合物和硫代酸酯在钯催化剂下偶联得到酮的反应。
Fukuyama吲哚合成反应 Fukuyama吲哚合成反应是由東京大学的福山透等人发现的自由基环化反应,可实现多取代吲哚的合成,分为第一代合成法和第二代合成法。通常用三丁基氢化锡作为自由基还原剂、AIBN或三乙基硼为自由基引发剂。该反应可用于合成含多取代吲哚结构的天然产物,如 aspidophytine、长春花碱和番木鳖碱,2002年,福山首次实现长春花碱的全合成。 Gabriel–Colman重排 芳基邻二酰亚胺基乙酸酯在碱性条件下重排得到1,4-二酚异喹啉类似物的反应。 Gabriel反应
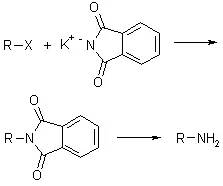
邻苯二甲酰亚胺钾盐是一种-NH2合成子,它可通过和烷基卤代烃反应制备伯胺。烷基化后,邻苯二甲酰亚胺没有亲核性,不能继续反应,产物 通过碱或者肼裂解得到伯胺产物和环状副产物。 Gassman吲哚合成反应 次氯酸化合物,β-羰基硫化物和碱依次加入到苯胺或取代苯胺中一锅法得到3-硫代烷氧基吲哚的反应被称为Gassman吲哚合成反应。 Gattermann–Koch reaction
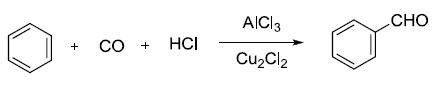
在高压条件下利用一氧化碳和氯化氢在三氯化铝催化下对芳烃进行醛基化得反应。 Gattermann醛合成(GattermannAldehyde Synthesis) Gewald氨基噻吩合成
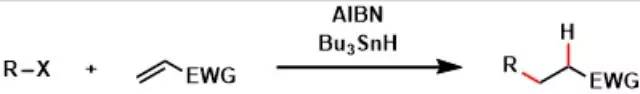
由酮,α-活性亚甲基腈和单质硫在碱性催化下制备氨基噻吩的方法。 Giese自由基加成反应(GieseRadical Addition)
像含卤素・硫化合物・Barton酯等可以与自由基起始剂反应形成碳自由基,进而与各种自由基捕获剂反应。在这些反应中,对于缺电子的烯烃作为底物的形成C-C键的反应通常被称为Giese反应 Glaser偶联是通过两个端基炔合成对称二炔或环状二炔的常用反应。 Goldberg胺化(GoldbergAmination)
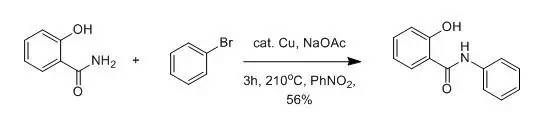
Goldberg反应(Goldberg reaction)是用苯胺或芳基酰胺,代替酚进行的 Ullmann 二芳醚合成。 由德国女化学家、Fritz Ullmann 的妻子 Irma Goldberg 发现。例如,邻氯苯甲酸与苯胺缩合,可得芬那酸。Goodbrand 等报道了一种用从碘化亚铜和邻二氮菲制备的催化剂介导的芳基碘化物和芳胺之间的 Ullmann 型芳香胺化偶联反应。富电子的芳基碘化物也能进行反应,因此这种方法可用于弥补 Buchwald-Hartwig 反应有些情况下不适用于富电子芳卤的缺点。 Goldberg偶联反应
铜或铜盐催化下进行芳酰胺化的反应。此反应最早由德国女化学家、Fritz Ullmann 的妻子 Irma Goldberg 发现。 Gomberg–Bachmann反应
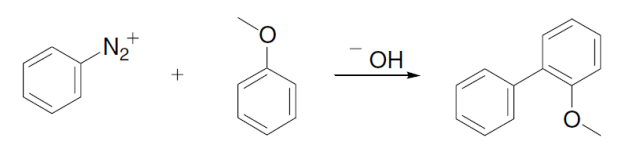
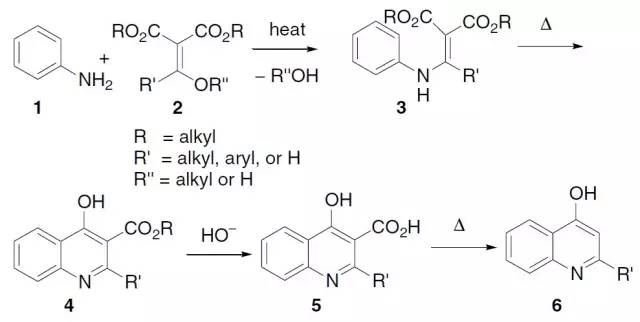
碱催化下芳基重氮盐和芳烃进行自由基偶联得到二芳基化合物的反应。 Gould–Jacobs反应
Gould–Jacobs反应是一系列反应的组合:一、苯胺1与烷氧基亚甲基丙二酸酯或酰基丙二酸酯2缩合得到苯胺基亚甲基丙二酸酯3;二、3发生环化反应得到4-羟基-烷酯基喹啉4;三、水解得到酸5;四、脱羧得到4-羟基喹啉6。 Griesbaum共臭氧化反应 Griesbaum共臭氧反应可以通过O-甲基肟和羰基化合物在臭氧中反应得到特定的四取代臭氧化物(1,2,4-三氧五环化合物)。 卤代烃在醚溶剂中与镁作用生成有机金属镁化合物,这一产物叫做格利雅试剂,简称格氏试剂。 Guareschi–Thorpe缩合 氰基乙酸酯和1,3-二酮在氨存在下缩合制备2-吡啶酮的反应。 Hajos–Wiechert反应 (S)-(—)-脯氨酸催化的不对称Robinson关环反应。 Haller–Bauer反应 在碱诱导下不能烯醇化的酮裂解得到酰胺衍生物(或羧酸)和烷烃的反应。 Hantzsch 合成法
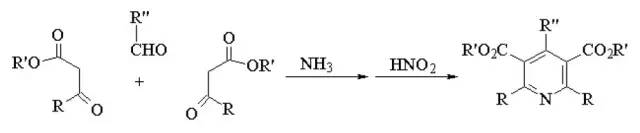
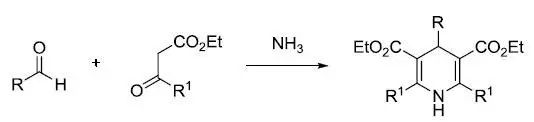
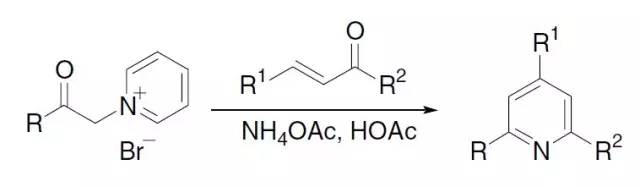
两分子β-羰基酸酯和一分子醛及一分子氨发生缩合反应,得到二氢吡啶衍生物,再用氧化剂氧化得到吡啶衍生物。 Hantzsch吡咯合成法
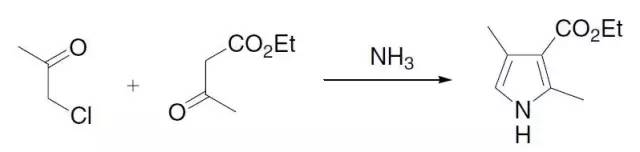
α-卤代甲基酮,β-酮基酯和氨缩合得到吡咯的反应。 Hantzsch二氢吡啶合成法
醛,β-酮酯和氨缩合得到1,4-二氢吡啶的反应。
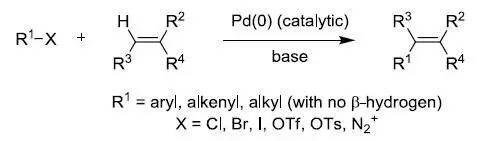
钯催化下对烯烃进行烯基或芳基化的反应。
通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联反应称为Heck反应。自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用范围越来越广泛,使该反应已经成为构成C-C键的重要反应之一,Heck凭借此贡献得到了2010年诺贝尔化学奖。另外,Heck反应具有很好的Trans选择性。
Hegedus吲哚合成反应
化学当量的Pd(II)催化剂氧化环化链烯基苯胺得到吲哚的反应。反应机理和Wacker氧化类似。 Heine 反应
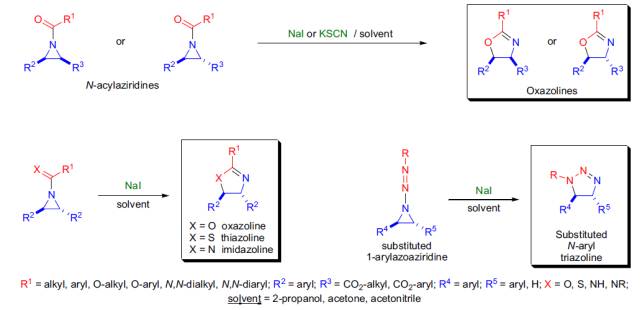
N-取代酰基氮杂环丙烷在亲核试剂 (e.g., NaI or KSCN) 的作用下扩环得到相应的取代噁唑啉的反应被称为Heine 反应。 Hell–Volhard–Zelinsky反应
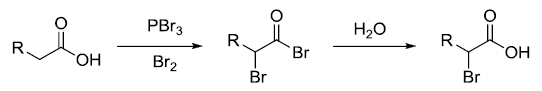
利用X2/PX3进行羧酸的α 位卤代的反应。 Henry反应 Henry反应是指在碱催化下硝基烷烃与醛酮反应β-羟基硝基烷烃的反应。此反应和羟醛缩合类似,也被称为硝基Aldol反应。 Hinsberg噻吩合成反应
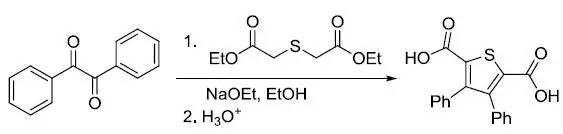
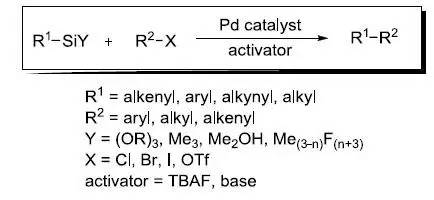
硫代二甘酸二乙酯和α-二酮在碱性条件下缩合得到3,4-二取代噻吩-2,5-二甲酸酯,然后水解生成相应的酸的反应。 Hiyama交叉偶联反应
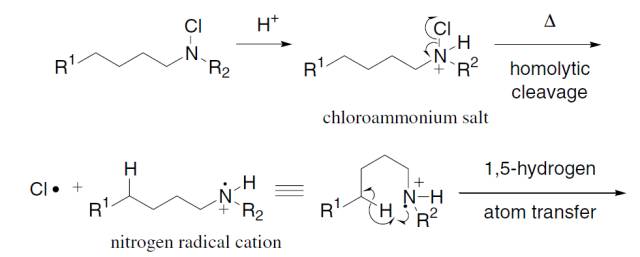
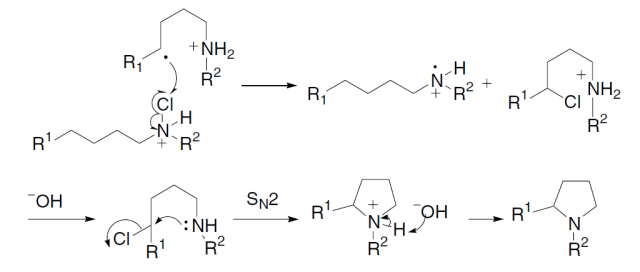
钯催化下有机硅试剂和有机卤代物或三氟甲磺酸酯进行交叉偶联的反应。 Hofmann–Löffler–Freytag反应 热化学或光化学条件下分解质子化的N-卤代胺制备吡咯烷或哌啶的反应。
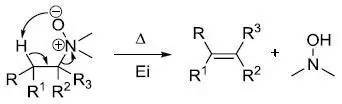
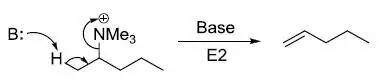
烷基三甲基铵在碱性条件下消除生成取代较少的烯烃的反应。
伯胺的酰胺通过次卤化物处理经过异氰酸酯中间体生成相应的伯胺的反应。 Horner– Wadsworth–Emmons反应Masamune–Roush改进法
本反应适用于对碱不稳定的醛和膦酸酯进行Horner–Wadsworth–Emmons反应制备烯烃。膦酸酯必须是α-酮基或α-烷氧羰基膦酸酯。 Horner-Wadsworth-Emmons反应 1958年,L. Horner利用烷基二苯基氧膦的负离子和醛酮反应成功制备了烯烃。这一对Wittig反应的改进反应被称为Horner-Wittig反应(或Horner反应)。 Hosomi Sakurai反应
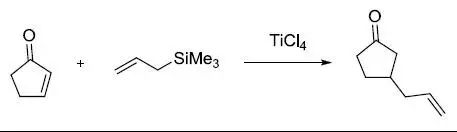
Hosomi Sakurai反应是指在路易斯酸催化下各种亲电试剂和烯丙基三甲基硅烷反应进行烯丙基化的反应。 Houben-Hoesch反应
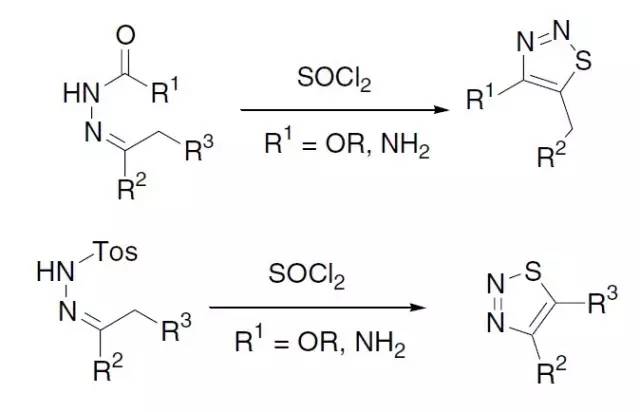
酚或酚醚和腈类化合物在酸催化下进行酰基化的反应。 Hunsdiecker-Borodin反应 羧酸银用卤素处理得到卤代烷的反应。 Hurd–Mori 1,2,3-噻二唑的合成
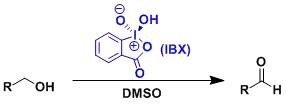
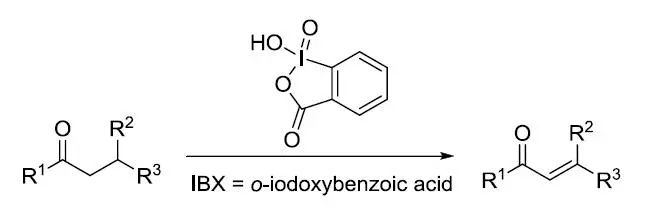
N-酰基或甲苯磺酰基腙衍生物和氯化亚砜反应一步得到1,2,3-噻二唑的反应。 IBX氧化反应IBX Oxidation
IBX氧化反应是一种反应条件相对温和,底物适用范围广泛的氧化反应。缺点是IBX在有机溶剂中的溶解性以及高价碘的不稳定性。 Iron-Catalyzed C-H Functionalization(铁催化导向碳氢官能团化) Ishikawa试剂
Ishikawa试剂(石川试剂)能将伯醇,仲醇和叔醇转化为相应的氟化合物,对羰基没有影响。 Ivanov反应
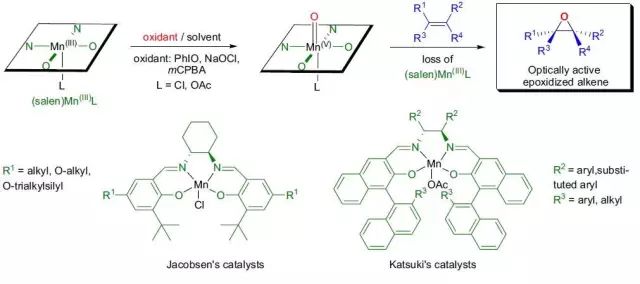
Ivanov试剂是由苯乙酸及其衍生物得到的羧基烯醇式(烯二醇二镁盐,或羧酸二盐),其与醛反应得到β-羟基酸,和羟醛缩合类似。 Jacobsen–Katsuki环氧化反应
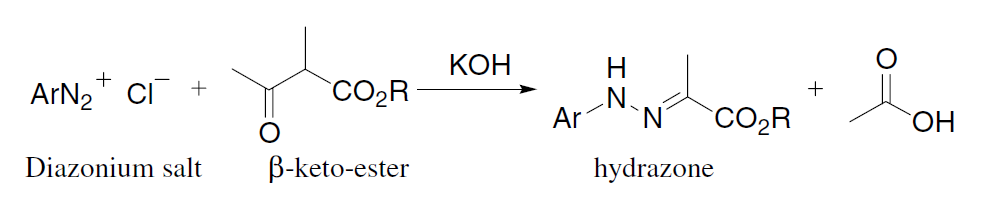
利用Mn(III)salen催化剂催化下氧化(Z)烯烃不对称合成环氧化物的反应。 Japp–Klingemann腙合成反应
α-酮酯和重氮盐在碱催化下制备腙的反应。 Jocic反应
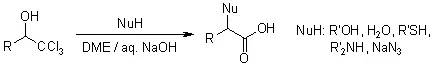
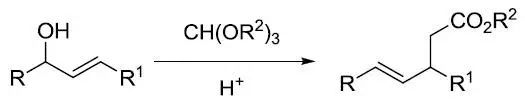
三氯甲基醇和各种亲核试剂在氢氧化钠水溶液中反应得到α-取代羧酸的反应。 Johnson–Claisen原乙酸酯重排
在少量弱酸存在下,加热烯丙醇类化合物与过量的原乙酸三酯反应得到γ,δ-不饱和酯的反应。 Johnson-Corey-Chaykovsky反应
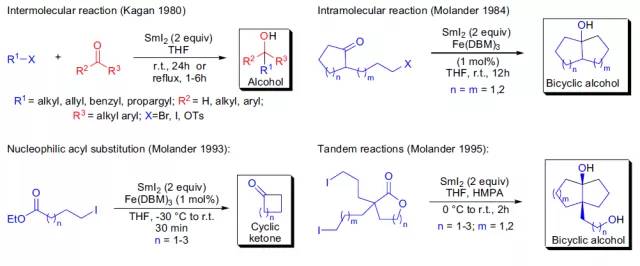
羰基化合物和锍叶立德反应制备环氧化物的反应。 Jones氧化反应(JonesOxidation) 该反应是最最基本的醇的氧化反应 Julia–Kocienski烯化反应 此反应是改进后的一锅法的Julia烯化反应,杂环芳基砜和醛反应主要生成生成(E)-烯烃。 多步制备(E)-烯烃的反应,苯磺酰基碳负离子和醛酮加成得到中间体醇,原位酯化,然后利用钠汞齐进行还原消除得到烯烃。 Kagan-Molander偶联反应
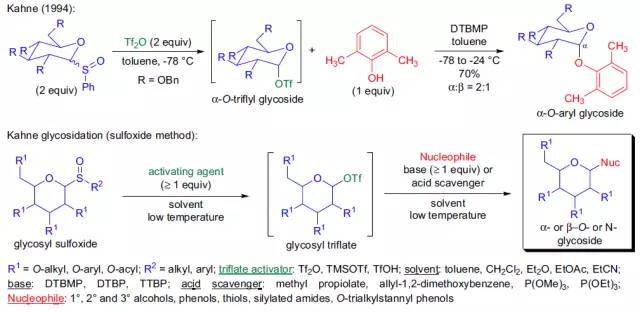
Kahne 糖苷化反应, Kahne–Crich糖苷化反应
通过活化的糖基亚砜制备高立体选择性的O-, S-,或N-糖苷的反应被称为Kahne糖苷化反应(亚砜法)。 Keck自由基烯丙基化反应
卤代烃和烯丙基三丁基锡在自由基条件下偶联烯丙基化的反应被称为Keck自由基烯丙基化反应。 Kennedy氧化环化反应 1992年Kennedy, R. M. 等人报道了5-羟基烯烃和氧化铼(VII) (Re2O7)反应得到2-羟甲基四氢呋喃的反应。此氧化环化反应是顺式加成,产量稳定,但有少量的醇被氧化为羰基化合物。 Knoevenagel缩合反应
羰基化合物和活泼亚甲基化合物在胺催化下缩合的反应。 Kochi-Fürstner偶联反应(Kochi-Fürstner Cross Coupling)
卤化芳烃・芳基三氟甲磺酸・芳基磺酸盐与Grignard试剂在铁催化剂的作用下进行的偶联反应。 Koenigs-Knorr糖苷化反应
通过糖基卤化物和醇或酚在重金属盐或路易斯酸存在下制备烷基和芳基-O-糖苷的反应被称为Koenigs-Knorr糖苷化反应。 Kornblum氧化反应
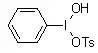
利用DMSO作为氧化剂将卤代烷氧化为相应的羰基化合物的反应被称为Kornblum氧化。 Koser试剂 Koser试剂:羟基(对甲苯磺酰氧基)碘苯, Hydroxy(tosyloxy)iodobenzene (HTIB)
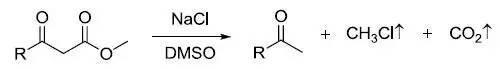
Krapcho反应
β-酮酯,丙二酸酯,α-氰基酯或α-磺酰基酯在亲核试剂存在下脱羧的反应 Kröhnke吡啶合成
由α-吡啶基甲基酮盐和α,β-不饱和酮反应制备吡啶的方法。 Kumada偶联反应
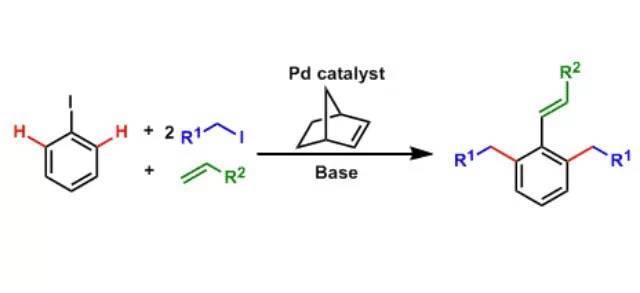
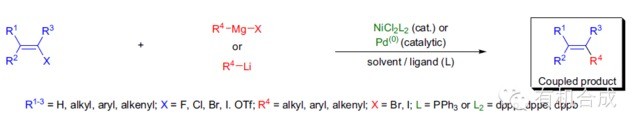
指烷基或芳基格氏试剂与芳卤或乙烯基卤,芳基三氟甲磺酸酯等等在镍或钯催化下的交叉偶联反应。 李朝军三组分反应
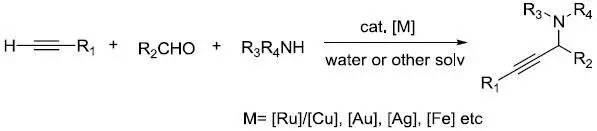
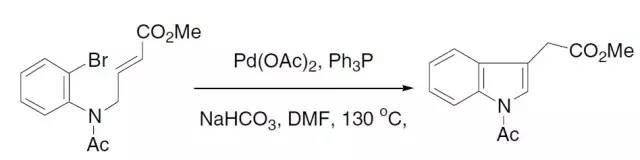
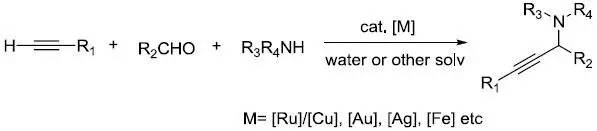
李朝军三组分反应是指在过渡金属催化下醛-炔-胺三组分直接脱水缩合得到丙炔胺的反应,反应通常在水中进行。1–4 Larock吲哚合成反应
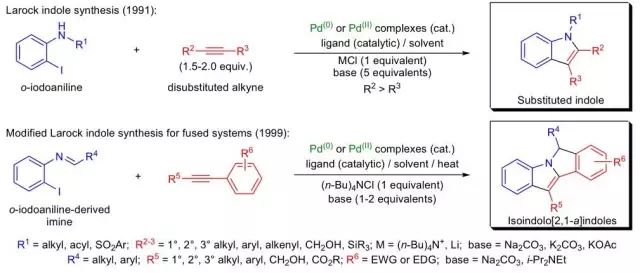
在钯催化下,邻碘苯胺和二取代炔烃进行杂环化合成2,3-二取代吲哚的反应被称为Larock吲哚合成反应。 Lawesson试剂
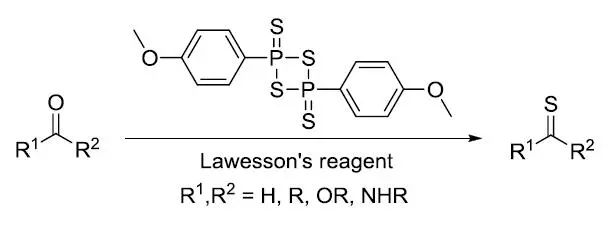
劳森试剂【2,4-Bis(4-methoxyphenyl)-1,3-dithiadiphosphetane-2,4-disulfide】 酮和胺在过量的甲酸作为还原剂的条件下进行还原胺化的反应。当用醛作为底物的反应为。 Ley-Griffith氧化 Ley-Griffith氧化,又被称为TPAP氧化。
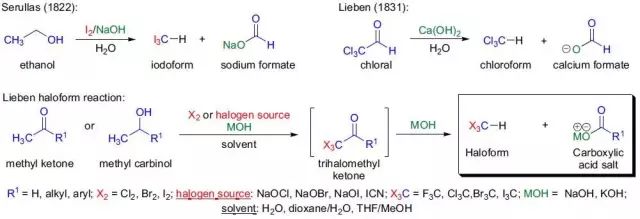
Lieben 卤仿反应
甲基酮或2-位醇和次卤酸盐反应得到卤仿和羧酸的反应被称为Lieben 卤仿反应。 Liebeskind偶联反应
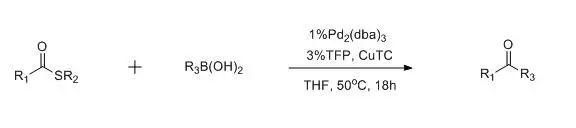
在化学计量的噻吩-2-羧酸亚铜(CuTC)和催化量的钯催化下,硫代酸酯和芳基硼酸或烷基硼进行偶联得到酮的反应被称为Libeskind偶联反应。 Lindlar Reduction
林德拉催化剂(Lindlar catalyst)是一种选择性催化氢化的异相催化剂。 Lossen重排
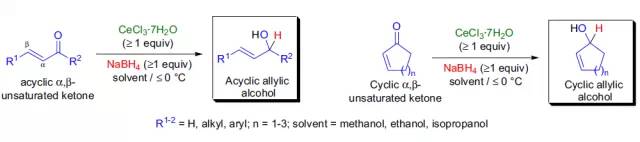
碱处理O-酰基羟肟酸重排得到异氰酸酯的反应。 Luche还原
使用氯化铈/硼氢化钠的混合物将共轭烯酮转化为相应的烯丙醇的反应被称为Luche还原。 Lu-Trost-Inoue反应
炔铜或炔酯在过渡金属催化剂或叔膦的催化下异构成E, E构型的共轭二烯酮的反应。 MacMillan催化剂
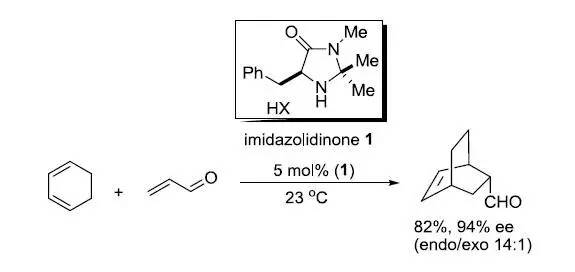
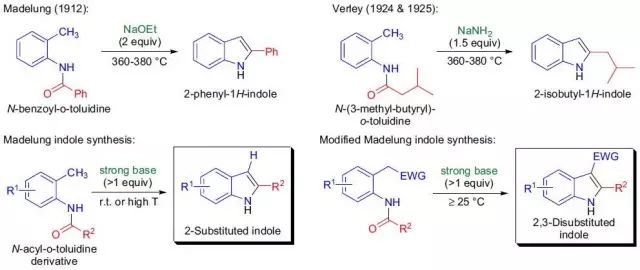
MacMillan催化剂 type 1(α-氨基酸衍生的咪唑烷酮)可以作为不对称有机催化剂高对映选择性的催化Diels-Alder反应。 Madelung吲哚合成反应
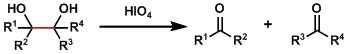
在强碱条件下N-酰基邻烷基苯胺进行分子内关环生成相应的取代吲哚的反应被称Madelung吲哚合成反应。 Malaprade乙二醇氧化断裂Malaprade Glycol Oxidative Cleavage
该反应是用高碘酸或高碘酸钠、将1,2-二醇氧化断裂的反应。 Mander试剂 在有机合成中在羰基的α-位引入甲酸酯制备β-酮酸酯衍生物是非常常见的一个反应。
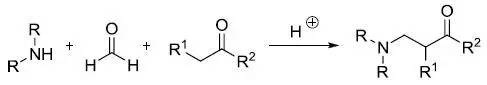
胺,醛和带有酸性较强的亚甲基的化合物进行三组分的胺甲基化反应。 Marshall硼氢化裂解
此反应是Grob裂解反应的一个变形。 Martin硫化物脱水试剂
Martin硫化物脱水试剂可以将叔醇或仲醇脱水得到烯烃,但伯醇主要得到醚。机理与Burgess脱水试剂类似。 McFadyen–Stevens还原
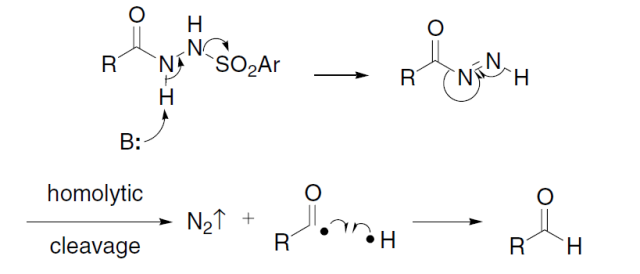
通过碱处理酰基苯磺酰基肼得到相应的醛的反应。
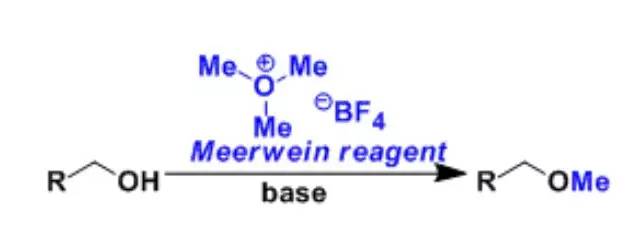
McMurry偶联反应 低价钛[如TiCl3/LiAlH4生成的Ti(0)]催化羰基制备烯烃的反应。此反应是单电子转移历程。 Meerwein 试剂
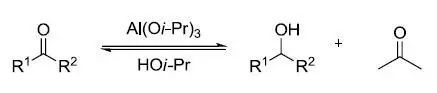
三甲基氧鎓四氟硼酸盐 (Me3OBF4)或是三乙基氧鎓四氟硼酸盐 (Et3OBF4)被称为Meerwein试剂。 Meerwein–Ponndorf–Verley还原
利用Al(Oi-Pr)3在异丙醇中还原酮得到相应的醇的反应。是Oppernauer氧化的逆反应。 Meerwein盐
Meerwein盐也称为Meerwein试剂,是指三甲基氧鎓四氟硼酸盐 (Me3OBF4)或是三乙基氧鎓四氟硼酸盐 (Et3OBF4)。 Meisenheimer络合物
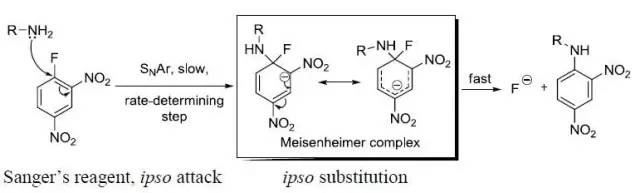
Meisenheimer络合物也被称为MeisenheimerJackson 盐,由于此中间体的稳定存在,所以可以发生 。胺对Sanger试剂(DNFB)进行原位进攻,得到原位取代物---Meisenheimer络合物。 Meyer–Schuster重排
通过1,3-迁移α-炔基仲醇或叔醇异构化得到α,β-不饱和羰基化合物的反应。 Meyers恶唑啉合成法
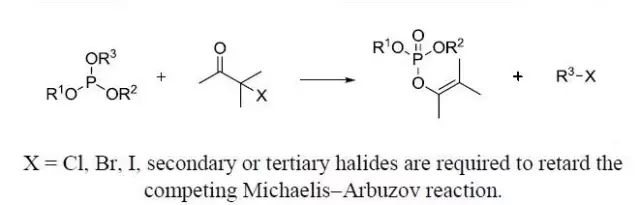
手性恶唑啉作为手性引导因子或在亲核取代过程中加入手性助剂,进行不对称C-C键形成的反应。 Michaelis-Arbuzov膦酸酯合成
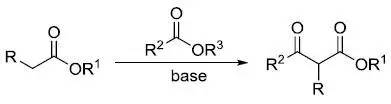
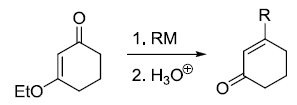
亚磷酸酯和卤代烷反应得到膦酸酯。 Michael加成反应
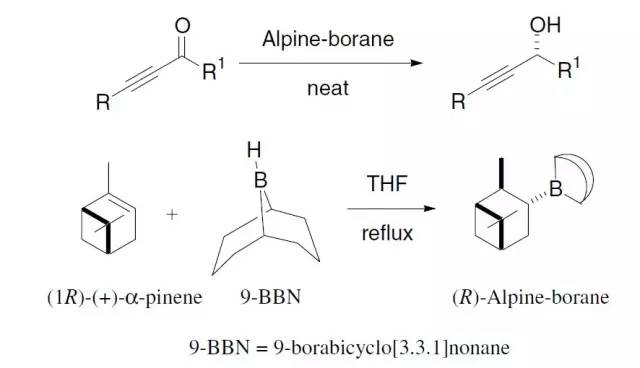
共振稳定的碳负离子对活化烯烃的1,4-加成(共轭加成)。 Midland还原
利用α-蒎烷-硼烷(Alpine-borane)不对称还原酮的反应。 Minisci反应
自由基与缺电子芳香杂环进行碳碳键生成的反应。 Mislow–Evans重排反应
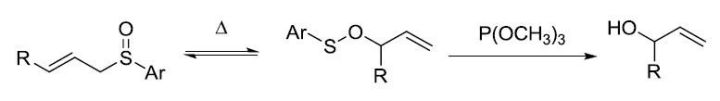
烯丙型亚砜在P(OMe)3存在下加热,发生[2,3]-σ-单电子重排,得到次磺酸酯,进而在P(OMe)3作用下转化为烯丙醇的反应。 Mitsunobu反应
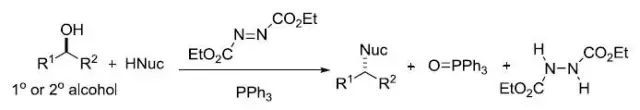
利用偶氮二羧酸酯(通常为偶氮二羧酸二乙酯,DEAD)和三取代膦化物(通常为三苯基膦),亲核试剂和醇进行SN2反应构型翻转得到构型相反的取代产物的反应。 Miyaura硼酸化反应
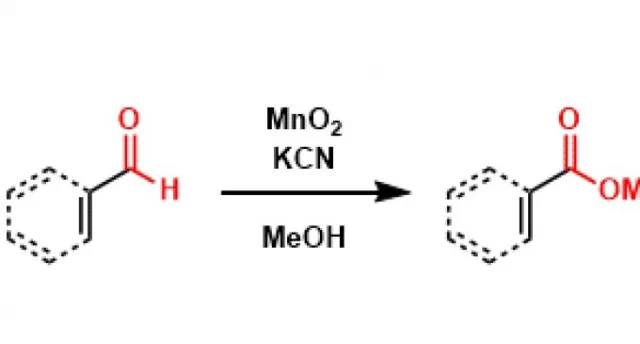
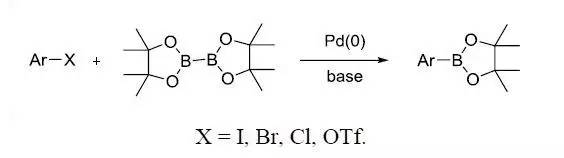
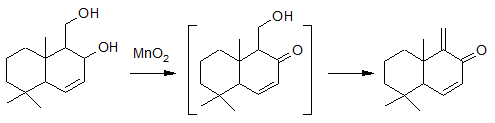
钯催化下芳基卤代物和双联硼试剂反应制备芳基硼酸酯的反应。也被称为Hosomi-Miyaura硼酸化反应。 MnO2 氧化 通过DCC和DMSO氧化醇得到醛酮的反应,也被称为Pfitzner-Moffatt氧化。 Morgan–Walls反应
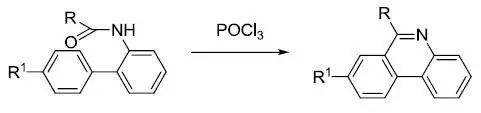
邻酰胺基联苯在硝基苯回流条件下利用三氯氧磷脱水关环得到菲啶环化合物的反应。 Mori-Ban吲哚合成反应
含有烯丙胺结构的邻卤代苯胺发生分子的Heck反应制备吲哚的反应。 Mukaiyama Michael加成反应
此反应是迈克尔加成反应的一个变体,在路易斯酸催化下硅基烯醇醚对α,β-不饱和体系进行迈克尔加成的反应。 Mukaiyama羟醛缩合反应
在Lewis酸催化下醛和烯醇硅醚进行羟醛缩合的反应。 Mukaiyama试剂
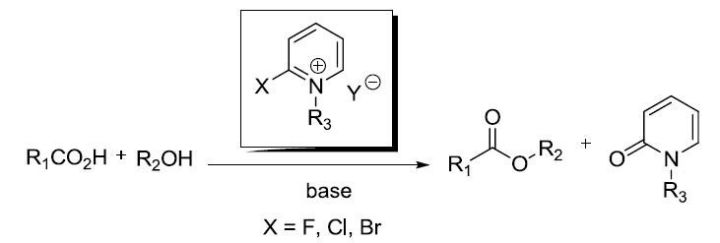
Mukaiyama试剂,2-卤-1-烷基吡啶盐(如2-氯-1-甲基吡啶盐)可用于酯化或酰胺化反应。 Mukaiyama氧化(MukaiyamaOxidation) Swern氧化虽说副反应少实用性高,但是必须要低温无水的条件,而且反应中同时生成有毒的一氧化碳和有恶臭的二甲基硫化物 Myers-Saito环化反应 丙二烯基烯炔在氢自由基供体(如1,4-环己二烯)存在下在加热或光照条件下构建取代芳环的反应。 Myers手性烷基化反应(MyersAsymmetric Alkylation) Nazarov环化反应
在酸催化下由二烯基酮电环化制备环戊烯酮的反应。 Neber重排反应
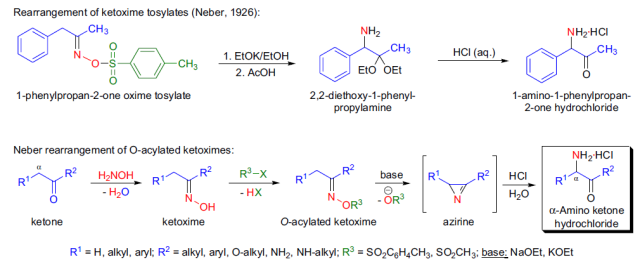
在碱诱导下由o-酰化酮肟重排生成相应的α-氨基酮的反应称为Neber重排。 Nef反应
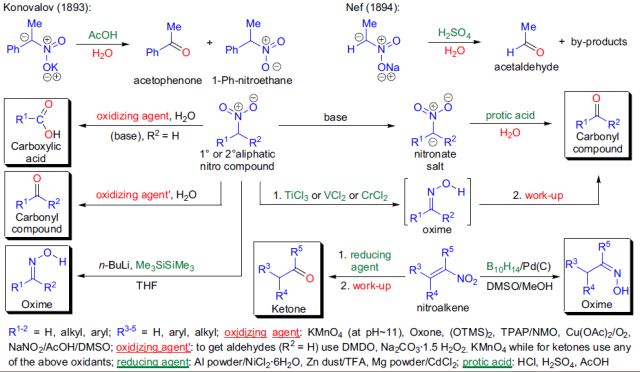
将硝基烷转化为相应的羰基化合物的反应被称为Nef反应。 Negishi 交叉偶联反应
在镍或钯催化下有机锌试剂和各种卤代物或磺酸酯(芳基,烯基,炔基和酰基)进行交叉偶联的反应。 Nenitzescu吲哚合成反应
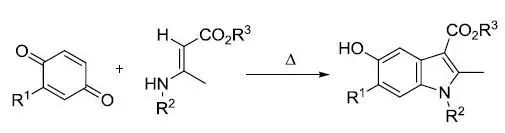
对苯醌和β-胺基巴豆酸酯缩合得到5-羟基吲哚的反应。 Newman-Kwart反应
将苯酚先转化为O-芳基硫代氨基甲酸酯,加热重排为S-芳基硫代氨基甲酸酯,接着水解为相应的苯硫酚的方法。 Nicholas反应
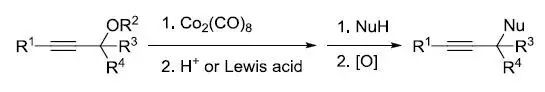
六羰基合钴络合的炔丙基正离子和亲核试剂反应,接着氧化脱金属得到相应的炔丙基化产物的反应。 Nicolaou IBX 脱氢反应
当量的IBX(o-iodoxybenzoic acid,邻碘酰基苯甲酸) 氧化醛酮制备α,β-不饱和醛酮的反应,另外与此反应相似的还有Saegusa氧化(钯催化)。烯醇硅醚也可以作为此反应的底物,进行脱氢反应。 Noyori不对称氢化反应
野依良治(R. Noyori)氢化催化剂是指手性双膦配体BINAP与金属钌(Ru)配位形成的手性配合物。此类催化剂可以还原脱氢氨基酸、烯胺、不饱和羧酸、酮酸酯和简单酮等化合物。 Nozaki–Hiyama–Kishi偶联反应
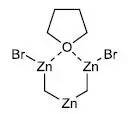
Nysted试剂
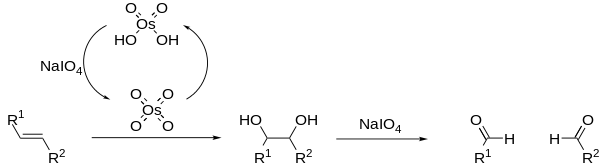
Nysted试剂,环-二溴-μ-亚甲基(μ-四氢呋喃)三锌,可以对醛酮进行烯化反应。 Oppenauer氧化 烷氧基金属盐催化剂催化下将二级醇氧化为酮的反应。 OsO4/NaIO4氧化合成醛
OsO4/NaIO4被称为Lemieux-Johnson试剂,此反应也被称为Lemieux-Johnson氧化。 Overman重排
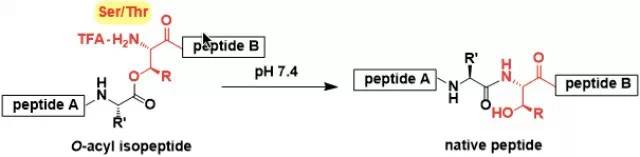
通过烯烃的1,3-位置互换将烯丙基三氯乙酰亚胺酯转化为烯丙基三氯乙酰胺进而将烯丙醇转化为烯丙胺的反应。 O-酰基异肽法(O-acylisopeptideMethod)
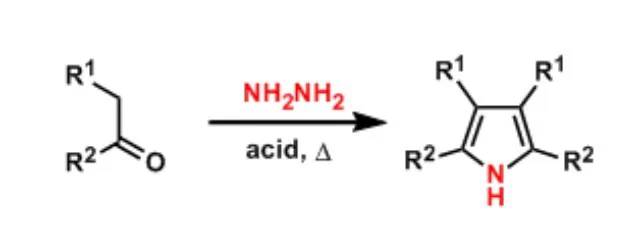
在丝氨酸-苏氨酸残基侧链上的羟基异构化成酯最终得到的肽被称为O-酰基异肽。 Paal–Knorr吡咯合成
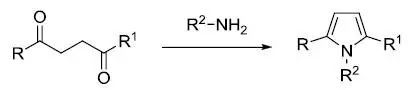
1,4-二酮和伯胺(或氨)反应制备吡咯的反应。此反应是Knorr吡唑合成的变体。 Paal–Knorr呋喃合成
酸催化下1,4-二酮环化得到呋喃的反应。 Paal噻吩合成
1,4-二酮在硫代试剂存在下加热脱水得到噻吩的反应。 Parham环化反应
烷基锂和芳基卤代物进行交换得到芳基锂,然后进行分子内的亲核加成得到关环产物的反应。 Parikh–Doering氧化 以二甲亚砜为氧化剂,固体三氧化硫-吡啶络合物为活化剂,三乙胺为碱而将伯醇和仲醇转化为相应的醛酮。 Passerini反应
羧酸,C-异氰化合物和羰基化合物三组分缩合得到α-酰氧基酰胺的反应,此反应与Ugi反应类似。 Paternó–Büchi反应
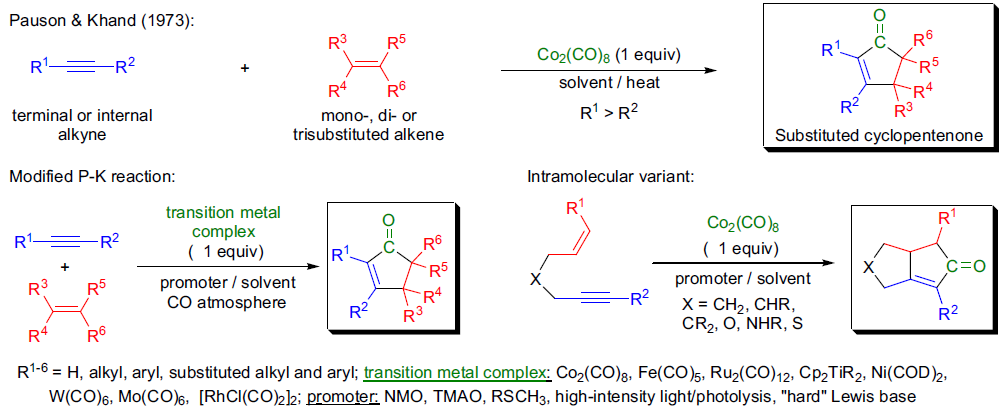
光诱导下羰基化合物和烯烃进行电环化得到多取代的氧杂环丁烷的反应。 Pauson-Khand反应
1973年,I.U.Khand 和P.L. Pauson报道了各种炔烃六羰基化钴络合物在烃类溶剂或醚中与烯烃反应得到很高产率的环戊烯酮的反应。 Pauson-Khand环戊酮合成 Payne重排
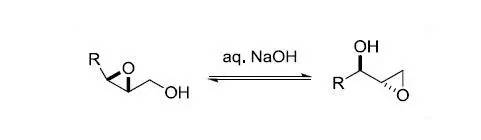
在碱性条件下2,3-环氧醇类化合物异构化得到1,2-环氧-3-醇的反应。此反应也被称为环氧迁移反应。 PCC(PyrindiumChlorochromate)氧化 PCC可以将伯醇和仲醇氧化成醛和酮。由于在有机溶剂中反应,一般不会将醇氧化到羧酸。但当反应体系中有水时,生成的醛酮会形成水合醛或水合酮,进而继续氧化得到羧酸。因此反应体系中要求无水。
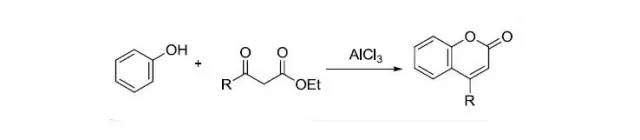
PDC(pyridiniumdichromate)氧化 将吡啶加入到三氧化铬的水溶液中有亮黄色的PDC固体生成,PDC溶于有机溶剂,在空气中室温下,易于储存和操作。在二氯甲烷的悬浮溶液中可以将醇氧化为醛酮( 与PCC氧化类似,惰性气体保护避免接触空气中的水。)。PDC用DMF当溶剂可以将伯醇氧化为酸。另外3Å分子筛,HOAc,PPTS,PTFA,Ac2O可以加快PDC的氧化速度。反应结束可以用亚硫酸钠快速淬灭反应。 Pechmann香豆素合成
Brønstedt酸或Lewis酸催化下酚和β-酮酯缩合得到香豆素类似物的反应。此反应也被称为von Pechmann 环化反应。 Perkin反应
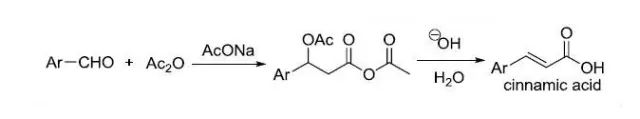
芳香甲醛和醋酸酐反应制备肉桂酸类似物的反应。 Perkow磷酸烯基酯的合成
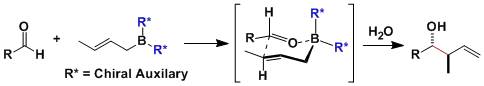
由α-卤代羰基化合物和三烷基亚磷酸酯制备磷酸烯基酯的反应。仲或叔卤代物由于位阻较难发生Michaelis-Arbuzov反应。 Petasis反应
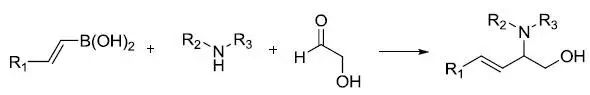
由芳基或烯基硼酸,羰基化合物和胺三组分反应制备苄基或烯丙基胺得到反应。 Petasis试剂
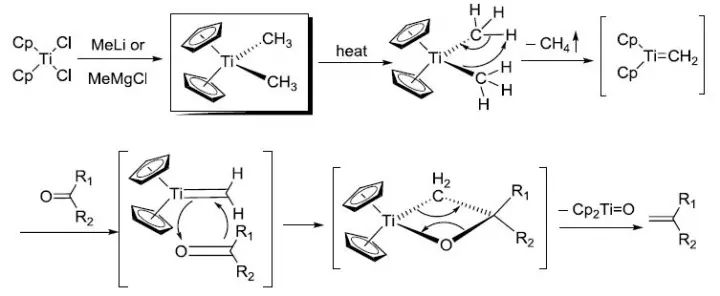
Petasis试剂(Cp2TiMe2),氯化二茂钛(Cp2TiCl2)和甲基锂(MeLi)或甲基格氏试剂(MeMgX)反应制备的亚甲基化试剂。 Peterson烯化反应
α-硅基碳负离子和羰基化合物反应先得到β-羟基硅烷,接着通过酸碱催化下消除得到烯烃的反应。此反应也被称为硅Wittig反应。 Pfitzner-Moffatt氧化反应 通过DCC和DMSO氧化醇得到醛酮的反应 Pictet–Gams异喹啉合成
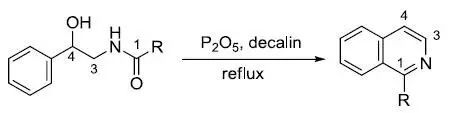
β-羟基-β-苯基乙胺的酰基衍生物在脱水试剂(如五氧化二磷或三氯氧磷)存在下在十氢化萘等惰性试剂中回流得到异喹啉类化合物的反应。
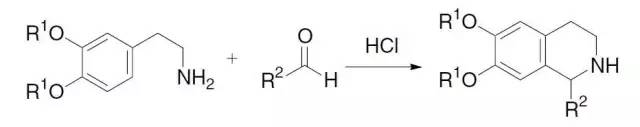
Pictet–Spengler四氢异喹啉合成
β-芳基乙胺和羰基化合物环化缩合得到四氢异喹啉的反应。 Piloty-Robinson Pyrrole Synthesis
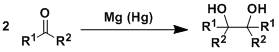
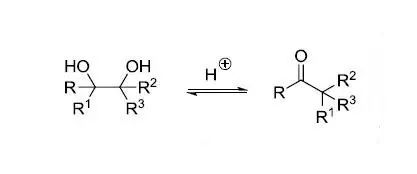
频哪醇偶联反应,又称醛酮的双分子还原偶联 Pinacol重排
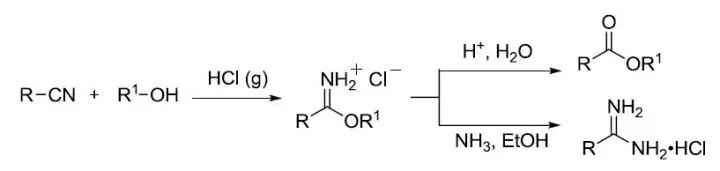
酸催化下邻二醇(频哪醇)重排得到羰基化合物的反应。 Pinner反应
将腈转化为亚胺酸酯,然后与水或氨反应制备酯或脒的反应。 Pinnick氧化
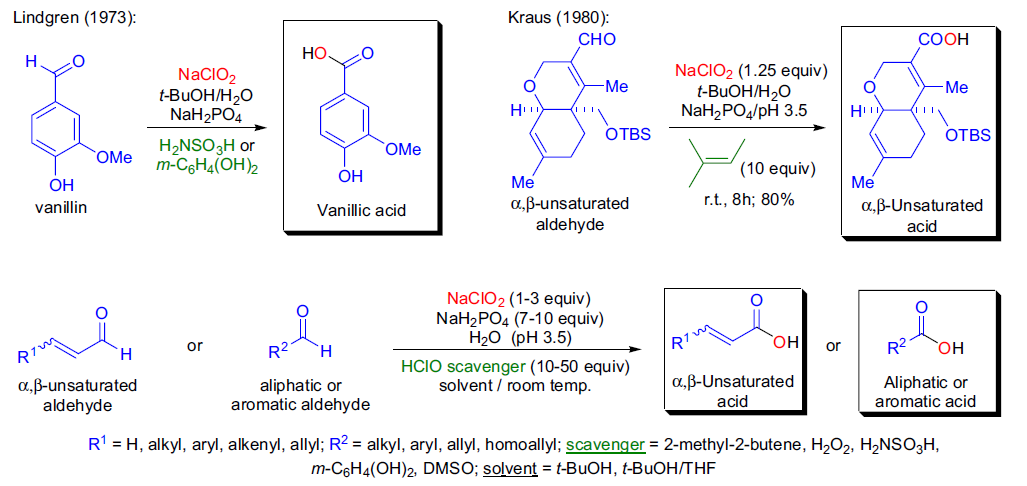
Pinnick氧化反应也被称为Lindgren氧化反应,这是一个选择性将醛氧化到相对应的羧酸的反应。 Polonovski反应
叔胺的氮氧化物用活性试剂(如乙酸酐)处理,重排生成N,N-二取代乙酰胺和醛的反应。 Polonovski–Potier反应
此反应是Polonovski反应的改进反应,但是反应条件温和,C-N键没有断裂,产物得到的是β-胺基α,β-不饱和三氟甲基酮。 Pomeranz–Fritsch 反应
在酸催化下氨基乙缩醛和苯甲醛反应得到异喹啉及其饱和衍生物的反应。 Povarov反应
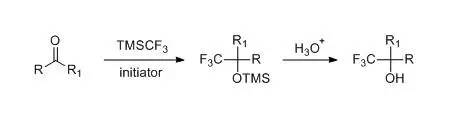
Povarov反应是一种反电子流向的氮杂DA反应(iEDDA),以N-芳基亚胺作为二烯体,以富电子烯烃作为亲二烯体进行[4 + 2]环加成得到四氢喹啉类产物或取代喹啉类的反应。 Prakash试剂 Prakash 试剂(TMSCF3)是非常一种重要的三氟甲基化试剂。
Prévost反式双羟化反应
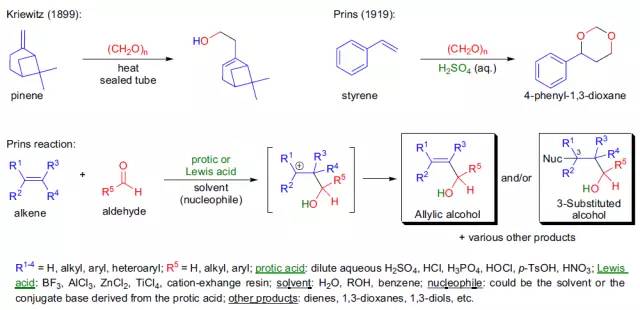
C. Prévost报道了利用苯甲酸银和碘氧化苯乙烯反应生成相应二醇的苯甲酸酯,水解从而得到1,2-二醇的反应。 Prilezhaev氧化反应 烯烃被过氧酸环氧化得到环氧乙烷的反应。 Prins反应
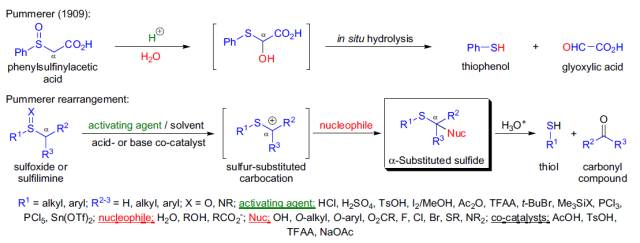
Pschorr环化反应 分子内的芳香自由基对另外一个芳环进行自由基取代关环得到二芳基三环化合物的反应。 Pummerer重排
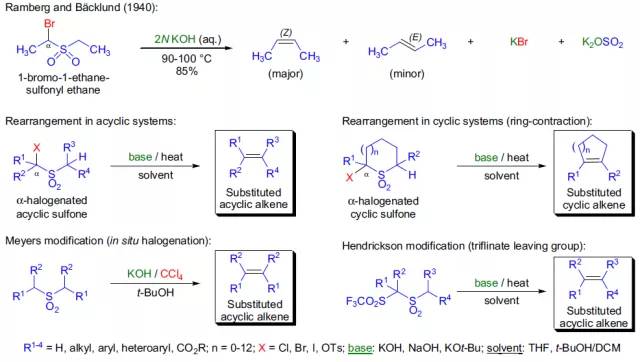
通过亚砜转化为相应的α-取代硫醚的反应被称为Pummerer重排。 Ramberg-Backlund重排
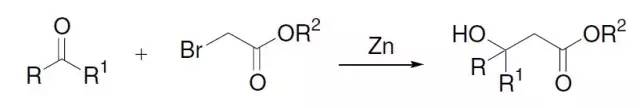
通过碱引发α-卤代砜经由一个三元环砜中间体重排为烯的反应称为Ramberg-Backlund重排。 Reformatsky反应
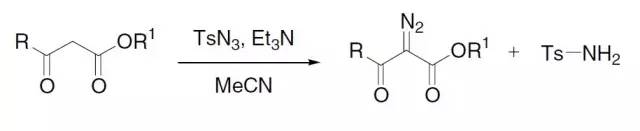
由α-卤代酯和锌粉制备得到的有机锌试剂对羰基化合物(醛、酮、酯)进行亲核加成生成β-羟基酯的反应。 Regitz重氮化合物合成
利用磺酰基叠氮与1,3-二羰基化合物或3-酮基酯反应得到 2-重氮基-1,3-二羰基化合物或2-重氮基-3-酮基酯的反应。 Reimer–Tiemann反应
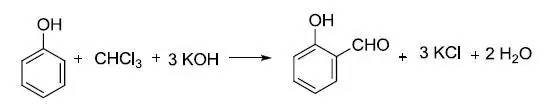
碱性条件下苯酚和氯仿反应生成邻甲酰基苯酚的反应。 Reissert反应
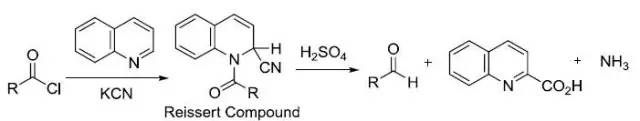
喹啉或异喹啉在酰卤和氰基源存在下进行三组分缩合得到Reissert化合物,而后水解得到醛,喹啉羧酸和氨气的反应。 Reissert吲哚合成反应 碱催化下邻硝基甲苯类似物和草酸乙酯缩合,进而还原,关环得到吲哚-2-甲酸类似物的反应。 Riley氧化
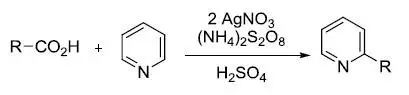
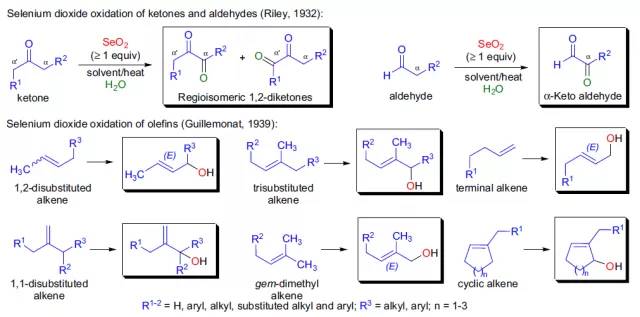
使用二氧化硒氧化羰基α位亚甲基或烯烃的烯丙位的反应都被称为Riley氧化反应。
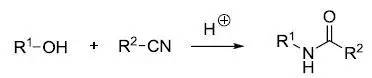
在强酸环境下醇和腈反应制备酰胺的反应。 Robinson–Gabriel反应
2-酰基胺基酮环化脱水得到2,5-二或2,4,5-三烷基,芳基或杂芳基恶唑的反应 Robinson关环反应
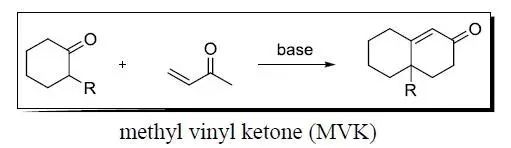
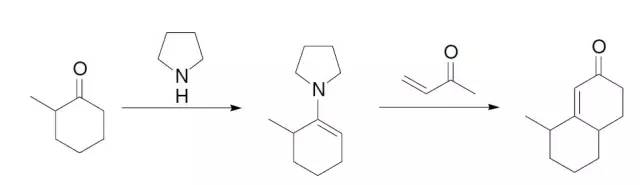
环己酮先对甲基烯基酮进行迈克尔加成,然后进行分子内的羟醛缩合关环得到六元环的α,β-不饱和酮的反应。 Robinson-Schöpf反应
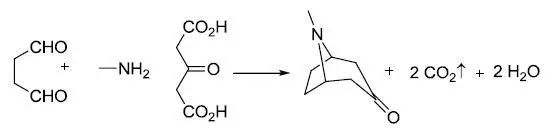
1,4-二醛,3-酮基-1,5-戊二酸和伯胺缩合得到托品酮类化合物的反应。 Rosenmund-von Braun反应 芳基卤化物和过量的氰化亚铜在高沸点极性溶剂(如DMF,硝基苯和吡啶)中回流反应得到芳基腈类化合物的反应。 Rosenmund还原
酰氯在BaSO4,喹啉-S或硫脲钝化的Pd催化剂的催化下氢化还原得到醛的反应。 Roskamp-Feng反应
1989年,Roskamp首先报道了利用氯化亚锡催化乙基重氮乙酸乙酯和醛反应制备β-酮酯的反应【J. Org. Chem.,1989, 54, 3258】。经过二十多年的发展各种路易斯酸(Sc(OTf)3,BF3, GeCl2)都可用于此反应。2011年,四川大学化学学院冯小明教授,以手性氮氧–Sc(OTf)3络合物催化剂实现了首例催化不对称Roskamp反应。 Rubottom氧化反应 烯醇基硅烷用mCPBA氧化,水解得到α -羟基化产物的反应。 Rupe重排
酸催化下α-炔基叔醇重排生成α,β-不饱和酮的反应。 史氏不对称环氧化反应
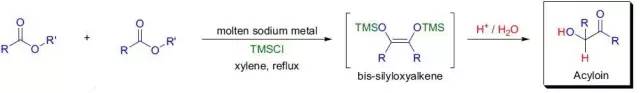
Saegusa氧化反应
钯催化下将烯醇基硅烷转化为α,β-不饱和酮的反应。此反应也被称为Saegusa–Ito氧化反应。 Sakurai allylation reaction
Lewis酸催化下烯丙基硅烷作为碳亲核试剂进行烯丙基化的反应。此反应也被称为Hosomi–Sakurai反应。 Sandmeyer反应
Sanford反应
在钯催化下通过导向基团(如吡啶和嘧啶)进行C-H位乙酰氧基化得反应. Sarett-Collins氧化(Sarett-Collins Oxidation)
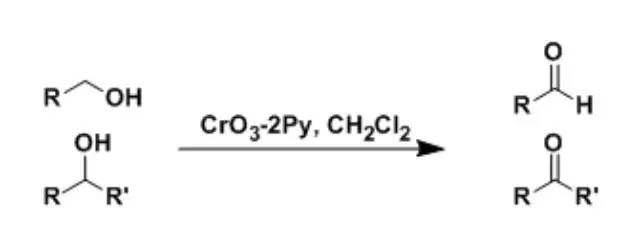
1953年、Sarett等人报道了用无水铬酸酐的吡啶溶液进行醇羟基的氧化反应。之后,1968难Collins等人,结晶出了红色的CrO3・2Py晶体,在二氯甲烷中进行同样的氧化反应,作为改良法被推广使用。 Schiemann反应
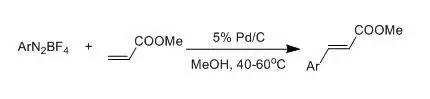
由芳胺制备四氟硼酸的芳香重氮盐(ArN2+BF4-)热分解得到芳香氟化物的反应。此反应也被称为Balz-Schiemann反应。 Schlittler–Müller反应
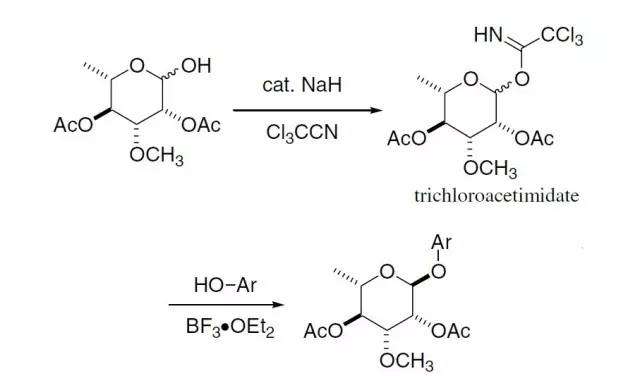
苯乙胺和醛基乙缩醛缩合并在酸性条件下关环得到异喹啉的反应 Schmidt 三氯乙酰亚胺酯糖苷化反应
在路易斯催化下糖的三氯乙酰亚胺酯对醇或酚进行糖苷化的反应。 Schmidt重排
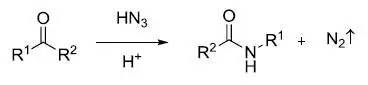
Schmidt反应是指酸催化下叠氮酸或叠氮化合物和亲电试剂(羰基化合物,叔醇和烯烃)反应重排放出氮气得到胺,腈,酰胺或亚胺的反应。 Scholl反应
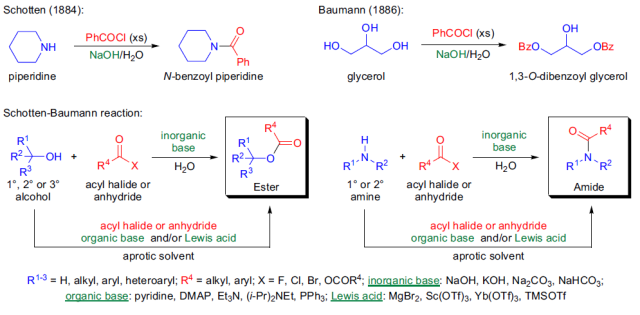
在Friedel-Crafts反应催化剂催化下消除两个芳基氢形成芳基-芳基键的反应。 Schotten-Baumann反应
在碱的水溶液催化下,醇或胺与酰卤或酸酐反应制备酯或酰胺的反应被称为Schotten-Baumann反应。 Seyferth-Gilbert增碳反应 Seyferth-Gilbert增碳反应是指在碱催化下重氮甲基膦酸二甲酯与醛或芳基酮在低温下反应得到炔的反应。 Shapiro反应
在丁基锂催化下醛酮的苯磺酰基腙分解并和亲电试剂反应生成烯的反应。 Sharpless不对称羟胺化
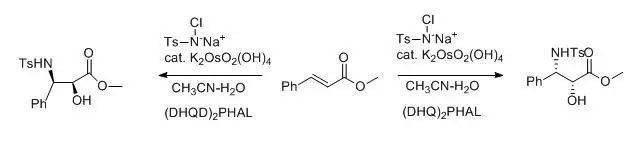
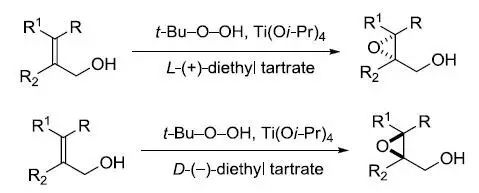
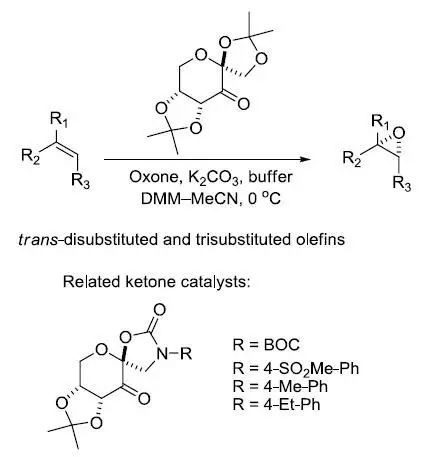
Sharpless不对称环氧化反应
叔丁基过氧化氢,钛酸四异丙酯和单一构型的酒石酸二乙酯对烯丙醇进行对映选择性的环氧化的反应。 Sharpless不对称双羟基化反应 RL:最大取代基,RM中等取代基,Rs:最小取代基。 含有(DHQ)2-PHAL的催化剂为ADmix-α (DHQD)2-PHAL
含有(DHQD)2-PHAL的催化剂为ADmix-β 锇催化剂和金鸡纳碱衍生物催化下烯烃对映选择性顺式双羟基化反应。 Sharpless烯合成反应
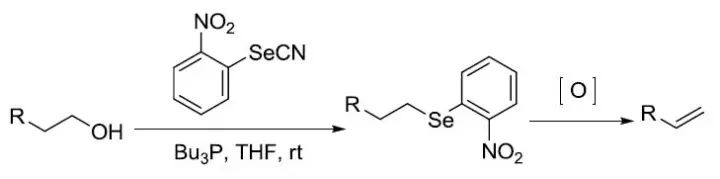
由邻硝基苯硒氰、Bu3P和醇反应得到的邻硝基苯硒醚经氧化順式消除制备烯烃的反应。 Shiina大环内酯化反应
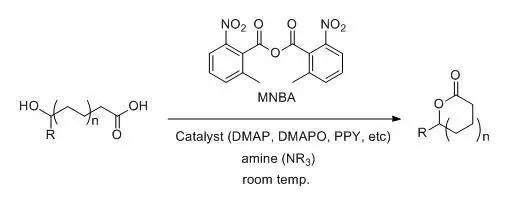
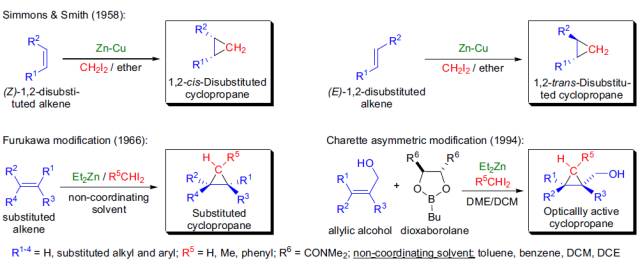
羟基羧酸利用2-甲基-6-硝基苯甲酸酐(MNBA; Shiina试剂),催化量的缩合剂(DMAP, DMAPO, PPY, etc)和三级胺,在温和的条件下进行大环内酯化的反应。 Simmons-Smith环丙烷化反应
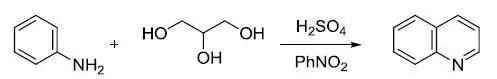
1958年,H.E. Simmons和R.D.Smith首次利用二碘甲烷和锌铜偶(Zn-Cu)将无官能团烯烃(如环己烯,苯乙烯)具有立体选择性地转化为环丙烷。这一反应后来得到普遍使用,并且是一种非常高效的制备环丙烷的反应,此反应以发现者Howard EnsignSimmons, Jr.和R. D. Smith命名--- Simmons-Smith环丙烷化反应。 Skraup喹啉合成
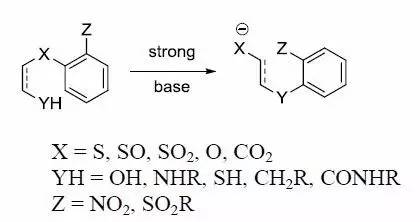
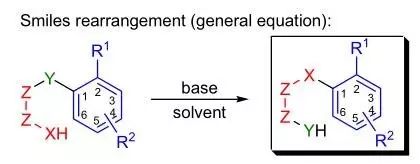
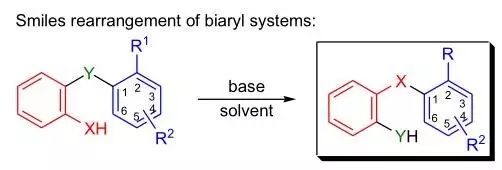
苯胺,甘油,硫酸和氧化剂(如PhNO2)反应制备喹啉的反应。 smile重排反应 分子内的芳香亲核重排反应。
Sommelet–Hauser重排
苄基季铵盐在氨基碱金属化合物的作用下得到铵叶立德中间体,接着进行[2,3]-Wittig重排生成邻甲基苄胺的反应。 Sommelet反应
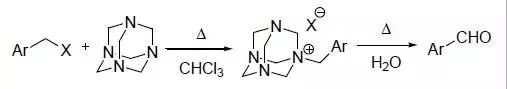
卤化苄在六甲基四胺(HMTA)的作用下转化为相应的芳基甲醛的反应。 Sonogashira反应
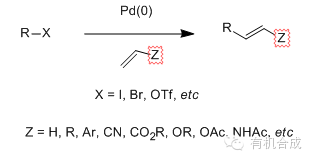
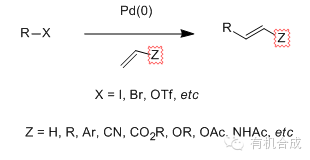
Pd/Cu催化的芳卤或烯基卤代物和端基炔进行偶联的反应。 Staudinger还原 叠氮化合物和三级膦(如, Ph3P)反应得到偶磷氮基化合物(如膦亚胺)中间体,水解得到相应的胺的反应。 Staudinger烯酮环加成反应
烯酮分别和亚胺,烯烃或羰基进行[2 + 2]环加成得到β -内酰胺,环丁酮或β -内酯的反应。 Steglich酯化反应
在DMAP催化下,以DCC为偶联试剂的酯化方法。 Sternbach苯二氮䓬合成
胺与3-氧喹唑啉反应得到重排产物1,4-苯二氮䓬。 Stetter反应
醛和α,β-不饱和酮在噻唑盐的催化下反应制备1,4-二羰基化合物的反应。 Stevens重排
在强碱作用下与氮相连的碳中有一个碳连有吸电子基团的季铵盐重排得到叔胺的反应。 Stille-Kelly反应
钯催化下分子内的二芳基卤代物利用二锡试剂进行交叉偶联的反应。 Stille偶联反应 Stille偶联反应是指有机锡试剂和卤代物或类卤代物在钯催化下进行CC键偶联的反应。此反应对卤代物的R基团限制较少。反应的条件比较多,另外正如下方介绍的卤代物和有机锡试剂种类很多,互相进行偶联,因此此反应可以合成的产物也很多。 Still–Gennari 反应
1983年W.C.Still 和 C. Gennari第一次应用HWE反应的改进法通过醛制备(Z)-构型烯烃。膦酸二(三氟乙基)酯和醛在强碱条件下制备(Z)-α,β-不饱和酮或酯的反应。 Stobbe缩合反应
丁二酸二乙酯及其衍生物和羰基化合物在碱性条件下进行缩合的反应。 Stork–Danheiser反应
β 烷氧基烯酮和有机金属化合物(格氏试剂或有机锂)反应接着进行酸处理得到另一种烯酮的反应,新生成的烯酮的羰基的位置是原料中烯醇醚的烯碳的位置。 Stork烯胺烷基化反应
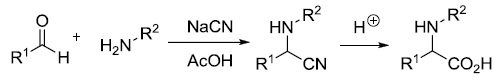
此反应是Robinson关环反应的一个变体,大位阻的胺如吡咯烷与羰基化合物形成烯胺,接着在位阻较小的一侧与甲基乙烯基酮进行共轭加成。 Strecker氨基酸合成反应
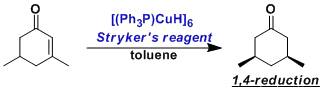
氰化钠,醛酮和胺进行缩合得到α -氨基腈,水解得到α -氨基酸的反应。 Stryker试剂(Stryker’sReagent)
三苯基磷亚铜(I)六聚体,通称为Stryker试剂。该试剂对热稳定,可以提供质子源,用于1,4-还原反应。 Suzuki–Miyaura反应
在碱存在下有机硼试剂和芳香或烯基卤代物(或芳香三氟甲磺酸酯)在钯催化下进行交叉偶联的反应。 Suzuki-镍催化Suzuki偶联反应 Swern氧化反应
利用草酰氯,DMSO和三乙胺将醇氧化为相应的羰基化合物的反应。 Takai反应 二价铬,醛和卤仿反应生成相应的(E)-烯基卤代物的反应叫Takai反应(Takai-Utimotoolefination)
含有烷氧基等的杂原子取代基的有机硅化合物在含氟化合物以及弱碱性的条件下、由过氧化氢氧化为醇。 相关反应:Fleming-Kumada oxidation, Tebbe试剂
Tebbe试剂, μ-氯(二环戊二烯基)(二甲基铝基)-μ-亚甲基钛【μ-chlorobis(cyclopentadienyl)(dimethylaluminium)-μ-methylenetitanium】。 TEMPO氧化 TEMPO = 四甲基六氢吡啶氧化物。2,2,6,6-四甲基哌啶氧自由基是一种很稳定的氮氧自由基,在此氧化反应中充当催化剂。 TEMPO氧化醇到醛酮
TEMPO = 四甲基哌啶氧化物。2,2,6,6-四甲基哌啶氧自由基是一种市售的很稳定的氮氧自由基化合物,在此反应中充当催化剂。 仲醇氧化到酮就会停止,但醛可能会继续氧化生成羧酸,但反应速度很慢,另外必须加入过量的次氯酸钠才可以继续氧化。具体内容参考往期发布的:TEMPO氧化。 Thorpe-Ziegler反应
Thorpe-Ziegler反应,在碱催化下分子内的两个氰基缩合得到亚胺进而异构化得到烯胺的反应。 Tiffeneau–Demjanov重排
β-胺基醇重氮化通过碳正离子重排C-C迁移得到羰基化合物的反应。 Tishchenko反应
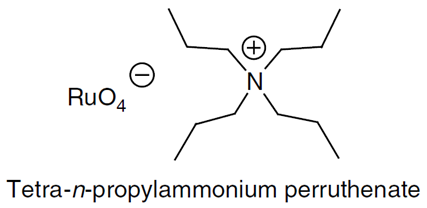
Tishchenko反应,两分子的醛通过歧化反应制备酯的反应。 TPAP (Ley-Griffith)氧化反应 TPAP是一个温和的、在中性条件下使用的氧化试剂 Ley-Griffith氧化反应 Trost氧化(TrostOxidation)
一级,二级醇共存的情况下,选择性氧化二级醇的反应。 Truce-Smile重排
此反应是Smile重排中Y为碳原子的特殊情况。 Tsuji-Trost反应
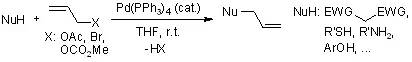
钯催化下亲核试剂(如活性亚甲基化合物,烯醇化合物,胺和酚)对烯丙基化合物(如乙酸烯丙酯和烯丙基溴)亲核取代进行烯丙基化的反应。 使用等当量的Wilkinson催化剂或Pd/C作用于醛类化合物,引起脱羰基反应,得到烷烃产物。 U. Schollkopf法合成手性氨基酸
Ugi反应
羧酸,C-异腈,胺和羰基化合物进行四组分缩合得到二酰胺(二肽)的反应。 Ullmann醚合成(UllmannEther Synthesis)
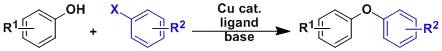
苯酚・醇类与卤代芳烃之间通过铜催化形成芳基醚的合成手法。 Ullmann偶联反应
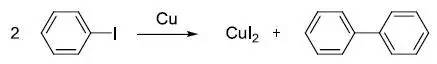
碘代芳烃在Cu , Ni 或Pd 催化下进行自身偶联得到二芳基化合物的反应。此反应是合成联芳基化合物的方法之一。该偶联反应多用于同种芳基卤的自偶联,不常用于两种卤代芳烃的偶联来合成不同官能团的联芳基化合物。 van Leusen噁唑合成反应
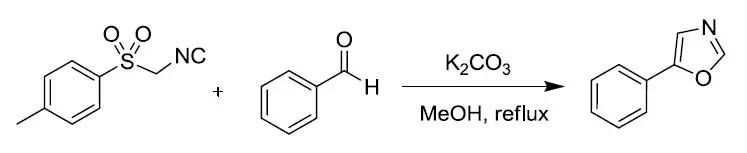
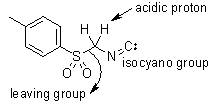
对甲苯磺酰基甲基异腈(TosMIC,van Leusen试剂)和醛在质子性溶剂中回流得到5-取代噁唑的反应。
Van Leusen咪唑合成反应
醛亚胺和对甲苯磺酰基甲基异腈(TosMIC)在碱性条件下关环制备咪唑的反应。 Van Leusen反应 酮和对甲苯磺酰甲基异腈(TosMIC)一锅法反应得到多一个碳的腈的反应。
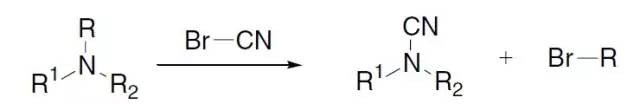
Vilsmeier–Haack试剂是一种氯代亚胺盐,弱亲电试剂。因此Vilsmeier–Haack 反应对于富电子的碳环或杂环反应活性更高。 Vinylcyclopropane-cyclopentene rearrangement(乙烯基环丙烷-环戊烯重排) 乙烯基环丙烷通过双自由基中间体转化为环戊烯的反应。 von Braun反应
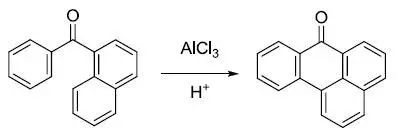
利用溴化氰处理三级胺得到氰基胺和卤代烷的反应。 Wacker氧化反应 氯化钯和氯化铜催化下烯烃氧化得到酮的反应,少数情况下可以氧化为醛。 Wagner–Meerwein重排
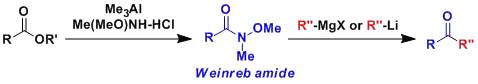
酸催化下醇的烷基进行迁移得到多取代烯烃的反应。 weinreb酰胺制备酮
N-甲氧基-N-甲基酰胺俗称Weinreb酰胺、它能与Grignard试剂或有机锂试剂反应生成酮。 Weiss–Cook缩合反应
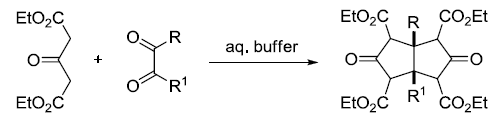
3-羰基戊二酸酯和邻二羰基化合物在缓冲溶液中缩合得到顺式-双环[3.3.0]辛烷-3,7-二酮(cis-bicyclo[3.3.0]octane-3,7-dione)的反应。产物极易脱羧。 Wenker反应 由1,2-胺醇制备氮杂环丙烷的反应。 Wharton反应
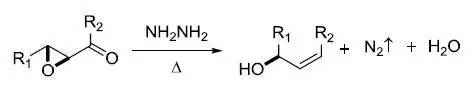
利用肼还原α,β-环氧酮得到烯丙醇的反应。 Willgerodt–Kindler反应
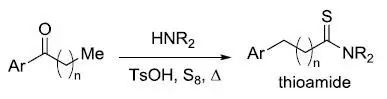
芳基酮通过羰基迁移制备链端硫代酰胺的反应。 Williamson醚合成反应
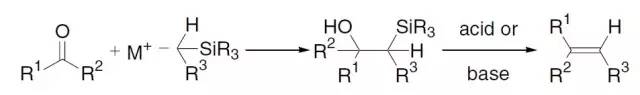
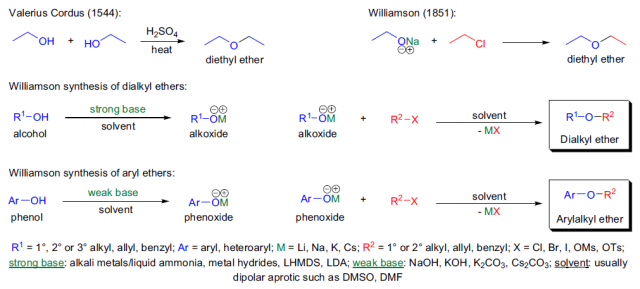
此类有脂肪烷氧盐或芳香酚盐和烷基、烯丙基或苄基卤代烃反应生成相应的醚的反应称为Williamson醚合成反应。 Wittig反应
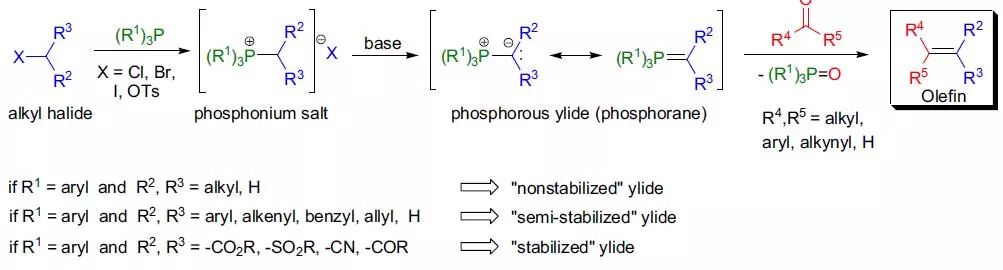
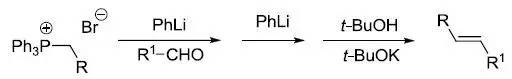
膦叶立德和羰基化合物作用制备烯烃反应被称为Wittig反应。 Wittig-Schlosser反应
本反应也被称为Wittig反应Schlosser改进法,常规的Wittig反应中叶立德和醛反应得到是Z构型的烯烃,而此反应生成的是E构型的烯烃。 Wohl–Ziegler反应
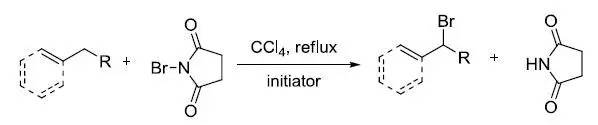
NBS(N-溴丁二酰亚胺)在自由基引发条件下对烯烃的烯丙位或芳烃的苄位进行取代得到烯丙基溴或苄溴的反应。 Wolff–Kishner还原 醛类或酮类在碱性条件下与肼作用,羰基被还原为亚甲基。 Wolff重排
α-重氮酮重排得到烯酮的反应。 Woodward顺位双羟化反应
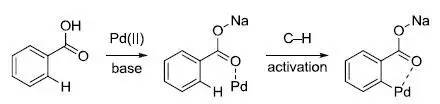
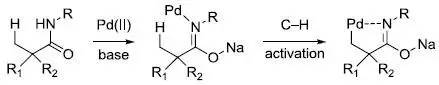
反应机理和Prévost 反式双羟化反应。 余金权C−H活化反应 余金权及其课题组1,7发现一些位置选择性或立体选择性的C-H活化反应,此类反应的特点是利用钯催化并加入氧化剂,通常底物含有导向基团,另外加入一些优化的配体会增强选择性和加快反应速率。 经典的 sp2 杂化C−H 活化:
经典的 sp2杂化C−H 活化:
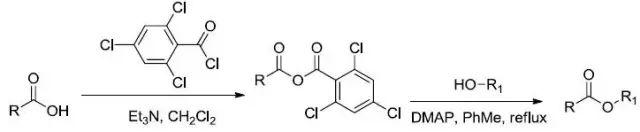
Yamaguchi酯化反应
该反应最早是由日本九州大学的Masaru Yamaguchi在1979年报道的。 羧酸和2,4,6-三氯苯甲酰氯作用生成混酐使羧酸得以活化,继而在DMAP的催化下与醇反应生成酯。 张绪穆烯炔环异构化反应
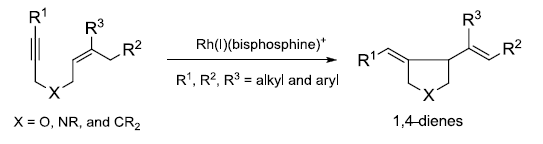
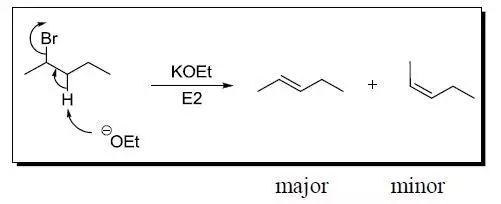
1,6-烯炔类化合物在膦配位的铑催化剂的催化下进行高区域选择性的进行不对称环化异构化生成五元杂环化合物的反应。 Zaitsev消除规则
扎伊采夫(Zaitsev,也译作查依采夫等)规则1875年由A.M.扎伊采夫提出。 Zimmerman重排
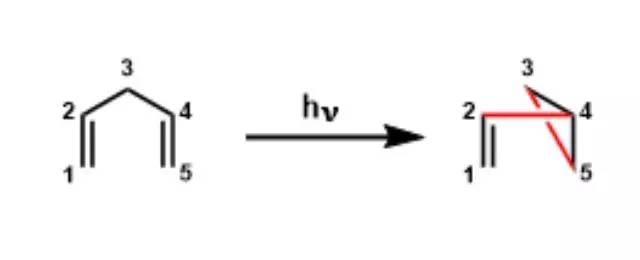
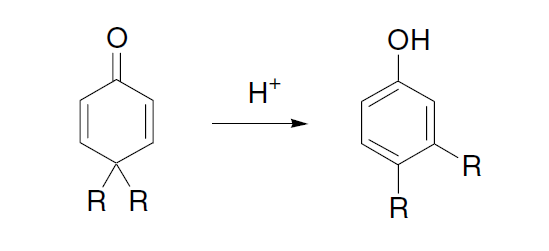
1,4-二烯类化合物在光照条件下转化为烯基环丙烷的反应。也被称为双-π-甲烷重排(Di-π-methane rearrangement)。 Zincke反应 N-(2,4-二硝基苯基)吡啶盐(Zincke盐)与苯胺或脂肪胺作用进行胺交换生成相应的N-芳基或N-烷基吡啶盐的反应。 Zinin联苯胺重排 酸催化下氢化偶氮苯重排得到4,4-二氨基联苯 (benzidine)和2,4-二氨基联苯的反应。 二苯乙醇酸重排反应 苯偶酰通过苯基重排得到二苯基乙醇酸的反应。 二烯酮苯酚重排
4,4-二取代环己二烯酮在酸催化下重排为3,4-二取代苯酚的反应。 不对称丙烯基硼化Asymmetric Allylboration
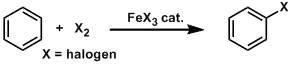
二氧化硒氧化(SeleniumDioxide) 叠氮-炔环加成 芳香环卤化反应Halogenation of Aromatic Ring
芳香杂环Heck反应
芳香杂环作为受体的发生在分子内或分子间的Heck反应。 重氮盐参与的Heck反应
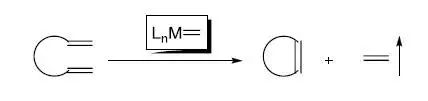
非均相催化还原(HeterogeneousHydrogenation) 均相加氢Homogeneous Hydrogenaton 芳香卤代烃在金属催化作用下的腈化反应 关环复分解反应【Ring-closingmetathesis (RCM)】
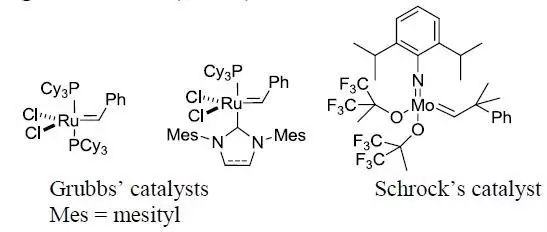
是指在金属催化下的碳碳双键的切断并重新结合进行关环的反应。是烯烃复分解反应中的一种。 常见的催化剂:
烯烃交叉复分解反应 两种端基烯烃在Ru(II)-卡宾(Grubbs Catalyst)催化下,放出乙烯的烯烃复分解反应。从统计学来看,反应应该生成三种可能的几何异构体,再加上每种异构体各有 E/Z构型,因此共有六种产物。 金属氢化物的还原反应
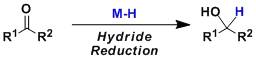
羰基化合物被金属氢化物还原生成醇。已知有各种各样的强度性质不同的还原剂。以容易得到,使用方便等实用性来考量,最多被使用的有以下还原剂。 加氢金属化反应Hydrometalation 金属卡宾的环丙烷化反应(Cyclopropanationwith Metal Carbenoid)
在金属催化剂存在下,重氮化合物分解生成卡宾活性种,继而与烯烃双键反应生成环丙烷的手法。 金属催化C-H活化(CatalyticC-H activation)
对惰性的C-H键进行直接的切断,重组,连接上不同的官能团的十分有用的手法。
偶氮偶合反应(Azo coupling)在染料、色淀和色素生产方面是一个应用非常广泛的反应。在此反应中芳基偶氮离子作为亲电试剂对活性芳烃(如苯胺或苯酚)进行亲电取代得到二芳基偶氮化合物。 活性二氧化锰氧化 交叉脱氢偶联反应(CrossDehydrogenative Coupling (CDC)) 在两个底物的C-H被活化的情况下,利用氢acceptor(氧化剂)的作用,进行的交叉型C-C偶联反应。如果氧化剂是分子状的氧气的话,理论上生成的副产物就是水而已,这样这样的反应就是非常优秀的绿色化学。因此,一旦实现的话这个反应也被认为是终极的,最理想的反应形式。 氘氢标记反应(DeuteriumLabeling Reaction)
过氧化酮氧化(Oxidationwith Dioxirane)
还原缩醛法合成醚(EtherSynthesis by Reduction of Acetal) 缩醛在酸性条件下生成的氧鎓阳离子被还原后形成醚的合成方法。 红铝氢化还原(Red-Al)
红铝的英文商品名称为Red-Al,Red应该是还原的简称,不过翻译是误将 Red 翻为红,因此中文译名误译为「红铝」,若依其原來英文商品名称的意义来看,应译为「还原铝」。 环化异构化反应(Cycloisomerization)
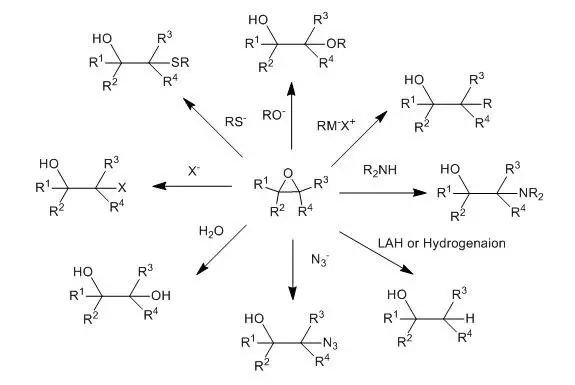
环氧化合物制备醇 通过对环氧化合物的亲核加成或直接还原可以得到各种各样的醇。
不对称环氧化合物的选择性开环 自Sharpless环氧化反应问世以来,各种环氧化产物的选择性开环方法层出不 穷, 不同方式开环得到的产物均具有很高的合成应用价值,下面提到的环氧 底物主要是Sharpless反应后的产物,底物结构中的羟基对这些开环氧反应具有关键的导向作用。下面是几个典型的例子。 由醇制备烷烃
康福斯重排反应(CornforthRearrangement)
4位有羰基取代基的恶唑在加热条件下发生重排,噻唑也同样有相似的重排反应发生。 李朝军三组分反应
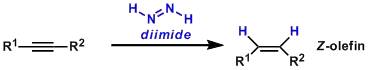
联亚胺法还原(DiimideReduction)
联亚胺法还原通常是把炔烃还原成Z-烯烃的方法。 邻位金属化反应(Directedortho Metalation) 烷基锂化合物和带有邻位导向基团 (Directed Metalation Group--DMG)的芳烃反应得到邻位金属中间体。 面包酵母不对称还原酮 强酸脱甲基反应 这是最为经典和简单的甲基芳基醚水解去甲基的方法。一般使用过量的浓HI酸回流下、或者大大过量的48% HBr或37% HCl在HOAc或Ac2O中回流,反应完后,浓缩去除过量的酸,加入水,用有机溶剂萃取,然后进一步纯化即可。特点是操作和后处理简单、方便。但要求底物对强酸稳定,对于有些底物,易形成卤代苯副产物。 三卤化铝脱甲基反应
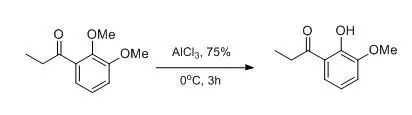
AlCl3/CH3CN和AlBr3/CH3CN是【Bull. Chem. Soc. Jpn., 1995, 68, 2033】一类常用的去甲基化方法,其操作类似BBr3的使用,只是一般反应温度在0℃到室温。另外加入硫化物,由于硫的亲核性更强,可以增加反应活性。AlBr3/EtSH,AlCl3/EtSH, AlCl3/HSCH2CH2SH体系的活性很高,分子中酯、醛、酮、双键不稳定,但酯在AlCl3/EtSH/CH2Cl2体系相对稳定。 羟基的选择性氧化综述
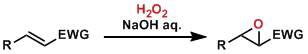
亲核环氧化反应(NucleophilicEpoxidation with Peroxide)
大多数的环氧化合物都是通过烯烃与过氧化物(能给出单个氧原子的试剂)反应得到的。 炔烃的环化三聚(Cyclotrimerizationof Alkynes)
史氏不对称环氧化反应
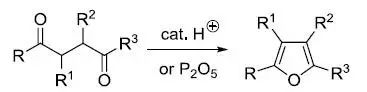
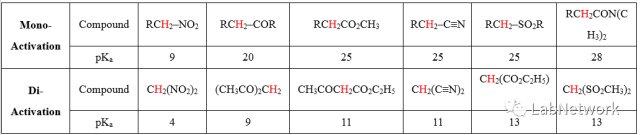
双活化底物的烷基化 碳-碳键的构建在有机化合物的合成中占有极其重要的地位,其中一种常用并且有效的构建方式便是在活性基团活化的α碳上的烷基化反应。 所谓的活性基团是因为电负性的差异所导致的,理论上电负性大于碳的原子与碳相连都可以使碳活化,但活化效果各有差别,其中常见的活化基团如下表所示(Acc. Chem. Res. 1988, 21, 456-463): Table 1 Acidity of α-Hydrogens in Mono- and Di-ActivatedCompounds
其中我们可以简单总结出以下的活化顺序:NO2 > COR > CN ~ CO2R ~ SO2R> Ph ~ SR > H > R。 四氧化锇氧化 在催化量的四氧化锇和共氧化剂的存在下,烯烃被氧化成邻二醇。通过其他的试剂较难实现的烯烃转化成邻二醇通过此方法能很温和平稳的进行。尽管锇价格相对昂贵,毒性很大,但四氧化锇作氧化剂进行烯烃的双羟基化是一种较好的顺式羟基化的方法,收率高。 羰基的选择性反应 羰 基 是 另 一 类 重 要 官 能 团, 经 常 被 用 来 进 行 研 究 选 择 性 反 应。 如 α, β - 不 饱 和 酮 和 饱 和 酮 由 于 它 们 的 电 子 离 域 情 况 不 同, 亲 核 性 还 原剂 H负 可 选 择 性 地 进 攻 饱 和 酮, 而 亲 电 性 试 剂 B2H6 则 可 选 择 与 不 饱 和 酮 反 应。
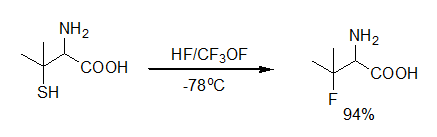
羰基化偶联反应Carbonylative Cross Coupling 利用一氧化碳能插入碳-金属键这一特性,在偶联反应中同时引入羰基,生成酯,酰胺,酮,醇等产物。在有机合成中是一个非常有效率的反应。常用于钯催化偶联反应。 我们知道一氧化碳很容易插入碳-金属键之间。用钯催化剂,有基卤化物,一氧化碳,醇一起反应会生成酯。用胺代替其中的醇会得到酰胺,用氢源替代醇会得到醛,换成有机金属试剂就会得到酮。 脱羧偶联反应 脱羧偶联反应是指利用金属催化剂实现羧酸类化合物脱羧并在原来的羧酸位点生成新的碳-碳键的化学反应。广义上来说,也可以将金属催化羧酸脱羧并生成碳杂原子化学键(碳-氧,碳-硫,碳-氮键等)的反应归类为脱羧偶联反应。[1, 2, 3]传统有机化学中的脱羧反应主要利用了氧化羧酸生成自由基的过程。芳基和烯基(Csp2-COOH) 羧酸的脱羧偶联反应主要利用金属催化实现氧化还原中性条件下的脱羧,并且生成金属有机中间体,从而实现与亲电试剂或者在氧化性条件下与亲核试剂的偶联成键。虽然一些活化的烷基羧酸可以在金属催化剂催化下通过生成金属有机中间体的历程进行非自由基脱羧偶联。但是,针对金属催化剂催化烷基羧酸(Csp3-COOH)的脱羧困难问题,一些烷基羧酸的脱羧偶联反应仍然需要通过自由基反应机理进行。值得指出的是,最近,MacMillan等人成功将光氧化还原催化剂与镍催化剂结合,通过结合光催化与金属有机催化的混合手段,实现了氨基酸和非活化烷基羧酸的脱羧偶联。[4] 脱硫氟代反应 和氧一样,含硫化合物如硫醇,硫缩酮,硫缩醛以及硫羰基化合物在氟代试剂的作用下,碳硫键断裂,硫原子被氟取代,生成相应的氟化物。这个方法于1976年由Kollonitsch和Marburg首次报导。和氧相比,硫更容易被取代。常用的试剂包括HF/CF3OF,HF/F2,HF/Pyridine,Bu4NH2F3,Tol-IF2,SF4,FBr3,MoF6和DAST等。 硫醇被氟取代生成相应的一氟代化合物【J. Org. Chem. 1976, 47, 3107】。
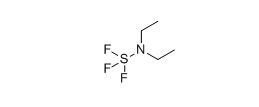
脱氧氟化Deoxyfluorination
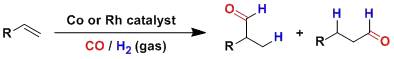
有机氟化合物向来在有机化学中占有举足轻重的位置。这里介绍了以DAST为代表的几种能够直接将碳氧键转化为碳氟键的氟化试剂。最近在sp2碳氟键的生成上也有进展。 烯基加氢甲酰化反应Hydroformylation
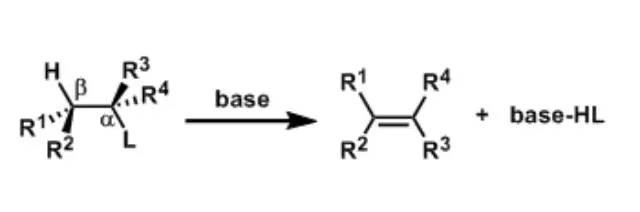
用一氧化碳和氢气的混合气体使烯基反应成为增长一个碳的醛的反应。常用的催化剂有铑或钴配体。钴催化剂相对比较便宜(Co2(CO)8),而铑比较贵但是催化活性更好,适合实验室小量反应研究使用。反应用到气体所以很适合工业生产,是非常实用的一个反应。 烯烃双羟化反应 在不同的条件下,烯烃双羟基化可以得到顺式和反式邻二羟基化合物。顺式双羟基化常用试剂为高锰酸钾,四氧化锇及碘-湿乙酸银。反式羟基化最常用的方法是过氧酸法,另外,Prévost反应也常用。 消除反应(EliminationReaction)
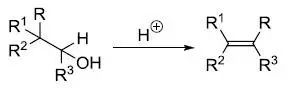
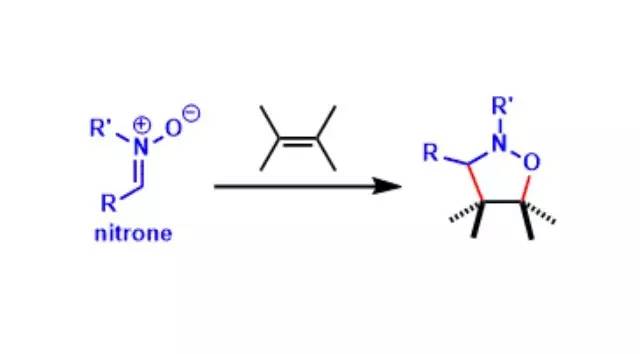
消除反应(Elimination Reaction)通常定义为从一个分子中失去部分原子或者官能团,形成多键的反应。 离去基团链接的碳(α碳)的邻位(β位)的氢被脱氢后一起离去的反应被称为β消除反応,拔氢的氢与离去基在同一个碳上的消除反应被称为α消除反应。通过α消除反应可以生成卡宾。 硝酮的1,,3-偶极子环化(1,3-DipolarCycloaddition of Nitrone)
硝酮是一种1,3-偶极子,可以通过不饱和烯烃发生[3+2]环化加成得到异恶唑产物。该化合物在铜催化剂下可以与末端炔烃反应得到β-内酰胺(衣笠反应)。 亚砜/氧化硒的syn-β消除Syn-β-elimination of Sulfoxide/Selenoxide
对于拥有β-H的亚砜或者氧化硒底物进行加热的话,会引起syn-β消除反应,最终形成烯烃产物 氧化加汞-脱汞还原
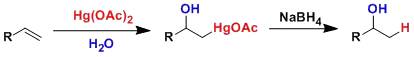
烯基上醋酸汞的顺式选择性加成反应,接着用硼氢化钠脱汞还原,得到马氏加成的醇。不需要强酸性条件,反应能在温和环境下进行。 原子转移自由基聚合(AtomTransfer Radical Polymerization)
在铱催化下对映选择性地烯丙位烯基化
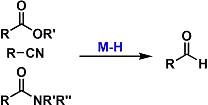
酯,酰胺,腈类的部分还原
酯,酰胺,腈类在适当的氢化金属还原剂的存在下,低温反应可以还原成醛。经常使用的还原剂有DIBAL、Red-Al等。酯基相对于腈类化合物来说,要被还原后停留在醛的阶段,更加不容易。使用2当量以上的DIBAL还原成醇后,在把醇氧化成所需的醛,步骤太冗长了。另外,对于5或6圆环的内酯来说、部分还原成内缩醛相对来说很容易。 Weinreb酰胺或吗啉酰胺的话,可以被LAH部分还原得到高产率的醛。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |