抗体类药物非临床研究相关种属选择的一般考虑 |
您所在的位置:网站首页 › vegf抗体是什么意思 › 抗体类药物非临床研究相关种属选择的一般考虑 |
抗体类药物非临床研究相关种属选择的一般考虑
|
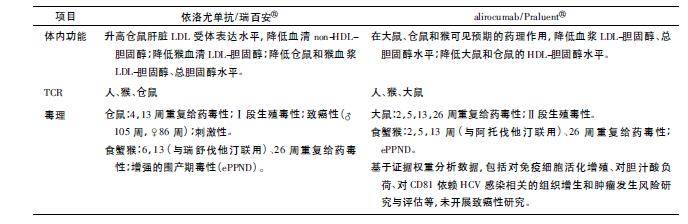
部分已上市抗体类药物的文献资料显示,非临床研究中经过充分探索,可能获得2 种及以上相关种属,也可能仅获得一种相关种属,甚至没有相关种属而仅能采用黑猩猩进行部分研究。以下按获得动物种属的多少分类表述( 尚未在国内上市的采用英文通用名) 。 1. 1 2 种及2 种以上相关种属 1. 1. 1 贝伐珠单抗 贝伐珠单抗( 安维汀 ®) 为IgG1型人源化抗血管内皮生长因子( VEGF) 单克隆抗体( 后文简称单抗) ,最早于2004 年在美国获准上市( bevacizumab /Avastin ®; 罗氏公司) ,已在国内获准进口,用于转移性结直肠癌和非小细胞肺癌的治疗。 该产品上市时间较早,FDA 审评报告中并未明确阐述支持其相关种属选择依据的信息[5],仅提及该产品与小鼠或大鼠VEGF 的结合亲和力低( 后续文献研究显示贝伐珠单抗与大鼠和小鼠VEGF-A 不结合[6]、无抑制活性[7]) ,可与食蟹猴和兔VEGF-A结合,食蟹猴为最相关种属。据此申请人开展了食蟹猴4 ~ 26 周重复给药毒性和药物相互作用( PK 和安全性) 研究; 在兔体内开展了伤口愈合、卵巢功能、顺铂肾损伤、Ⅱ段生殖毒性等安全性研究以及放射性标记的组织分布、代谢和排泄研究。此外,由于在食蟹猴重复给药毒性试验中观察到骨骺发育不良( physeal dyslasia) ,又在幼龄兔( 42 日龄) 体内开展相关研究确认了该产品可引起股骨和胫骨生长板增厚和肥大伴软骨细胞数量增多。报告中还指出与灵长类相比,贝伐珠单抗与兔VEGF 的亲和力弱8 倍,这可能是同等剂量下对骨生长板的影响弱于食蟹猴模型的原因。值得注意的是,针对II 期临床研究期间出现的静脉血栓不良事件,申请人采用兔开展了相关研究。另在食蟹猴体内开展了不同批次产品间比较的多次给药伤口愈合试验,以及食蟹猴、兔和人体TCR 试验[5]。 该产品开发时间较早,试验条件有限,虽未明确相关种属选择依据,仍通过体外结合活性、体内药理效应等研究方式确认兔和食蟹猴为相关动物,并采用兔和食蟹猴开展了相关研究,以探索产品的毒性特征并提示临床安全性风险。晚于该产品2 年上市的同靶点同表位药物ranibizumab /Lucentis ®( 雷珠单抗/诺适得 ®; 诺华公司) 提供了相对更全面的信息,明确雷珠单抗在兔体内有活性,但与兔VEGF 结合亲和力低于人体,选择兔和食蟹猴开展了相关研究[8]。 1. 1. 2 依洛尤单抗和alirocumab 依洛尤单抗( 瑞百安 ®) 为IgG2 型全人源抗前蛋白转化酶枯草杆菌蛋白酶Kexin-9( PCSK9) 单抗,最早于2015 年获得欧洲药物管理局( EMA) 批准,随后在美国、日本均获准上市( evolocumab /Repatha ®; 安进公司) ,2018年7 月在国内获准进口用于治疗高胆固醇血症。Alirocumab 与依洛尤单抗类似,也是PCSK9 抑制剂,区别在于该分子为IgG1 型全人源单抗,于2015年获FDA 批准上市( Praluent; 赛诺菲/再生元公司) 。 依洛尤单抗和alirocumab 作用靶点、适应证相似,根据FDA 审评报告[9 - 10],对二者开展的主要非临床研究及支持相关种属选择的依据对比见表1。
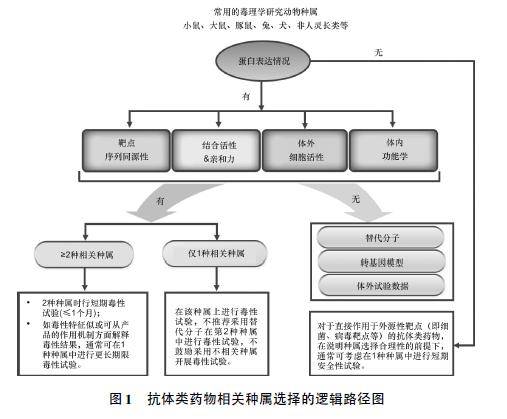
由表1 可见,综合种属间靶点序列同源性、分子和细胞水平亲和力、体内药效学研究信息,可以为后续毒理学研究的相关种属选择提供支持性证据。针对相同靶点的2 个产品,相关种属的评价策略相似但不完全相同; 如抗原表位存在差异,相关种属也可能是不同的,不能进行产品间的外推。如alirocumab 所示,当大鼠、小鼠和仓鼠均为药理学活性相当的相关动物种属时,大鼠通常是优先考虑的啮齿类动物。 1. 3 guselkumab 和乌司奴单抗 guselkumab 为一种IgG1 /λ 型全人源单抗,与白细胞介素23 ( IL-23) 的p19 亚基结合,阻止IL-23 与其受体结合。该产品于2017 年获FDA 批准上市( Tremfya; 强生公司) ,用于治疗成人中度至重度斑块性银屑病。 根据已公开的FDA 审评报告[11],支持guselkumab相关种属选择的试验依据包括:① 与人和食蟹猴IL-23 的亲和力KD相当( 3. 3 vs 1. 9 pmol·L -1) 。② 与豚鼠、非人灵长类动物( 包括狒狒、黑猩猩、豚尾猴和食蟹猴) IL-23 结合/抑制,与大鼠和小鼠不结合,与犬部分结合。③ 完全抑制豚鼠IL-23,且与人和食蟹猴相当,故选择食蟹猴和豚鼠作为非临床研究的相关种属。主要开展的试验包括食蟹猴单次给药,5周、24 周重复给药毒性试验,ePPND 试验;豚鼠3 周重复给药毒性试验、Ⅰ段生殖毒性试验; 食蟹猴和人体TCR 试验。 此外,申请人基于已开展的食蟹猴重复给药毒性试验结果,结合IL-23 通路在肿瘤发展和抗肿瘤免疫中的潜在作用等已发表的文献信息,进行了致癌性风险评估,未开展致癌性研究。 乌司奴单抗为Centocor 公司开发的IgG1 /λ 型全人源单抗,可与IL-12 和IL-23 的p40 蛋白亚基特异性结合。该产品的开发时间早于guselkumab,最早于2009 年获EMA 批准上市( ustekinumab /Stelara ®) ,已于2017 年获准进口,用于治疗斑块状银屑病。 根据公开的FDA 审评报告[12],在ustekinumab的药理学研究信息中可见食蟹猴IL-12 和IL-23与人体的序列同源性为92%,食蟹猴和人IL-12 /IL-23p40 结合的氨基酸残基序列一致; 与人与食蟹猴IL-12 和IL-23 结合/中和活性相当,与小鼠、大鼠、犬或兔部分结合或没有活性。 上述数据支持ustekinumab在食蟹猴体内开展26 周重复给药毒性试验,食蟹猴Ⅰ段、Ⅱ段和Ⅲ段生殖毒性试验以及TCR 试验。申请人还采用小鼠替代分子开展了小鼠Ⅰ段生殖毒性试验。此外,基于文献数据进行了致癌性风险评估,认为该品存在潜在致癌风险,根据ICH S6( R1) ,未开展致癌性研究,通过说明书和风险管理实践来规避潜在风险。 1. 1. 4 galcanezumab galcanezumab 为靶向于降钙素基因相关肽( CGRP) 的IgG4 /κ 型全人源单抗,分别于2018 年9 月和11 月在美国和欧盟获准上市( Emgality; 礼来公司) ,用于治疗成人患者偏头痛。 根据FDA 审评报告[13],支持该产品相关种属选择的主要依据为: 体外结合和功能学试验显示galcanezumab 在大鼠、兔和人均有药理学活性。与人和大鼠CGRP 的结合亲和力KD分别为31 和250pmol·L -1。 在细胞水平比较了该产品对人和兔CGRP 介导的SK-N-MC 细胞产生cAMP 的抑制作用, IC50分别为0. 23 和0. 06 nmol·L -1; 功能学研究显示galcanezumab 可以降低辣椒素( capsaicin) 诱导的大鼠面部血流增加,长时间抑制辣椒素诱导的食蟹猴前臂血流增加。 该产品的非临床研究主要包括大鼠6 ~ 26 周重复给药毒性、Ⅰ段、Ⅱ段和Ⅲ段生殖毒性、幼龄动物毒性( PND21-90) ; 食蟹猴6 ~ 26 周重复给药毒性;兔Ⅱ段生殖毒性以及人体、食蟹猴和大鼠TCR 试验。 此外,基于galcanezumab 对抗CGRP 相关血管生成和免疫抑制的潜力、对CGRP 的特异性、未见警示结构以及已有的毒性和临床研究结果综合提示该产品具有较低的潜在致癌性,未开展致癌性研究。 1. 2 1 种相关种属 1. 2. 1 纳武利尤单抗 纳武利尤单抗( 欧狄沃 ®)为靶向抗程序性死亡受体( PD-1) 的IgG4 型全人源单抗,最早于2014 年在日本获准上市( nivolumab /Opdivo; 百时美施贵宝/小野公司) , 2018 年8 月获准进口用于治疗非小细胞肺癌。 根据FDA 审评报告[14],该产品的相关种属选择依据如下: 采用SPR 法检测到与人和猴的亲和力接近,分别为3. 06 和3. 92 nmol·L -1; 采用流式细胞术检测到该产品可与激活的食蟹猴淋巴细胞PD-1结合,与激活的大鼠和兔淋巴细胞PD-1 未见结合。基于上述结果,采用食蟹猴为相关种属开展了重复给药4 周、13 周毒性试验、ePPND 试验以及与食蟹猴和人体TCR 试验。 结合食蟹猴ePPND 试验结果和PD-1 基因敲除小鼠( PD-1 通路基因突变和接受PD-1 中和抗体) 的文献资料,综合分析了纳武利尤单抗的生殖毒性风险。此外,还评价了与ipilimumab等免疫检查点抑制剂对比,与HBsAg,DNP-Ficoll和细胞SKMel 免疫激动剂联用的影响。未采用该产品或替代分子开展非相关动物的毒性试验。 1. 2. 2 ipilimumab ipilimumab 为细胞毒性T 淋巴细胞相关抗原4( CTLA-4) IgG1 /κ 型全人源单抗,最早于2011 年在美国获准上市( Yervoy,百时美施贵宝公司) ,批准的适应证包括不可切除的或转移性黑色素瘤、晚期肾细胞癌和转移性结直肠癌。 目前在国内开展临床研究。FDA 审评报告显示[15],申请人最初提交的非临床研究确认非人灵长类动物是唯一的药理学相关种属,且在食蟹猴和人体的TCR 特征相似,因此选择猴作为相关动物种属开展安全性评价研究。采用流式细胞术检测了该产品与恒河猴的CTLA-4 结合,与小鼠和大鼠不结合; ELISA 检测显示与人CTLA-4结合,与小鼠或大鼠均不结合。 体外激活和细胞表面结合试验结果显示,该产品与小鼠和兔的淋巴细胞均不结合,与大鼠CD +3 T 淋巴细胞结合的阳性率仅为0. 3% ~ 1. 8%,与猴淋巴细胞结合的阳性率约15% ~ 35%。基于上述研究结果,在食蟹猴体内开展了单次给药毒性,2周、4 周和6 个月的重复给药毒性和ePPND试验,同时评价与HBsAg,DNP-Ficoll 和细胞SKMel 免疫激动剂联用的影响,以及与其他免疫调节剂联用研究。 此外,除了食蟹猴ePPND 研究结果,申请人结合CTLA-4 敲除小鼠的文献资料、临床研究中ipilimumab 相关的内分泌紊乱、TCR 结果( 与猴的胎盘存在结合,人体组织未见) 以及猴6 个月重复给药毒性研究中的对生殖系统的影响,综合分析了该产品的生殖和发育毒性风险。值得注意的是,尽管猴是相关种属,但ipilimumab 与食蟹猴CTLA-4 的亲和力较人弱1. 8 ~ 4. 2 倍,可能导致毒性被低估。 在这种情况下,参考ICH S6,当受试产品在所选种属细胞水平的亲和力低于人细胞水平时,应相应提高采用该种属开展试验的剂量。ipilimumab的审评报告中也提示在比较人体和猴试验剂量时,应将种属间的亲和力差异考虑在内。尽管与大鼠CD +3 T 淋巴细胞可见较弱的结合,未采用大鼠开展相关毒性试验。 1. 2. 3 obinutuzumab obinutuzumab 是基于此前已上市的利妥昔单抗( Rituxan /美罗华 ) 开发的IgG1 型单抗,能结合B 淋巴细胞表面的CD20,结合表位与利妥昔单抗相同,但通过糖基化修饰技术提高了抗体依赖的细胞毒作用( ADCC) 。 于2013 年在美国获批( Gazyva; 罗氏公司) 用于慢性淋巴细胞白血病,后续获批用于治疗滤泡性淋巴瘤。根据FDA 审评报告[16],obinutuzumab 不与啮齿类CD20 结合; 除食蟹猴外,obinutuzumab 对其他种属没有药理学活性; 且与人和猴CD20 的亲和力相似。申请人提供了3 个单独的研究报告来确认食蟹猴作为相关种属用于obinutuzumab 毒理学评价的合理性。主要的研究内容如下: ① 种属间CD20 序列比对。人与猴的CD20 序列仅有1 个氨基酸不同( 总297 个) ,与大鼠、小鼠的同源性为63%; 采用Pescan 技术并经X 射线晶体学和定点诱变方法确认人和食蟹猴的核心抗原表位是保守的。 ② 与不同种属CD20 亲和力比较。流式细胞术检测显示,obinutuzumab 对非霍奇金淋巴瘤细胞株上表达的人和猴CD20 的结合亲和力相当; 与利妥昔单抗对比,obinutuzumab 对多种人淋巴细胞株的EC50相当,对SU-DHL4( 人类B 细胞淋巴瘤细胞) 的结合亲和力相当。 ③ FcRn 和FcγIIIa 亲和力比较。Biacore 检测显示,与利妥昔单抗对比,obinutuzumab 与人和食蟹猴FcRn 和FcγIIIa( 与ADCC 作用相关) 的亲和力相当。基于上述相关种属选择依据,obinutuzumab 非临床研究主要包括食蟹猴2 周( 与利妥昔单抗对比) 、4 ~ 26 周重复给药毒性、ePPND 试验以及与食蟹猴和人体TCR 试验。 尽管以上举例的抗体类药物大多开展了不同种属组织的TCR 试验,但根据ICH S6( R1) ,TCR 并非是为了确定相关种属,而是有助于了解靶点分布和潜在的非预期结合,为临床安全性风险提供更全面的信息。 1. 3 无相关种属或仅黑猩猩为相关种属 1. 3. 1 伊库珠单抗 伊库珠单抗( 舒立瑞) 为一种人源化IgG2 /4κ 型单抗,能与人补体蛋白C5 高亲和性结合并阻止终末补体复合物C5b-9 的生成,最早于2007 年在美国获准上市( eculizumab /Soliris;Alexion 公司) ,2018 年9 月获准进口,用于治疗成人和儿童阵发性睡眠性血红蛋白尿症( PNH) 和非典型溶血性尿毒症综合征( aHUS) 。 由于该产品开发时间较早,支持相关种属选择的试验信息较为有限。根据FDA 审评报告[17],申请人考察了该产品对不同种属来源的补体引起的鸡红细胞裂解的抑制作用。 结果显示,仅对人补体引起的红细胞裂解有抑制活性,对非人灵长类动物( 包括狒狒、黑猩猩、恒河猴、食蟹猴) 、猪、兔、大鼠、豚鼠均无活性。基于以上研究结果,该产品仅特异性识别人补体C5,后续研究包括人体TCR 试验; 采用替代分子( 抗小鼠C5) 开展的小鼠4 周、26 周重复给药毒性试验以及小鼠Ⅰ ~Ⅲ段生殖毒性试验。 1. 3. 2 达雷木单抗 达雷木单抗为CD38 全人源IgG1 /κ 型单抗, 2015 年获FDA 批准用于多发性骨髓瘤( daratumumab /Darzalex; 强生公司) 。 尽管序列对比分析提示人与黑猩猩( 99%) 和恒河猴、食蟹猴( 约92%) CD38 序列同源性均较高,但已公开的FDA 审评报告显示[18],达雷木单抗仅与黑猩猩淋巴细胞结合,不与食蟹猴、恒河猴、猪、兔、大鼠和小鼠的淋巴细胞结合; 与人和黑猩猩的血小板结合。 由于除黑猩猩外未找到其余相关种属,申请人构建了抗人和食蟹猴CD38 的替代分子开展了一系列对比研究证明替代分子具有相似的性质[详见《采用替代分子开展非临床研究的一般考虑》( 待发表) ]后,采用黑猩猩开展了重复给药6 周毒性试验( 有限的动物数和考察指标) ,以及采用食蟹猴给予替代分子开展了重复给药2 周毒性试验和药动学试验。 此外,由于该产品的唯一相关种属为黑猩猩,缺少进行生殖和发育毒性研究的可操作性,FDA 同意基于CD38 表达、潜在的胚胎/胎仔暴露以及基因敲除小鼠的数据进行证据权重分析,并将相关信息纳入说明书。 1. 3. 3 blinatumomab blinatumomab 为一种双特异性scFv 抗体,靶向于CD19 和T 细胞CD3。该产品于2014 年12 月在美国获准上市( Blincyto; 安进公司) ,适应证为费城染色体阴性的复发难治的B 细胞起源的急性淋巴性白血病( ALL) 。 FDA 审评报告显示[19],该产品针对相关种属选择进行了专题性的研究,主要包括以下内容: ① 种属相关性筛选。流式细胞术检测显示blinatumomab仅与黑猩猩的B 细胞( CD +20) 和T 细胞( CD +4) 结合,与小鼠、比格犬、食蟹猴、恒河猴、狒狒不结合; 与黑猩猩的B 细胞和T 细胞结合导致B 细胞裂解; 与人B 细胞和T 细胞结合,与非洲绿猴、狨猴、松鼠猴、大鼠和小鼠不结合。 ② 采用人和黑猩猩体外试验系统进行的表征研究。与人和黑猩猩的CD +4淋巴细胞均未见结合饱和; 与人CD +20淋巴细胞结合的饱和浓度( 10 μg·mL -1) 高于黑猩猩( > 2 μg·mL -1) ; 采用NALM-6 细胞开展的自体B 细胞耗竭试验和细胞毒性试验中,人和黑猩猩的EC50值相似; 在人和黑猩猩效应细胞中, IL-2, IFN-γ 和TNF-α 释放特征相似。 确认黑猩猩为唯一相关种属后,申请人构建了与blinatumomab 具有可比性的鼠替代分子[详见《采用替代分子开展非临床研究的一般考虑》( 待发表) ]用于开展小鼠体内毒性研究,包括小鼠CNS 安全药理试验和4 周、13 周给药毒性试验和Ⅱ段生殖毒性试验。还在黑猩猩体内开展了重复给药5 周毒性试验、人体TCR 试验、小鼠CNS 安全药理试验、4周、13 周给药毒性试验和Ⅱ段生殖毒性试验。 由上述案例可知,在除黑猩猩外没有其余相关种属时,可采用经过全面表征的替代分子开展关键的非临床研究,结合在黑猩猩体内有限的试验数据,综合评价受试产品的非临床有效性和安全性对上市申请的支持性。 1. 4 直接作用于外源性靶点的单抗 1. 4. 1 bezlotoxumab bezlotoxumab 为一种能结合并中和艰难梭状芽孢杆菌毒素B 的IgG1κ 型全人源单抗,于2016 年获FDA 批准( Zinplava; 默沙东公司) 用于减少18 岁及以上患者艰难梭状芽孢杆菌感染( CDI) 复发。 该产品开展了大量的体外和体内CDI 动物模型的药理学研究、小鼠体内单次给药、2 周和3 周重复给药毒性试验、与人体和小鼠组织的TCR 试验。由于bezlotoxumab 与人体和小鼠组织的TCR 均为阴性结果,因此FDA 认为上述研究是充分的[20]。 1. 4. 2 idarucizumab idarucizumab( 泰毕安) 为一种人源化IgG Fab,是达比加群特异性逆转剂,最早于2015 年获FDA 批准( Praxbind; 勃林格殷格翰公司) ,用于使用达比加群进行治疗的患者的紧急手术和危及生命或不受控制的出血。 FDA 审评报告显示[21],该产品在体外和小鼠、大鼠和猪体内开展了充分的药效学研究; 在大鼠和食蟹猴体内开展了药动学试验( PK、排泄) ; 大鼠呼吸系统安全药理和4 周重复给药毒性试验; 食蟹猴2 周重复给药毒性伴随PD 试验; 人体、食蟹猴和大鼠TCR 试验。该产品仅在需要快速逆转达比加群抗凝血作用的紧急情况下使用,因此FDA 认为不需要进行遗传毒性、生殖和发育毒性以及致癌性研究,这与ICH S6( R1) 中的建议是一致的。 内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。 2 结语 在生物制品的非临床研究中,相关动物种属选择的科学性和合理性对非临床研究数据的解读、临床起始剂量的估算以及后续临床开发有重要意义。 种属间靶点序列的高度同源性可以为后续开发建立信心,但一级结构相似并不代表结合表位相同; 蛋白水平的表达情况和TCR 试验结果有助于指导和确认毒理学种属选择的科学性和合理性,但也应注意到可能存在假阳性结合、与体内毒性发现缺乏相关性( 特别是胞浆型结合) 等局限性[1]; 分子和/或细胞水平的结合活性和亲和力试验通常可以进一步评估种属相关性,但应关注在某些情况下仅进行结合活性试验可能不足以确保抗体类药物在动物种属中的生物学活性与在人体中是相似的; 对于体外细胞活性方面的种属差异,除了需考虑靶点的生理水平差异外,还应明确种属间的作用机制是否相似[3]; 在某些情况下,体内功能试验有助于动物种属的选择。 对于经过系统性筛选,确认无相关种属或仅黑猩猩为相关种属的,ICH S6 ( R1) 建议可采用转基因动物或替代分子进行试验,申请人应对转基因动物和替代分子进行必要的表征研究。基于ICH S6( R1) 和案例分析,对抗体类药物相关种属选择的逻辑路径图以及相关案例的印证图见图1。
通过上述药物研发案例,简要回顾了抗体类药物选择相关动物种属时的一般考虑,但并不一定适用于所有靶点、所有适应证领域的所有情况。通过比较发现,近几年获准上市的相同靶点或不同靶点的产品分别采取了思路相似但方法并不完全相同的策略用于支持其相关种属的选择; 核心之处在于,结合产品结构、靶点特征和作用机制具体情况具体分析。 值得一提的是,文中所述案例的相关动物种属选择依据均来自FDA 的审评报告,不能排除开发者在早期筛选和开发过程中进行过其他的与评价种属特异性有关的基础研究,这对于候选药物的早期表征研究和制定开发阶段的研究策略非常重要。 对于申请人,应关注在进行种属特异性评价时所采用的试验设计与产品特点的匹配程度,疾病模型( 尤其是自发模型和人源化模型) 是否体现与临床相关的毒性特征、动物模型与临床目标人群和疾病模型中靶点的生物学和表达特征相似程度等,积累可信的支持相关动物选择的证据,这有助于指导毒理学试验的科学设计和提高研究结果的临床转化价值。 对于审评机构,建议在关注种属选择的合理性的同时,对非临床研究结果的临床相关性的判断更为关键,应基于科学依据对已知风险进行识别、提示潜在的风险,为完善风险控制管理策略提出建议。 参考文献 中国新药杂志 2020 年 第 29 卷 第 5 期 免责声明 我们尊重原创作品。选取的文章已明确注明来源和作者,版权归原作者所有,如涉及侵权或其他问题,请联系我们进行删除。 内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。返回搜狐,查看更多 |
【本文地址】