Transwell侵袭实验 |
您所在的位置:网站首页 › transwell孔径 › Transwell侵袭实验 |
Transwell侵袭实验
 背景及应用 恶性肿瘤从原发瘤或继发瘤向邻近的宿主组织侵犯或占领称为侵袭。检测肿瘤侵袭能力是判断肿瘤转移能力的一种方法。如(图1)所示,肿瘤细胞侵袭发生在转移的第一步,即肿瘤细胞在原位突破基底膜,然后内渗进入血管、淋巴管的过程,后期定植到其他组织并增殖。利用transwell侵袭实验可以检测肿瘤细胞的侵袭能力。trans有转移、转运之意,well有小室之意,transwell合起来就是穿过小室。未铺胶的transwell实验检测细胞的迁移能力,铺胶的transwell实验检测细胞的侵袭能力。迁移和侵袭是两个概念。迁移是指细胞的运动能力,而侵袭是细胞在运动的同时会分泌出消化ECM的蛋白,清除运动障碍,这个实验更能模拟人体内环境。 transwell侵袭实验的基本原理: transwell小室在培养板中,小室内称上室,小室放入的培养板称下室,上室底部为一层聚碳酸酯膜,这层膜具有通透性,将上室培养液和含下室培养液隔开,下室中的培养液可以影响上室中的细胞,从而研究下室中液体对细胞的生长、迁移的影响,细胞接种到低营养的培养液里,通常膜孔都被ABW®Matrigengel覆盖,模仿细胞外基质,肿瘤细胞必须分泌水解酶并通过变形运动才能穿过铺有ABW®Matrigengel的滤膜,计数进入下室的细胞量可反应肿瘤细胞的侵袭能力。 应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。  图1. 肿瘤细胞的转移过程 图1. 肿瘤细胞的转移过程 图2.Transwell小室的基本结构 图2.Transwell小室的基本结构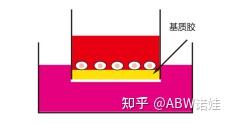 图3. 细胞铺在上室 图3. 细胞铺在上室 图4. 上室细胞侵袭到下室 图4. 上室细胞侵袭到下室一、准备工作 1.实验材料 ①生长状态良好、汇合度达70%-80%的细胞 ②培养基:无血清培养基、含10%FBS的完全培养基 ③耗材:200ul、1.5ml EP管、放有8um Transwell小室的24孔板 ④其他:胰酶、PBS、结晶紫染液、4%多聚甲醛、Matrigengel 2.在冰上4℃过夜融化Matrigengel,实验前转移到冰盒中。 3.将200ul枪头、1.5ml EP管、放有Transwell小室的24孔板和无血清培养基提前-20℃预冷,实验前转移到冰盒中。 二、实验步骤 A.准备基质胶 1.4℃隔夜解冻Matrigengel,实验前转移到冰盒中。 2.将提前准备好的冰放置冰盒中,凝胶前的操作均在冰上操作。将枪头、离心管与放有Transwell小室的24孔板放入冰盒预冷,并用预冷枪头将Matrigengel混匀。 B.基质胶铺板 1.稀释Matrigengel:先将8µL Matrigenge加入预冷的1.5ml EP管中,然后加入64µL预冷的无血清培养基,并用枪头吹打充分混匀。(Matrigenge和无血清培养基以1:8的比例稀释) 2.吸取60µL 稀释后的Matrigengel,垂直加入Transwewll上室中,均匀平铺在底部。 3.放入培养箱(37℃,5%CO2)中孵育3h,使Matrigengel聚合成薄膜。(注意:铺胶过程不要产生气泡,均匀铺胶。) 4.孵育后将上室中多余液体吸掉,在每孔中加入100 µL无血清培养基后,于培养箱放置30min,进行基底膜水化。 5.将上室中液体吸掉,检查是否有液体穿过小室进入到下室中,若没有,则可以接种细胞。 C.制作细胞悬液 1.制作细胞悬液前可先让细胞撤血清饥饿12-24h,进一步去除血清的影响。(此步骤可选择操作,如果细胞迁移能力不强,可考虑进行此步骤增加血清对细胞的诱导。) 2.取汇合度达70%-80%的细胞进行消化并离心弃废液,然后用无血清培养基重悬细胞,计数后调整细胞密度至2.5×105/mL。(不同细胞大小和迁移能力不同,可设置浓度5×104/mL 、2.5×105/mL、5×105/mL摸索合适的浓度。) D.接种细胞 1.在24孔板下室加入500µL含10%FBS培养基。然后用镊子将Transwell小室置于24孔板内(注意:下层培养液和小室间经常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。) 2.每孔加入200µL细胞悬液到Transwell上室中。 3.培养箱培养24h后可进行固定染色。(时间点可根据肿瘤细胞侵袭能力而定,一般24-48h,还需要考虑细胞状态和消化时间对细胞的影响。另外建议最好接种细胞后1-2h把培养板从培养箱里拿出来看看,确保没有大气泡产生。) E.细胞固定 1.取出Transwell小室,吸走培养基,用棉签轻轻擦拭Matrigengel和上室内的细胞。 2.在24孔板干净的孔中加入4%多聚甲醛600µL,将小室放入后固定20-30min。 F.细胞染色及计数 1.弃去固定液,将小室在盛有PBS的6cm皿中涮洗1遍。(注意避免触碰到小室底部) 2.用0.1%结晶紫染色5-10min,PBS涮洗3遍,除去未与细胞结合的结晶紫,用棉签轻轻擦拭小室的上侧,将非特异性结合于小室上表面的染料擦掉,以便后续镜检。 3.适当风干后,在10倍显微镜下选取5个视野观察细胞并计数。 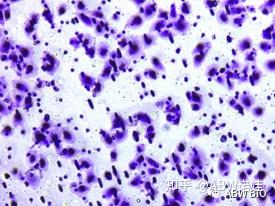 未铺胶组 未铺胶组 1:8稀释铺胶组 1:8稀释铺胶组
|
【本文地址】