一种双荧光标记的重组菌及其制备方法和在研究耐药基因体内转移中的应用与流程 |
您所在的位置:网站首页 › tomato基因显影 › 一种双荧光标记的重组菌及其制备方法和在研究耐药基因体内转移中的应用与流程 |
一种双荧光标记的重组菌及其制备方法和在研究耐药基因体内转移中的应用与流程
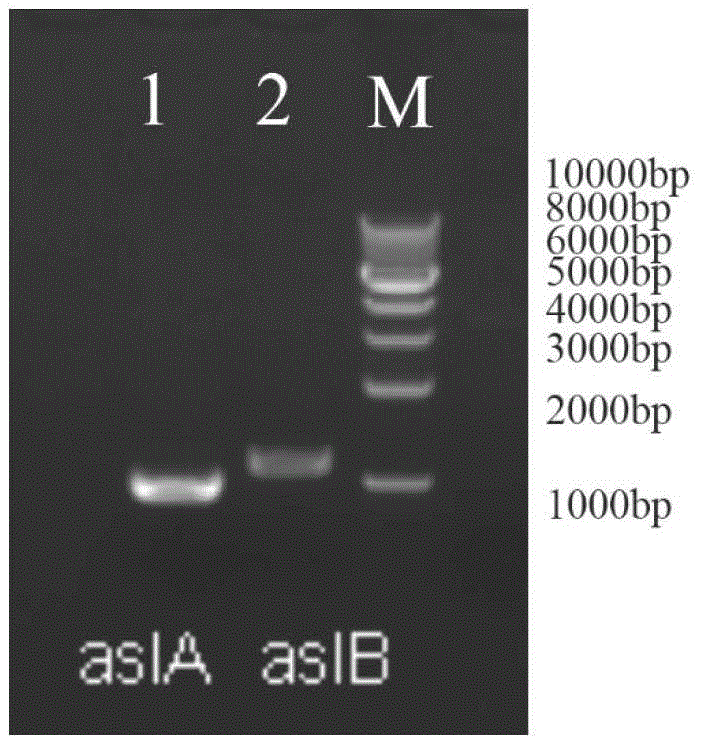 本发明属于耐药基因研究技术领域,尤其涉及一种双荧光标记的重组菌及其制备方法和在研究耐药基因体内转移中的应用。 背景技术: 抗菌药物通过杀灭细菌发挥治疗感染的作用,细菌作为一类广泛存在的生物体,也可以通过多种形式获得对抗菌药物的抵抗作用,逃避被杀灭的危险,这种抵抗作用被称为“细菌耐药”,获得耐药能力的细菌就被称为“耐药细菌”。细菌耐药是一种被人类强化的自然现象。所谓细菌的耐药性,是指细菌多次与药物接触后,对药物的敏感性减小甚至消失,致使药物对耐药菌的疗效降低甚至无效。随着抗生素药物的广泛使用,细菌耐药性问题已成为严重影响人类健康的问题之一,耐药基因作为细菌耐药的物质基础,近年来成为人们关注的热点。 而耐药基因在体内转移情况及能转移给哪些受体菌,由于缺乏适当的分选和分析技术,暂时还不清楚。目前,已有很多文献报道了绿色荧光蛋白基因及其衍生物在细菌瞬时表达,质粒的水平转移,病原菌侵入细胞途径及监测体内细菌的迁移和变化等方面的应用。目前尚没有在细菌耐药基因水平转移应用方面的研究。 技术实现要素: 有鉴于此,本发明的目的在于提供一种双荧光标记的重组菌及其制备方法和在研究耐药基因体内转移中的应用。 为了实现上述发明目的,本发明提供了以下技术方案: 一种双荧光标记的重组菌,所述重组菌以大肠杆菌为原始菌株,在所述大肠杆菌的基因组上整合有红色荧光标记基因;所述大肠杆菌内有携带绿色荧光标记基因的接合性质粒rk2。 优选的,所述大肠杆菌为e.coliatcc47076。 优选的,所述红色荧光标记基因通过同源重组的方式整合到所述大肠杆菌的基因组上asla酶切位点和aslb酶切位点之间。 本发明提供了所述的重组菌的制备方法,包括以下步骤: 1)构建携带红色荧光标记基因的打靶载体; 2)将所述打靶载体转入原始菌株大肠杆菌中获得基因组上整合有红色荧光标记基因的第一重组菌株; 3)将携带有绿色荧光标记基因的接合性质粒rk2转入所述第一重组菌株中获得双荧光标记的重组菌。 本发明提供了所述的重组菌在研究耐药基因体内转移中的应用。 优选的,所述应用包括以下步骤: 1)用所述重组菌喂食动物18~22d后,解剖所述动物,并收集粪便细菌和肠道细菌; 2)检测所述粪便细菌或肠道细菌的荧光信号,若所述粪便细菌或肠道细菌中出现绿色荧光信号,说明所述粪便细菌或肠道细菌接受了重组菌中的接合质粒,易于产生耐药性;若所述粪便细菌或肠道细菌中没有出现绿色荧光信号,说明所述粪便细菌或肠道细菌没有接受重组菌中的接合质粒,不易产生耐药性。 优选的,步骤1)中所述动物为斑马鱼。 优选的,所述重组菌喂食的量为1~9×108cfu/d/条。 优选的,所述粪便细菌和肠道细菌的收集采用流式细胞分选实现。 优选的,检测肠道不同位置分离获得的肠道细菌的绿色荧光信号,根据肠道不同位绿色荧光信号出现的的数量和细菌种类比例确定肠道不同位置细菌耐药性产生的概率。 本发明的有益效果:本发明提供的双荧光标记的重组菌,以大肠杆菌为原始菌株,在所述大肠杆菌的基因组上整合有红色荧光标记基因;所述大肠杆菌内有携带绿色荧光标记基因的接合性质粒rk2。本发明中所述重组菌的基因组上携带红色荧光蛋白基因,细胞内还存在质粒携带绿色荧光蛋白基因;所述重组菌携带的两种荧光标记基因便于对所述重组菌分布的检测;并且所述携带绿色荧光标记基因的接合性质粒rk2能够通过结合作用转入到其他种类细菌细胞内,通过荧光信号检测能够准确的确定通过结合作用转入绿色荧光蛋白的细菌的种类和分布;便于不同种类细菌耐药性强弱的判断以及细菌耐药性产生部位的判断。 附图说明 图1为asla和aslb基因扩增产物的电泳图; 图2为电转化大肠杆菌k12中psc101-bad-gbaa-tet质粒pcr产物的验证; 图3为克隆子中打靶载体线性片段pcr产物的电泳检测; 图4为k12-tdtomato转化子的荧光检测; 图5为egpf-rk2载体酶切产物电泳图; 图6为k12td-tomato:rk2(egfp)的绿色荧光验证; 图7为k12td-tomato:rk2(egfp)的双荧光验证; 图8为供体菌和接合子的3d-sim超分辨率荧光显微镜下照片;其中a:供体菌k12td-tomato:rk2(egfp);b:供体菌k12td-tomato(不带质粒);c:供体菌和接合子;(1)编码在基因组上的td-tomato基因表达的红色荧光;(2)编码在质粒上的egfp基因表达的绿色荧光;(3)来自不同荧光信号的重叠图像; 图9为肠道和粪便样品中供体菌和接合子的流式细胞分析;其中a:前肠;b:中肠;c:后肠;d:粪便。 图10为斑马鱼肠道和粪便中接合子的物种注释和丰度分析;每格的颜色从蓝到红代表相应物种的丰度逐渐增加;fgg:前肠;mgg:中肠;hgg:后肠;feg:粪便。 具体实施方式 本发明提供了一种双荧光标记的重组菌,所述重组菌以大肠杆菌为原始菌株,在所述大肠杆菌的基因组上整合有红色荧光标记基因;所述大肠杆菌内有携带绿色荧光标记基因的接合性质粒rk2。 本发明对所述大肠杆菌的来源和种类没有特殊限定,采用本领域常规大肠杆菌即可。在本发明具体实施过程中,所述大肠杆菌优选为e.coliatcc47076,购自atcc(americantypeculturecollection)。在本发明中,所述红色荧光标记基因优选为td-tomato基因;所述td-tomato基因的核苷酸序列优选的如seqidno:1所示。在本发明中,所述td-tomato基因优选的通过同源重组的方式整合到所述大肠杆菌的基因组上asla酶切位点和aslb酶切位点之间。 在本发明中,所述携带绿色荧光标记基因的接合性质粒rk2优选的通过将所述绿色荧光蛋白标记基因连接至结合性质粒rk2中获得;在本发明中,所述结合性质粒rk2优选的购于质粒载体菌种细胞基因保藏中心(ntcc)。在本发明中,所述绿色荧光蛋白标记基因优选的插入到所述结合性质粒rk2的bamhi和ecori酶切位点之间。本发明对所述绿色荧光蛋白标记基因连接至结合性质粒rk2的方法没有特殊限定,采用本领域常规方法即可。 本发明提供了所述的重组菌的制备方法,包括以下步骤:1)构建携带红色荧光标记基因的打靶载体;2)将所述打靶载体转入原始菌株大肠杆菌中获得基因组上整合有红色荧光标记基因的第一重组菌株;3)将携带有绿色荧光标记基因的接合性质粒rk2转入所述第一重组菌株中获得双荧光标记的重组菌。 在本发明中,构建携带红色荧光标记基因的打靶载体。在本发明中,所述打靶载体优选的以pet32a载体为初始载体,在所述pet32a载体上依次连接aslb基因-gb2基因-红色荧光蛋白基因td-tomato-gb2基因-kanr基因-asla基因。在本发明中,所述asla基因和aslb基因为大肠杆菌的硫酸酶家族基因;本发明通过打靶载体上的asla基因和aslb基因与原始菌株中的asla基因和aslb基因进行同源重组,将所述红色荧光蛋白基因插入到原始菌株中的asla基因和aslb基因之间。在本发明中,所述asla基因和aslb基因的dna片段,以大肠杆菌基因组dna为模板,通过pcr扩增获得。本发明对所述pcr扩增的体系和程序没有特殊限定,采用本领域常规的pcr扩增体系和程序即可,详见实施例的记载。在本发明具体实施过程中,优选的将红色荧光蛋白基因td-tomato与初始载体pet32a载体连接后获得pet32a-tdtomato载体;将所述pet32a-tdtomato载体与asla基因和aslb基因的dna片段连接获得所述携带红色荧光标记基因的打靶载体。在本发明上述实验过程中,基因与载体的连接优选的通过内切酶的酶切与连接实现;本发明对所述酶切和连接的具体步骤和参数没有特殊限定,采用本领域常规的酶切与连接方式即可。 本发明在获得所述打靶载体后,将所述打靶载体转入原始菌株大肠杆菌中获得基因组上整合有红色荧光标记基因的第一重组菌株。在本发明中,所述打靶载体在转入原始菌株大肠杆菌之前优选的进行线性化;所述打靶载体的线性化优选的通过酶切实现;所述酶切用酶优选为hindiii酶。在本发明具体实施过程中,所述线性化的打靶载体优选的与重组辅助质粒共转染所述大肠杆菌的感受态细胞。在本发明中,所述重组辅助质粒优选为psc101-bad-gbaa质粒;所述重组辅助质粒优选的购自广州优宝生物科技有限公司。在本发明中,所述转入大肠杆菌感受态细胞的方法优选为电转化法;本发明对所述电转化法的具体步骤和参数没有特殊限定,采用本领域常规的方法和参数即可。 本发明在获得所述第一重组菌后,优选的对所述第一重组菌的荧光性能进行检测;将所述第一重组菌至于荧光显微镜下观察,若呈现红色荧光,则表明第一重组菌构建成功。 本发明在获得所述第一重组菌株后,将携带有绿色荧光标记基因的接合性质粒rk2转入所述第一重组菌株中获得双荧光标记的重组菌。在本发明中,所述绿色荧光蛋白标记基因优选的插入到所述结合性质粒rk2的bamhi和ecori酶切位点之间。在本发明中,优选的采用bamhi酶和ecori酶分别对所述绿色荧光蛋白标记基因以及结合性质粒rk2进行酶切后,连接。本发明对所述酶切和连接的具体步骤和参数没有特殊限定,采用本领域常规的酶切与连接方式即可。 本发明在获得所述双荧光标记的重组菌后,优选的对所述双荧光标记的重组菌的荧光性能进行检测;将所述双荧光标记的重组菌至于荧光显微镜下观察,若同时呈现红色荧光和绿色荧光,则表明所述双荧光标记的重组菌构建成功。 本发明提供了所述的重组菌在研究耐药基因体内转移或体内细菌耐药性中的应用。 在本发明中,所述应用优选的包括以下步骤:1)用所述重组菌喂食动物18~22d后,解剖所述动物,并收集粪便细菌和肠道细菌;2)检测所述粪便细菌或肠道细菌的荧光信号,若所述粪便细菌或肠道细菌中出现绿色荧光信号,说明所述粪便细菌或肠道细菌接受了重组菌中的接合质粒,易于产生耐药性;若所述粪便细菌或肠道细菌中没有出现绿色荧光信号,说明所述粪便细菌或肠道细菌没有接受重组菌中的接合质粒,不易产生耐药性。 在本发明中,用所述重组菌喂食动物18~22d后,解剖所述动物,并收集粪便细菌和肠道细菌。在本发明中,所述动物优选为斑马鱼;本发明中喂食斑马鱼的时间优选为19~21d,更优选为20d。在本发明中,所述重组菌喂食的量优选为108cfu/d/条;所述重组菌喂食的方法优选为将所述重组菌与斑马鱼的饲料混合喂食。本发明在所述重组菌喂食动物后,解剖所述动物,并收集粪便细菌和肠道细菌。本发明对所述解剖没有特殊限定,采用本领域常规解剖手段即可。在本发明中,所述粪便细菌和肠道细菌的收集优选的采用流式细胞分选实现。 在本发明中,所述流式细胞分选具体的包括以下步骤:将样品置于装有氩离子激光器的流式细胞分选仪中进行分选。fl1通道(581nm,21nm带宽的滤波器)收集的是不含rk2质粒的k12cm菌发出的红色荧光信号(p1),fl2通道收集的是双荧光标记的重组菌发出的红色和绿色两种荧光信号(p2),fl3通道(488nm的滤波器)收集的是肠道中接受了rk2质粒的接合子发出的绿色荧光信号(p3)。收集到的细胞以荧光散点的方式分布在坐标轴内。设门采用的是散射光设门法。即前向散射光(fsc)和侧向散射光(ssc)联合设门法,排除碎片或噪声的干扰,同时考虑到荧光的阴性对照,使设置的门都在fscvsfitc或fitcvspe等荧光分析点图上。1ml灭菌的pbs作为鞘液,最后分选后的细胞收集在15mlfalcon流式细胞管中。 本发明在获得所述粪便细菌和肠道细菌后,检测所述粪便细菌或肠道细菌的荧光信号,若所述粪便细菌或肠道细菌中出现绿色荧光信号,说明所述粪便细菌或肠道细菌接受了重组菌中的接合质粒,易于产生耐药性;若所述粪便细菌或肠道细菌中没有出现绿色荧光信号,说明所述粪便细菌或肠道细菌没有接受重组菌中的接合质粒,不易产生耐药性。 在本发明中,优选的还包括检测肠道不同位置分离获得的肠道细菌的绿色荧光信号,根据肠道不同位置绿色荧光信号出现的的数量比例确定肠道不同位置细菌耐药性产生的概率。在本发明中,所述肠道不同位置优选的包括前肠、中肠和后肠。 下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。 实施例1 本实施例中所用的基因重组引物如下: 本实施例中所用的质粒和菌株信息如下: 其中,菌株e.colik12mg1655购于atcc(americantypeculturecollection),接合性质粒rk2购于质粒载体菌种细胞基因保藏中心(ntcc),其余质粒购自广州优宝生物科技有限公司。 1双荧光标记重组菌k12td-tomato:rk2(egfp)的构建 1.1打靶载体aslb-gb2-tdtm-gb2-kanr-asla-pet32a的构建 1.1.1asla和aslb同源臂的扩增 选取在asla和aslb这两个基因之间插入td-tomato红色荧光蛋白基因。以e.colik12菌液的基因组dna为模板,ecori-asla-f(seqidno:1)和hindiii-asla-r(seqidno:2)为扩增asla基因的上下游引物,kpni-aslb-f(seqidno:3)和aslb-test-r(seqidno:4)为扩增aslb基因的上下游引物,pcr扩增后获得同源臂asla和aslb-em7的dna片段(em7为启动子)。pcr的扩增体系的体积为20μl,扩增体系为2×taqpcrmastermix10μl,上下游引物(10μm)各1μl,模板2μl,ddh2o6μl。扩增条件如表1所示。 表1asla和aslb-em7基因的扩增条件 pcr扩增结果如图1所示,其中,m为1kbdnaladder,1和2泳道为大肠杆菌k12基因组dna为模板,ecori-asla-f,hindiii-asla-r和kpni-aslb-f,aslb-test-r分别为扩增asla和aslb基因的上下游引物,由目的片段和dnaladder的比对结果来看,确认从供体菌k12上扩增的基因为asla和aslb。 1.1.2同源臂asla和aslb-em7片段连入pet32a-tdtomato后挑取单克隆pcr检测 将pet32a-tdtomato载体用hindⅲ和ecori,kpnl和xhol两对限制性内切酶在37℃消化3h,然后配备25μl的连接反应液,包括asla和aslb-em7基因片段(0.3pmol),10×t4dnaligase缓冲液(2.5μl),t4dnaligase(1μl)pet32a-tdtomato载体(0.03pmol)和ddh2o(补齐至25μl),16℃过夜反应。最终使asla和aslb-em7基因连入pet32a-tdtomato载体,成为aslb-gb2-tdtm-gb2-kanr-asla-pet32a打靶载体。 1.1.3重组辅助质粒psc101-bad-gbaa-tet电转大肠杆菌k12感受态细胞 电流瞬时高压会造成细胞膜的不稳定,形成电穿孔,这有利于质粒等大分子的进入;用4℃的无菌水反复多次的洗涤处于对数生长前期的细胞,使细胞悬液中含有尽可能少的导电离子。实验步骤为: ⑴取过夜培养的大肠杆菌k122ml转接在200mllb液体培养基中,37℃恒温摇床上震荡扩增培养大约2h,此时前后需小心观察直至od600=0.5。 ⑵将菌液迅速置于冰上。务必保证下列步骤在超净工作台及冰上操作。 ⑶吸取1.5ml培养好的菌液至1.5ml离心管中,冰上冷却10min。 ⑷1000g,20min,4℃离心,弃掉上清。 ⑸加入10ml提前预冷到4℃左右的10%甘油(pbs为溶剂),用移液管轻轻的抽吸打匀,细胞重悬,此步骤重复3~4次,确保菌液无其它杂质残留。 ⑹1000g在4℃下离心5min。 ⑺加入20μl冰冷的10%甘油,轻轻的吹打混匀,使细胞重悬(此时的细胞为感受态细胞,可分装保存在-80℃冰箱)。 ⑻将分装的感受态细胞每管(100μl)中加入200ng质粒dna(重组辅助质粒psc101-bad-gbaa-tet,约5μl),轻轻的吹打混匀,置于冰上。 ⑼调节bio-rad电击仪的电击条件为:电极电压2.3kv,200ω,25μf。 ⑽将菌液和质粒dna的混合物加入预冷的0.2cm电击杯中,电击时间为4-5ms。 ⑾电击后迅速向转化杯中加入1mlsoc液体培养基,重悬细胞。 ⑿吸取一部分细胞到lb液体培养基中30℃过夜培养。 ⒀吸取100μl细胞悬液涂布于含有80μg/ml的氨苄青霉素的sob琼脂平板上,30℃培养24h。 ⒁挑取转化子,鉴定对氨苄青霉素有抗性的克隆子并-80℃保存。 在图2中,m为dl2000marker,1-10泳道为质粒转化后克隆子的pcr产物。每个克隆子里都转入了重组辅助质粒psc101-bad-gbaa-tet。 1.1.4打靶载体线性片段电转入e.colik12-redet感受态细胞 将打靶载体线性化:打靶载体用hindiii酶切后线性化,反应体系如下:hindⅲ1l;10×mbuffer2l;dna2l;灭菌水补足20l。将线性化打靶载体电转入e.colik12-redet感受态细胞,方法同前。 m为dl2000marker,n为阴性对照,1-6泳道为克隆子中线性打靶载体的pcr产物,由电泳图3可以看出,1,3,5,6号泳道上的克隆子中都成功转入了线性打靶载体,即asla-km-alsb-tdtomato基因片段成功转入了大肠杆菌k12。 1.1.5第一重组菌株k12-tdtomato重组大肠杆菌的荧光检测 在倒置荧光显微镜用绿光为激发光,观察k12-tdtomato重组大肠杆菌,结果如图4所示,能观察到红色菌体,说明基因组上重组了td-tomato基因的大肠杆菌可以成功表达红色荧光。 1.1.6egfp-rk2质粒的构建- pcr扩增egfp基因,bamhi和ecori限制性内切酶消化后,将egfp基因在t4dna连接酶的作用下连入rk2-em7质粒。 基因片段双酶切体系:bamhi1μl;ecori1μl;10×mbuffer2μl;dna2l,灭菌水补足20l。 t4连接体系:酶切产物(2μl),10×t4dnaligase缓冲液(2.5μl),t4dnaligase(1μl)rk2-em7质粒载体(0.03pmol)和ddh2o(补齐至25μl),16℃过夜反应。得到rk2-egfp质粒。 分子量标准采用的是1kbdnamarker,1-9泳道分别是egfp-rk2质粒用bamhi和ecori限制酶内切的产物,由电泳图5可以看出,egfp基因已成功标记在rk2质粒上。 1.2双荧光标记重组菌k12td-tomato:rk2(egfp)的构建 制备k12td-tomato感受态细胞,电转rk2-egfp质粒至k12td-tomato感受态,电转转入的具体操作步骤见前述方法步骤。将转化子涂布在含有50μg/ml安普霉素的lb固体培养基中,37℃过夜后挑取克隆子在荧光显微镜下观察荧光。 1.2.1egfp-rk2转入k12td-tomato的绿色荧光验证 由荧光显微镜下照片(图6)可以看出,egfp-rk2成功转入供体菌中,并能显著的表达绿色荧光。 1.2.2k12td-tomato:rk2(egfp)供体菌的双荧光检测 由图7可以看出,构建的k12td-tomato:rk2(egfp)供体菌能够稳定的同时发出绿色和红色荧光,并且荧光的表达是自发的,不需要底物的诱导。 实施例2 双荧光标记重组菌k12td-tomato:rk2(egfp)与粪便固有菌群的体外接合转移 为了测试和检验rk2质粒的接合转移性能,以构建的双荧光标记重组菌k12td-tomato:rk2(egfp)为供体菌,未喂食细菌的空白对照组的斑马鱼粪便肠道细菌为受体菌,进行体外结合;体外接合一段时间后,在3d-sim结构化超分辨率荧光显微镜下观察供体菌和接合子的情况,并用未转入egfp-rk2质粒的k12td-tomato供体菌作为对照。结果见图8。从图中可以根据细菌表达的不同颜色的荧光蛋白而很直观的将接合子从供体菌中分离出来。供体菌基因组上敲入了td-tomato片段,并且携带的rk2质粒上带有egfp基因,因此供体细胞可以同时表达红色和绿色两种荧光蛋白,接合子通过接合转移接受了来自供体菌的质粒,因此只能表达绿色荧光蛋白(图8a)。在对照组,由于供体菌中没有转入接合质粒,因此只能观察到供体菌表达的红色荧光蛋白,没有观察到接合子的产生(图8b)。图8c显示出供体菌可以通过接合转移将质粒传递给斑马鱼粪便中的固有菌群,而发生转移的接合质粒在粪便的固有菌群中也可以稳定的表达绿色荧光蛋白。 实施例3 斑马鱼肠道和粪便中供体菌和接合子的流式细胞分选 给斑马鱼喂食供体菌(双荧光标记重组菌k12td-tomato:rk2(egfp)直至20d,此时供体菌接合质粒和肠道固有细菌的接合转移达到最大,处于平台期,解剖斑马鱼并收集粪便细菌和肠道细菌,用流式细胞分选技术将供体菌和接合子分离,同时回收分离的接合子用于后续检测。具体方法步骤如下:将样品置于装有氩离子激光器的流式细胞分选仪中进行分选。fl1通道(581nm,21nm带宽的滤波器)收集的是不含rk2质粒的k12cm菌发出的红色荧光信号(p1),fl2通道收集的是k12td-tomato:rk2(egfp)供体菌发出的红色和绿色两种荧光信号(p2),fl3通道(488nm的滤波器)收集的是肠道中接受了rk2质粒的接合子发出的绿色荧光信号(p3)。收集到的细胞以荧光散点的方式分布在坐标轴内。设门采用的是散射光设门法。即前向散射光(fsc)和侧向散射光(ssc)联合设门法,排除碎片或噪声的干扰,同时考虑到荧光的阴性对照,使设置的门都在fscvsfitc或fitcvspe等荧光分析点图上。1ml灭菌的pbs作为鞘液,最后分选后的细胞收集在15mlfalcon流式细胞管中。流式细胞分析结果见图9。从图9(a)中可以看出,在p2通道中收集了14.6%的信号(gfp阳性,td-tomato阳性),它们是来自前肠样本中供体细胞,百分比数据表示的是在前肠,供体菌数量占细菌总数的14.6%。p3通道共收集了8.1%gfp阳性,td-tomato阴性的信号,表示前肠中接合子的数量占细菌总数的8.1%。图9(b)中显示,在中肠肠段,供体菌和接合子数量相近,分别为11.0%和8.1%。然而,与前肠和中肠相比,后肠样品的p3通道(gfp阳性,td-tomato阴性)分选出的接合子数量更多,占全部细菌总数的10.8%,供体菌的相对数量变化不大,如图9(c)所示。在粪便样品中,供体菌和接合子占全部细菌总数的比例与后肠相似,分别为11.0%和10.3%,如图9(d)所示。 流式细胞分选的结果显示出更多的接合子定植分布在后肠和粪便中,也就是斑马鱼后肠和粪便中的固有菌群更容易接受质粒,成为接合子,而后肠是产生粪便的重要场所,因此,rk2质粒在体内接合转移发生最活跃的场所是后肠肠段。 实施例4 接合子的细菌物种和丰度分析 为了鉴定接合子的物种组成和丰度分布,采用16srdna高通量扩增子技术对流式细胞分选回收的接合子样本进行测序分析。物种注释结果如热图中所示(图10)。 结果显示,肠道和粪便的接合子中既包括可培养细菌,也包括非可培养细菌,后者占全部接合子的90.4%~97.2%。其中气单胞菌属(aeromonas)丰度最高,占全部细菌的90%以上(均值为90.0%~96.7%),是肠道固有菌群中接合转移发生频率最高,最容易获得rk2质粒的物种。其它的接合子主要来自proteobacteria,firmicutes和fusobacteria菌门(加起来占大约5%)。除aeromonas外,来自proteobacteria门的可培养细菌shewanella以及enterobacteriaceae也是肠道固有菌群中重要的接合子。各段肠道中细菌的物种组成及丰度分布情况如下:在前肠中,来自proteobacteria门的aeromonas,polynucleobacter,achromobacter为主要的非可培养接合子,占90.4%,可培养的接合子主要是来自enterobacteriaceae,comamonadaceae和halomonas科的其它菌属(属水平未比对到分类信息)以及来自proteobacteria门的shewanella和pseudomonas,它们共占了总接合子的9.6%。在中肠,非可培养接合子主要是来自proteobacteria门的aeromonas,polynucleobacter和achromobacter,共占97.2%,而来自enterobacteriaceae和comamonadaceae科的其它菌属,以及proteobacteria门的shewanella和halomonas等可培养细菌,占总接合子的2.8%。在后肠中,非可培养接合子主要是来自proteobacteria门的aeromonas,polynucleobacter和achromobacter,共占96.0%,而可培养接合子主要来自enterobacteriaceae和comamonadaceae科的其它细菌以及来自proteobacteria门的shewanella,占全部接合子的4.0%。在粪便里,非可培养细菌主要是来自proteobacteria门的aeromonas,burkholderia和thiohalorhabdus以及fusobacteria门的cetobacterium,占93.8%,可培养细菌主要是enterobacteriaceae科的其它菌属,proteobacteria门的shewanella和halomonas,占总接合子的6.2%。 由上述实施例可知,本发明提供的双荧光标记的重组菌携带的两种荧光标记基因便于对所述重组菌分布的检测;并且所述携带绿色荧光标记基因的接合性质粒rk2能够通过结合作用转入到其他种类细菌细胞内,通过荧光信号检测能够准确的确定通过结合作用转入绿色荧光蛋白的细菌的种类和分布;便于不同种类细菌耐药性强弱的判断以及细菌耐药性产生部位的判断。 以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。 序列表 军事科学院军事医学研究院环境医学与作业医学研究所 一种双荧光标记的重组菌及其制备方法和在研究耐药基因体内转移中的应用 4 siposequencelisting1.0 1 27 dna 人工序列(artificialsequence) 1 cggaattcagcgatagcgccggcttag27 2 33 dna 人工序列(artificialsequence) 2 cccaagcttccgttctgaatacatcaagcaatt33 3 30 dna 人工序列(artificialsequence) 3 ggggtacctggcaggaagataagtaacagc30 4 24 dna 人工序列(artificialsequence) 4 cgatttctacttactcaccaccag24 |
【本文地址】