细胞微管与芬苯达唑、秋水仙素抗癌原理研究 |
您所在的位置:网站首页 › teinsaz和fz区别 › 细胞微管与芬苯达唑、秋水仙素抗癌原理研究 |
细胞微管与芬苯达唑、秋水仙素抗癌原理研究
|
在细胞骨架中,微管是直径最大的,其内径为15nm,外径为24nm,几乎存在于所有的真核细胞中,部分微管为暂时性的,例如细胞分裂时的纺锤丝,也有部分是永久性的,如纤毛和鞭毛中的微管。 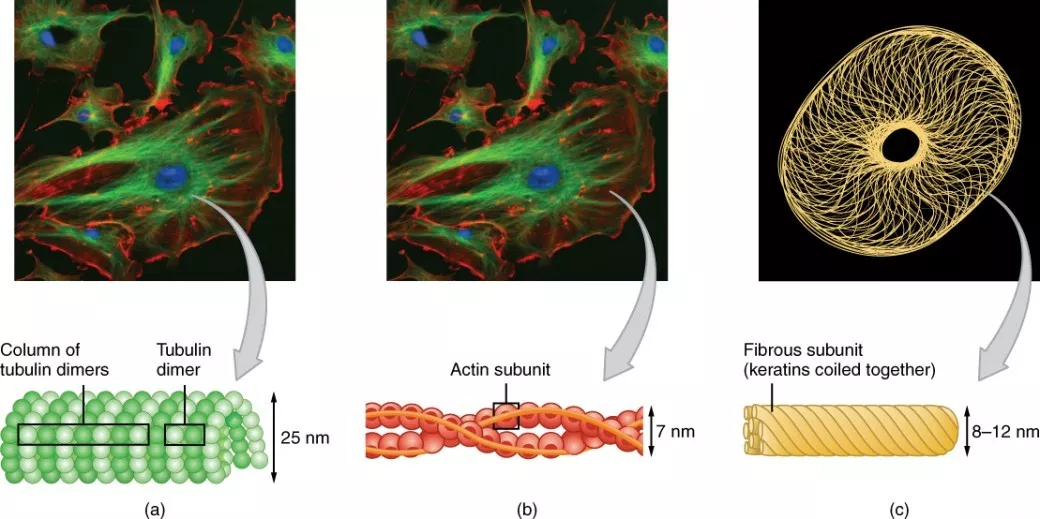 (a)代表微管,(b)代表微丝,(c)代表中间丝 微管是由微管蛋白组装形成的,微管蛋白包括两种类型:α-微管蛋白和β-微管蛋白  图片来自于: OpenStaxBiology. 微管的横截面有13个球形蛋白质,微管中的球形蛋白二聚体(αβ)纵向排列形成原纤丝,13根原纤丝合拢后形成微管,但是二聚体蛋白在纵向排列上存在1nm左右的交错,因此微管蛋白沿微管的四周呈螺旋状排列。 微管的结构是一个动态的,微管是可以延长的,人们一般将组装较快的一极称为正极(通常末端为β-微管蛋白),另一端称为负极。  秋水仙素的作用机理是结合在β-微管蛋白的秋水仙素结合位点上,阻止αβ-蛋白二聚体的聚合,从而抑制微管的形成,进而抑制纺锤体的形成。 ▼  图中的Colchicinebinding site即为秋水仙素的结合位点 功能 1、维持细胞形态 2、细胞器定位 3、参与囊泡运输 4、鞭毛和纤毛 机体很多细胞均具有纤毛。上呼吸道的上皮细胞是一个常见的例子,其纤毛可以有规律的摆动(朝向咽喉方向摆动),可以将呼吸进入的灰尘、花粉、细菌等物质连同粘液有规律的“挪到”喉部,再此引发咳嗽反射,最终排出体外。另一个例子就是雌性动物的输卵管上皮细胞,其纤毛的运动有助于受精卵运动至子宫中。  鞭毛要比纤毛粗长,人体细胞中唯一具有鞭毛的就是精子,其鞭毛的摆动有助于精子游动,在输卵管位置与卵细胞相遇,完成受精。鞭毛在细菌中比较常见,参与细菌的运动。  细菌鞭毛运动的模式图 无论是鞭毛还是纤毛,均具有相同的结构,均属于9+2型:由9个二联体微管组成环形结构,内部还具有两条中央微管。  上图为电子显微镜实图,下图为模式图,图片引自"Thecytoskeleton: Figure 5," by OpenStax College, Biology (CC BY 3.0). 动力蛋白沿着微管的纵轴分布,会产生一种使得微管弯曲的力,以此提供微管运动的动力。 基础小体是纤毛或鞭毛形成的关键,可以看成是一个中心粒。 5、参与细胞分裂 细胞分裂过程中,着丝点分裂之后,两条染色单体分开称为子染色体,子染色体在纺锤丝的牵引下移向细胞两极,此处的纺锤丝就是微管。 已经临床批准或经过实验测试的癌症以外的病症但被发现具有以前未被认识的对恶性细胞的细胞毒性的药物可以作为适合的抗癌候选物。N-(6-苯基硫烷基-1H-苯并咪唑-2-基)氨基甲酸甲酯[Fenbendazole,FZ],苯并咪唑化合物,是一种安全且廉价的驱虫药,具有有效的抗增殖活性。在我们早期的工作中,我们报道了FZ的有效生长抑制活性,部分是由蛋白酶体功能的损害引起的。在这里,我们显示FZ表现出对哺乳动物微管蛋白的中等亲和力,并且在微摩尔浓度下对人癌细胞发挥细胞毒性。同时,它引起p53的线粒体易位并有效抑制葡萄糖摄取,GLUT转运蛋白以及己糖激酶(HK II)的表达 - 己糖酶(HK II) - 大多数癌细胞茁壮成长的关键糖酵解酶。当小鼠口服给药时,它阻断了nu / nu小鼠模型中人异种移植物的生长。结果与我们早期的数据一起表明,FZ是一种新的微管干扰剂,具有抗肿瘤活性,可以作为潜在的治疗剂进行评估,因为它对多种细胞途径有效,可有效消除癌细胞。 微管在细胞分裂,运动,细胞内运输中的重要性以及它们根据环境调节细胞形状的作用使其成为抗癌治疗最成功的靶标之一。扰乱微管动力学的药物已被广泛用于癌症治疗1,2,3,4。考虑到有丝分裂剂在癌症治疗中的相对成功,微管可被称为迄今为止鉴定的最佳癌症靶标之一。  微管靶向剂可大致分为两大类。第一类由微管去稳定剂组成,其抑制微管聚合。这类抗有丝分裂药物包括几种化合物,例如长春花生物碱(长春碱,长春新碱,长春瑞滨,长春地辛,长春氟宁),雌莫司汀,秋水仙碱和combretastatin,它们在临床上使用或正在进行癌症治疗的临床研究。第二类由微管稳定剂组成。这些药物包括紫杉醇,多西紫杉醇,埃坡霉素和discodermolide6。在分裂细胞中用这两类药物破坏微管蛋白和微管动力学的结果是中期停滞和诱导细胞凋亡。 芬苯达唑(N-(6-苯基硫烷基-1H-苯并咪唑-2-基)氨基甲酸甲酯)是广谱苯并咪唑驱虫剂,被批准用于许多动物物种7。重新利用显示出有希望的人类使用结果的兽药可以大大减少开发新药所需的时间和成本。已知芬苯达唑具有高安全范围,并且大多数物种对其耐受性良好。它在实验动物中具有非常低的毒性和高度安全性8,9,10,11,12。在该研究中,我们显示芬苯达唑(FZ)对人癌细胞表现出中等的微管解聚活性,但具有有效的抗肿瘤作用,这在体外和体内实验中是明显的。我们的结果表明,FZ通过破坏微管动力学,p53激活和参与多种细胞途径的基因的调节发挥其抗肿瘤作用。由于GLUT转运蛋白和关键糖酵解酶的下调,FZ处理还导致癌细胞中葡萄糖摄取减少。 由于肿瘤发生过程涉及许多基因和蛋白质改变各种细胞信号传导途径,单靶药物显示出有限的功效并可能导致耐药性13,14,15。因此,除了具有避免产生抗性的可能性之外,预期具有多个细胞靶标的药剂具有改善的功效。 总的来说,本研究表明FZ对癌细胞的多效性导致细胞死亡。因此,FZ可能具有潜在的治疗应用。 FZ使人NSCLC细胞中的微管蛋白网络不稳定 据报道,苯并咪唑氨基甲酸酯抑制微管蛋白聚合并破坏寄生虫细胞中的微管功能[16,17]。使用富含蠕虫和哺乳动物微管蛋白提取物的体外研究结果表明,微管蛋白是苯并咪唑18的主要分子靶点。因此,为了检查FZ对哺乳动物微管网络组织的影响,用1μMFZ处理人非小细胞肺癌(NSCLC)A549细胞24小时,并使用α微管蛋白抗体进行免疫荧光处理。秋水仙碱用作阳性对照。结果显示FZ处理导致微管网络的部分改变(图1a)。与对照模拟处理的细胞相比,细胞核周围的微管笼似乎已失去其完整性。然而,该组织中的这种修饰并不像秋水仙碱处理那样显着,其表现出微管完全解聚成微管蛋白亚基。该数据表明FZ导致细胞的微管框架扭曲。  FZ治疗改变人癌细胞的微管蛋白网络。 (a)用1μMFZ或50ng / ml秋水仙碱处理A549细胞24小时。处理后,使用抗α-微管蛋白一级和FITC缀合的二级抗体处理细胞用于免疫荧光。 (细胞核用碘化丙啶复染)(b)将牛微管蛋白(1.8mg / mL)与DMSO(对照),FZ(10μM)或秋水仙碱(100nM)一起温育,通过测量浊度通过分光光度法监测聚合效果。如“方法”中所述,在340nm处。(c)用FZ,诺考达唑,紫杉醇或秋水仙碱处理细胞24小时,然后裂解并分级成可溶性(S)和聚合的(P)提取物。用SDS-PAGE分离提取物,转移到PVDF膜上并用抗α-微管蛋白和抗β-肌动蛋白抗体探测。显示了A549细胞中的代表性免疫印迹分析。 (d)通过NIH ImageJ程序测量免疫印迹的每个条带的强度,并计算每种处理中可溶性和聚合的微管蛋白和β-肌动蛋白的比例。 (e)如所示用不同的MTA处理细胞24小时,然后使用Ac-α-微管蛋白(6-11B-1)特异性和β-肌动蛋白抗体进行蛋白质印迹。 (全长未剪切的印迹包括在补充图S6中)。 通过体外测定进一步评估FZ对微管蛋白聚合的影响。将纯化的牛微管蛋白与FZ一起温育,并随时间记录微管蛋白聚合。结果显示FZ在体外对微管蛋白聚合的轻度抑制,这与秋水仙碱处理的情况不同。 (图1b) 接下来,将FZ对微管蛋白聚合的作用与其他微管去稳定剂如诺考达唑和秋水仙碱的作用进行比较。在药物处理24小时后制备聚合的和可溶的级分,并使用α-微管蛋白和β-肌动蛋白抗体进行蛋白质印迹(图1c)。聚合的和可溶性级分的微管蛋白条带在归一化后用它们各自的β-肌动蛋白条带定量,其用作内部对照(图1d)。与对照未处理的细胞相比,FZ处理的细胞中聚合微管蛋白适度降低,而在秋水仙碱处理的细胞中几乎不存在聚合形式的微管蛋白。结果证实,与其他已知的微管破坏剂如诺考达唑和秋水仙碱相比,FZ的相对温和的微管蛋白解聚活性。 紫杉烷和长春花生物碱的主要限制因素是它们的剂量限制性毒性和对多药物耐药性(MDR)的易感性,通常由于p-糖蛋白(p-gp; MDR1)的高表达而发生19,20。 已知β-微管蛋白同种型和突变的过表达赋予对紫杉烷的抗性21。 与紫杉烷和长春花生物碱不同,靶向秋水仙碱结合位点的试剂是有利的,因为除了它们克服β-微管蛋白同种型过表达的作用的能力之外,它们显示出最小的多药耐药性22,23,24。 然而,秋水仙碱及其衍生物的主要缺点是它们对人类的急性毒性22,25。 因此,与秋水仙碱结合位点结合但毒性低的微管抑制剂可以非常有效26,27。 基于荧光的竞争性秋水仙碱结合测定的结果表明FZ可以在秋水仙碱结合位点结合微管蛋白(图S1)。 微管蛋白乙酰化与微管的稳定性有关。 因此,为了检查治疗后微管蛋白的乙酰化状态,用不同的微管靶向剂处理人NSCLC细胞24小时,并使用Ac-α-微管蛋白特异性抗体(6-11B-1)对细胞提取物进行蛋白质印迹分析。。 如图1e所示,尽管诺考达唑,秋水仙碱和长春新碱导致乙酰化微管蛋白的显着减少,但与对照模拟处理的细胞相比,FZ没有改变乙酰化微管蛋白的量。 该结果进一步证实了与其他已知的微管解聚剂相比,FZ对哺乳动物微管蛋白的相对温和的作用。 FZ不是P-gp底物或抑制剂 耐药性的发展是癌症治疗中的主要问题。由编码P-糖蛋白(P-gp)的MDR-1基因的过表达引起的多药耐药性(MDR)是耐药性的关键机制,其导致对多类药物的交叉耐药性28,29。大量常用的化疗药物如紫杉烷和长春花生物碱是P-gp底物30。然而,由于不可避免的副作用,抑制P-gp的努力没有显示出令人鼓舞的结果31,32。因此,发现和开发不是P-gp底物的新型抗增殖化合物是克服耐药性的有效方法。 为了测试FZ是否是P-gp的底物或抑制剂,我们研究了在P-gp抑制剂维拉帕米存在下FZ对癌细胞生长的抑制作用。结果显示维拉帕米对P-gp的抑制不会增强FZ对癌细胞增殖的抑制作用(图2c)。荧光染料罗丹明123(Rho123)是众所周知的参考P-gp底物,常用于测定药物的P-gp抑制潜力33。在未处理对照和FZ处理的细胞之间未观察到Rho123积累的显着差异,这意味着FZ与P-gp之间不存在任何相互作用。 (图2a,b)在维拉帕米存在下,经处理和未经处理的细胞显示出相当水平的Rho123积累,证实FZ不是P-gp的底物或抑制剂。  FZ治疗导致早期G2 / M阻滞伴随细胞死亡 由于微管蛋白聚合的抑制阻断细胞周期进展并且可以诱导有丝分裂灾难,因此检查了芬苯达唑对细胞周期进展的影响。通过血清饥饿将A549细胞同步48小时,并用1μMFZ处理不同的时间间隔。在细胞分裂期间,细胞周期蛋白B1与细胞周期蛋白依赖性激酶1(CDK1)结合,允许从G2转变为有丝分裂。此后,从中期到后期的进展需要泛素化和蛋白酶体介导的由后期促进复合物(APC)34诱导的细胞周期蛋白B1的降解。我们的结果显示FZ处理的细胞中细胞周期蛋白B1 / CDK1水平的早期升高(8小时与对照未处理细胞的情况下16小时相比)(图3a)。此外,组蛋白pH3(Ser10),一种有丝分裂进展的指标,用于评估FZ是否特异性地在有丝分裂期诱导细胞周期停滞。如图3b所示,发现p-组蛋白H3(Ser10)在A549细胞中FZ处理后12和24小时上调。该数据证实FZ导致人NSCLC细胞中有丝分裂期的细胞周期停滞。通过流式细胞术定量细胞周期的不同阶段的细胞和经历凋亡的细胞。凋亡细胞的数量以时间依赖性方式增加,同时细胞周期蛋白B1水平降低,并且在FZ处理32小时后~30%细胞经历凋亡(图4a)。细胞周期蛋白B1水平在处理40和48小时时进一步下降,相当于凋亡细胞百分比的进一步增加。因此,细胞周期蛋白B1水平的降低伴随着凋亡细胞死亡的增加,表明A549细胞明显经历有丝分裂退出,随后响应于FZ处理而死亡。  FZ导致细胞周期蛋白B1水平的早期升高并诱导有丝分裂停滞。a(i)和a(ii)A549细胞通过血清饥饿同步48小时,然后不处理或用1μMFZ或50nM秋水仙碱处理指定的时间间隔。 然后使用细胞周期蛋白B1,cdk1和β-肌动蛋白抗体处理细胞提取物用于Western免疫印迹。b(i)和b(ii)用1μMFZ处理A549细胞指定的时间间隔,然后使用pH3和β-肌动蛋白抗体处理提取物用于蛋白质印迹。 使用ImageJ软件对条带进行定量。 (全长未剪切的印迹包括在补充图S6中)。  有丝分裂停滞,随后在人NSCLC细胞中响应FZ而死亡。 (a和b)如前所述在同步后处理细胞,并进行FACS分析以检测细胞周期的不同阶段中的群体部分以及凋亡细胞。 (c)用1μMFZ处理H460细胞24小时,并在相差显微镜(i和ii)下或在荧光显微镜(iii和iv)下Hoechst 33342染色后观察细胞形态。 进行TdT染色以检测凋亡细胞核(v&vi)。 虽然在32小时FZ处理后观察到显着的凋亡群体(亚G1期),但相反,秋水仙碱处理的细胞在相同时间点经历多倍体(图4b)。FZ强制细胞在有丝分裂中积累,导致细胞凋亡的显着增加,而没有进展到G1样状态的证据。 图4c显示24小时FZ处理后的凋亡细胞。 总体而言,该数据表明FZ导致细胞周期停滞和有丝分裂细胞死亡,与其作为微管抑制剂的作用一致。 在我们早期的工作中,我们报道了广谱半胱天冬酶抑制剂Z-VAD-FMK对FZ诱导的细胞死亡没有任何影响35。 目前的数据表明由FZ引起的有丝分裂细胞死亡为该结果提供了可能的解释,因为有丝分裂细胞死亡可以是半胱天冬酶不依赖的,并且已知不受半胱天冬酶抑制剂Z-VAD-FMK36的影响。 具有野生型p53的肿瘤细胞系显示出对FZ诱导的细胞凋亡的增强的敏感性 用MTU测定法测定用1μMFZ处理H460和A549人NSCLC细胞系显着减少细胞生长(图5a)。与p53突变体或无效细胞相比,具有野生型(WT)p53的肿瘤细胞系似乎对FZ作用高度敏感(图5b),表明在WT p53存在下增强的细胞凋亡诱导活性。与该数据一致,在用WT p53构建体瞬时转染后暴露于FZ的p53无效H1299细胞显示出增强的凋亡细胞死亡(图5c)。值得注意的是,与肺癌细胞系相比,FZ对从大鼠肺组织培养的原代上皮细胞显示出较低的毒性(图5d)。在FZ处理后诱导野生型p53靶基因(图6a),表明FZ诱导的WT p53蛋白具有转录活性。然而,FZ也可以独立于p53诱导p21(图6b,c),这可能是通过其对早期报道的蛋白酶体途径的影响35。剂量依赖性FZ处理导致WT p53在这些细胞中的核积累增加,这与增强的细胞凋亡活性相关(图6d)。据报道,微管蛋白乙酰化可增强应激介导的p53向细胞核的易位,其中它具有转录活性[38,39]。因此,增强的p53核积累与早期数据同时显示FZ处理细胞中乙酰化微管蛋白的稳定水平。总之,证据支持转录活性p53在FZ轻度微管破坏后增加细胞死亡的积极作用。  FZ介导的体外癌细胞抑制受p53状态的影响。 (a)将人H460或A549细胞接种到96孔组织培养板上。 不处理细胞或用不同剂量的FZ处理细胞48小时。 通过MTT测定法测量细胞活力。 (b)用1μMFZ处理H460,A549,H522或H1299细胞48小时,并通过MTT测定法测量细胞活力。 (c)用p53表达构建体或单独用载体转染H1299细胞。 转染16小时后,将细胞不处理或用FZ处理24小时,然后通过MTT测定法测量细胞活力。 (d)如所示,用1μMFZ处理源自大鼠肺组织的H460细胞或原代肺上皮细胞不同的时间点。 通过MTT测定确定细胞活力。 显着性水平设定为p FZ处理后人NSCLC细胞凋亡和p53的诱导。 (a)在H460细胞中进行FZ处理24小时后,对p53靶基因进行Western印迹。 (b)用p53表达构建体瞬时转染H1299细胞,不处理或用FZ处理24小时。 然后对p53和p21进行Western印迹。 (c)使用Image J软件定量“b”。 (全长未剪切的印迹包括在补充图S6中)(d)在用递增浓度的FZ处理24小时后对H460细胞中的p53进行免疫染色。 FZ诱导p53线粒体易位 我们早先报道了响应FZ处理的细胞凋亡中线粒体膜电位降低,细胞色素c释放和PARP裂解。结果表明,FZ处理导致p53蛋白的积累主要是由于抑制蛋白酶体降解,并且还观察到泛素化形式的p53的积累35。因此,当NSCLC细胞暴露于药物时,我们观察了p53的线粒体水平。为此,用GFP-p53构建体转染p53无效H1299细胞,并在用不同的微管靶向剂处理24小时后检查其亚细胞分布(图7a)。p53的Western印迹显示FZ处理后线粒体部分中p53蛋白水平增加(图7b,c)。另外,响应于FZ处理而转移至线粒体的p53似乎是单泛素化的,表明FZ处理的细胞中单泛素化p53的增加的池转移至线粒体,导致这些细胞中的线粒体细胞死亡途径40(图S3)。相应地,使用JC1电压敏感染料在FZ处理的细胞中也观察到线粒体膜去极化(图7d)。  FZ治疗导致p53向线粒体的易位增加。 (a)用GFP-p53表达构建体瞬时转染H1299细胞,并如前所述进行处理。然后用红色mitotracker染料(Molecular Probes)染色它们,并使用Nikon荧光显微镜获取荧光图像。 (b)用1μMFZ,500nM诺考达唑或100nM紫杉醇处理H460细胞24小时。处理后,使用Sigma的线粒体分离试剂盒分离线粒体。然后在SDS-PAGE上分离全细胞裂解物(WC),细胞溶质(C)和线粒体(M)级分,并使用抗p53,β-肌动蛋白和COX IV抗体进行蛋白质印迹分析。 (c)使用Image J软件量化来自“a”的条带强度,并用β-肌动蛋白(WC和C)或COXIV(M)水平标准化。 (全长未剪切印迹包括在补充图S6中)(d)H460细胞未处理或用1μMFZ处理24小时,然后加工用于JC-1染色(i,对照; ii,FZ)。 FZ对葡萄糖摄取的抑制使癌细胞发生凋亡在寄生虫研究中,苯并咪唑的驱虫作用与葡萄糖摄取的抑制有关,导致葡萄糖代谢的改变41。 我们测试了FZ对人癌细胞中葡萄糖摄取的影响。 用1μMFZ处理H460和A549细胞4小时,观察到荧光葡萄糖类似物2-NBDG的摄取。FZ处理导致两种细胞系中葡萄糖摄取的抑制(图8a)。 当使用来自用递增浓度的FZ处理的细胞的培养上清液进行葡萄糖氧化测定时,获得了类似的结果(图8b)。 预计,FZ治疗还导致乳酸水平降低(图8c)。 因此,FZ诱导的细胞死亡似乎与葡萄糖摄取的抑制有关。  FZ改变葡萄糖摄取并损害HKII在NSCLC细胞中的酶活性。 (a)用1μMFZ处理A549或H460细胞4小时,然后如所述通过荧光显微镜检查荧光葡萄糖衍生物2-NBDG的摄取。显示了来自三个独立实验的细胞的代表性图像。 (b)将人NSCLC H460细胞暴露于增加剂量的FZ 24小时。然后使用来自Sigma的GO测定试剂盒,通过葡萄糖氧化测定法将培养物上清液用于评估葡萄糖消耗。 (c)不处理H460细胞或用1μMFZ处理,并使用BioVision的乳酸盐测定试剂盒在指定的时间点评估培养上清液中的乳酸水平。 (d)如所示,将人H460细胞暴露于1μMFZ24或48小时,分离总RNA并使用对指定基因特异的引物进行RT-PCR。 (e)(i)不处理H460细胞或用1μMFZ处理24小时,然后处理细胞提取物用于SDH(A630nm)的分光光度测定。 (ii)A549细胞未经处理或用1μMFZ处理20小时,然后对其进行组织化学分析以评估SDH活性。然后在显微镜下观察细胞,并以40X放大率获得图像。 (f)不处理H460细胞或用1μMFZ处理24小时。然后如“材料和方法”中所述用分光光度法测定HK酶活性。 (g)在开始反应之前,将H460和A549细胞裂解物与DMSO或FZ一起温育15分钟。然后如“材料和方法”中所述用分光光度法测定HK酶活性。 (h)将来自酿酒酵母的纯化的HKII与增加剂量的FZ一起温育,然后用分光光度法测量HK活性。 (* p |
【本文地址】
今日新闻 |
推荐新闻 |
