欧盟原料药ASMF注册管理制度简介 |
您所在的位置:网站首页 › smf是什么药 › 欧盟原料药ASMF注册管理制度简介 |
欧盟原料药ASMF注册管理制度简介
|
原标题:欧盟原料药ASMF注册管理制度简介 欧盟原料药大部分来源于欧盟以外的地区,这对于国产企业而言,既是机会也是挑战。目前原料药进入欧盟市场主要有两种途径,一是CEP认证,二是ASMF注册。上次笔者已对原料药CEP注册管理制度进行了介绍,本文笔者将介绍原料药ASMF注册管理制度,以期帮助业内同仁更全面的了解欧盟原料药注册管理制度。 1. ASMF简介 活性物质主文件(ASMF,Active Substance Master File),以前称为欧洲药物主文件(EDMF,European Drug Master File),是由原料药生产商向欧洲药品管理局(EMA)或欧盟各成员国药政递交的包含原料药保密信息的技术文件,用于支持制剂生产商的上市许可(MA)申请。 ASMF适用于以下三类原料药的申请: - 新的活性物质; - 已存在的活性物质,但还未被欧洲药典或欧盟成员国的药典收录; - 已被欧洲药典或欧盟成员国的药典收录的药物活性物质。 2. ASMF的注册流程 与CEP认证区别较大的是,ASMF的申报必须与使用该原料药的制剂的MA申请关联进行(ASMF要求不早于MA一个月或不晚于MA递交),原料药生产商通过开具授权信(LOA)实现与制剂上市许可申请的关联审评,这就意味着ASMF的审评程序和相应的制剂上市许可申请的审评程序是一致的。 ASMF的一般申报流程如下所示:
索引该ASMF的制剂MA申请的审评程序有四种,如下所示:
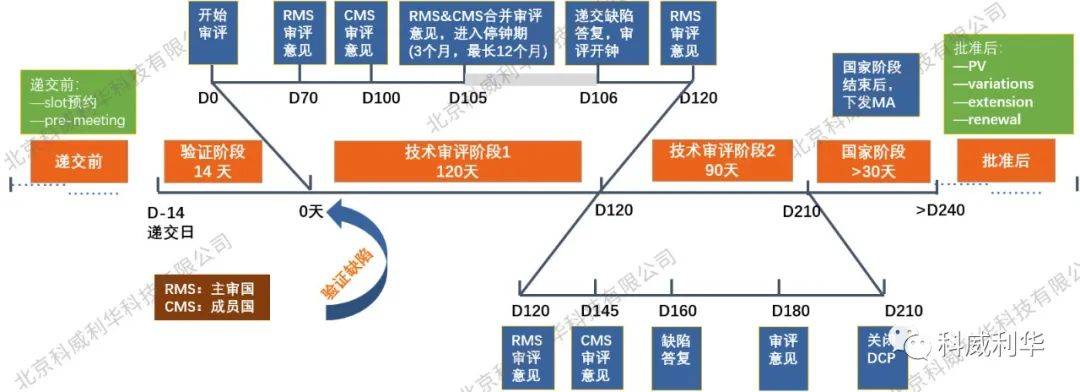
以制剂MA的非集中审评程序(DCP)为例,其审评流程如下所示:
3. ASMF申报资料要求 根据欧盟的指南,ASMF申报资料中的M2和M3分为公开部分(Applicant’s part, AP)和保密部分(Restricted part, RP),其要求总结如下:
4.ASMF常见缺陷
5. 结 语 ASMF是用于支持制剂MA申请而必须向药政部门提交有关原料药的基本情况的支持性技术档案。ASMF注册管理制度既能让制剂上市许可持有人作为药品质量的责任人能够了解原料药质量控制的必要信息,又可以保护原料药生产企业的技术机密。同时,ASMF并不局限于已被药典收载的活性物质,这很好的弥补了CEP认证的局限,使原料药在欧盟的注册申报更为灵活。返回搜狐,查看更多 责任编辑: |
【本文地址】
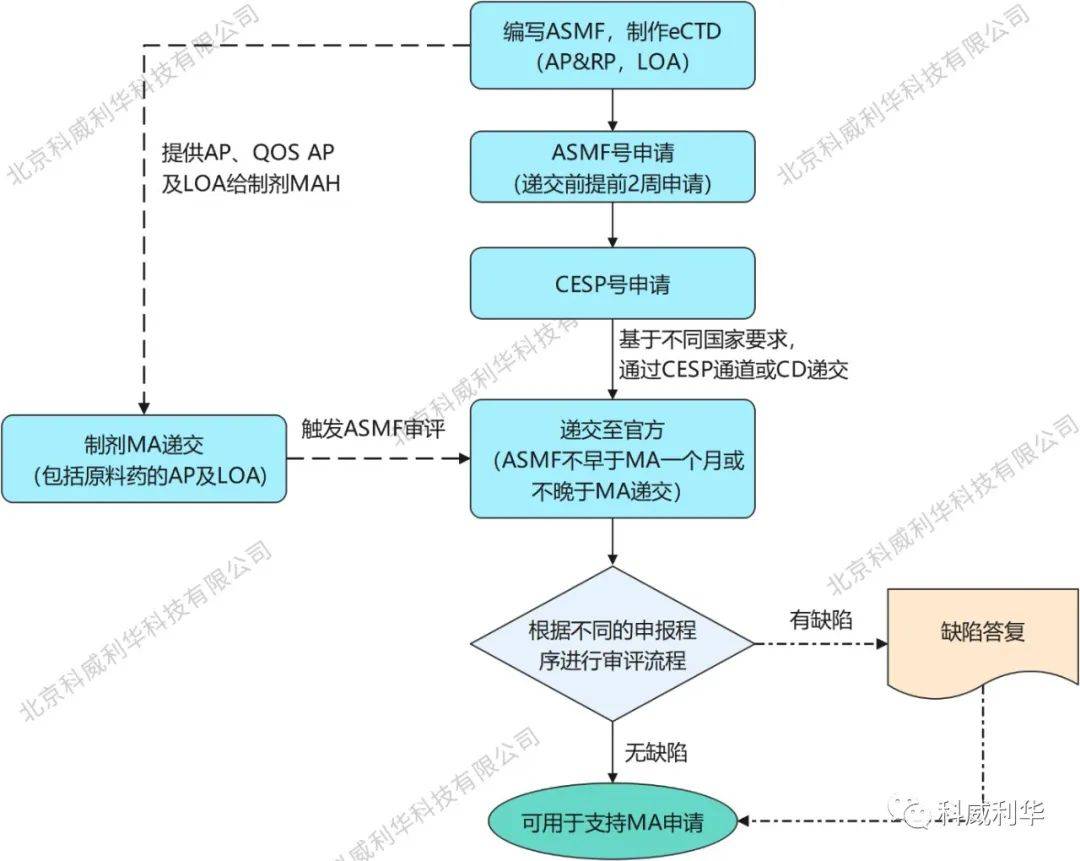 ASMF申报流程
ASMF申报流程