某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金 |
您所在的位置:网站首页 › si的最高价含氧酸 › 某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金 |
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金
|
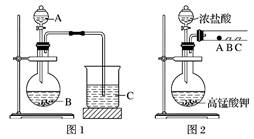
某研究性学习小组设计了一组实验来探究元素周期律。 甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究; 乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。 已知常温下浓盐酸与高锰酸钾能反应生成氯气; 可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
(1)甲同学实验中(图1): ①从给出试剂中选出最佳物质(填化学式):A________,B________。 ②烧杯C中发生反应的离子方程式为__________________________。 (2)乙同学实验中(图2): ①写出A处反应的离子方程式________________________。 ②B处实验现象是________________________。 ③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。 答案 HNO3 CaCO3 CO2+SiO32-+H2O===H2SiO3↓+CO32- Cl2+2Br-===Br2+2Cl- 试纸变蓝 2.24 L 【分析】 (1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可; (2)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物确定实验现象,根据化学方程式计算氯气体积,或者得失电子数相等列关系式计算。 【详解】 (1)甲同学实验中(图1): ①根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硝酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,所以A为稀硝酸,B为碳酸钙,C为硅酸钠; 答案: HNO3 CaCO3 ②图1烧杯中为二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-; 答案:CO2+SiO32-+H2O===H2SiO3↓+CO32- (2)乙同学实验中(图2): ①根据题干信息:乙同学设计了如图装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是同主族单质氧化性越强阴离子还原性越弱,对应元素非金属越强,高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的,即A处:Cl2+2Br-=2Cl-+Br2; 答案:Cl2+2Br-=2Cl-+Br2。 ②B处反应:Cl2+2I-=2Cl-+I2,所以B处的现象变蓝,剩余的氯气能使湿润红纸褪色; 答案:试纸变蓝 ③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。 根据得失电子数相等列关系式:设氯气生成nmol 2KMnO4~5Cl2 2mol 5mol 0.04mol nmol n= V=nVm=0.1mol×22.4L/mol=2.24L; 答案:2.24L。 【点睛】 本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,具有较强的综合性,有一定的难度,注意实验设计的原理和方法。 |
【本文地址】
今日新闻 |
推荐新闻 |