超声波辅助提取对花生蛋白结构与功能特性的影响 |
您所在的位置:网站首页 › sdspage分离范围 › 超声波辅助提取对花生蛋白结构与功能特性的影响 |
超声波辅助提取对花生蛋白结构与功能特性的影响
|
耿军凤,张丽芬,陈复生,* (1.河南工业大学粮油食品学院,河南郑州450001;2.河南省南街村(集团)有限公司,河南漯河462000) 花生是我国主要的油料作物之一,资源十分丰富。2016 年我国花生年产量达1 728.98 万吨,居世界首位[1]。花生中蛋白质含量约为25%~35%,且含有大量人体必需氨基酸,其营养价值与动物蛋白相近,易被人体消化和吸收,是一种理想的植物蛋白质资源[2]。与大豆蛋白相比,天然花生蛋白的功能性较差,主要是因为花生榨油过程中经高温压榨及提取过程中使用有机溶剂造成了蛋白质发生不可逆变性,从而限制了其在食品工业的应用[3]。研究超声波辅助提取对花生蛋白结构和功能特性的影响,对拓宽花生蛋白在食品工业上的应用领域具有重大的意义。 超声波通过与介质之间的相互作用,能够引起一系列物理化学反应,从而造成空化效应、机械效应和热效应等[4]。利用超声波的空化效应,在液体介质中产生空穴气泡,气泡破裂导致破裂处的能量释放,产生局部超高温(5 000 K)和超高压(1 000 MPa),位于空化区域的植物细胞组织发生变形、破裂,进而产生增溶作用,有利于充分提取蛋白质等有效成分[5]。与其他提取方法相比,超声波因具有耗能少、时间短、纯度好、效率高等优点而被广泛用于蛋白质的提取中。超声波不仅可以提高蛋白质的提取率,在改善蛋白质功能特性方面也有广泛的应用。Flores-Jiménez 等[6]研究超声15 min 和30 min 时菜籽蛋白的溶解度、持水性和持油性的变化,在pH 12 超声30 min 时,其溶解度达到最大值77.96%,而未经超声处理的菜籽蛋白溶解度仅为74.32%;持水性从2.93 g/g(未经超声处理)分别降至2.72 g/g 和2.52 g/g,其原因可能是超声波改变了蛋白质结构,使其表面疏水性增加;同时菜籽蛋白持油性由2.84 g/g(未经超声处理)分别提高到3.06 g/g 和3.26 g/g,可能是超声波对脂肪分子中的烃链作用后非极性残基侧链的暴露,从而使油脂更易吸附。Zhang 等[7]研究超声波预处理对胶束酪蛋白功能特性和结构的影响。结果表明,超声波预处理5 min 后,其溶解度从84.14%显著增加到91.03%;溶解度的增加可能是因为超声波处理后蛋白质的球状结构发生改变,使亲水基团暴露于水中,增强了水-蛋白质的相互作用。此外,超声波处理也改善了酪蛋白的乳化性和凝胶性,这些改变将促进其在食品工业中的应用。 综上所述,利用超声波技术可降低蛋白质提取过程中的变性程度,并改善蛋白质功能特性。目前,超声波技术虽广泛应用于植物蛋白的提取和改性,但在超声波辅助提取花生蛋白过程中对蛋白质功能特性和结构的影响鲜有报道。因此,本文以花生粕为原料,研究超声波辅助提取对花生蛋白功能特性的影响,同时通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis ,SDSPAGE)和傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)等方法研究了其对花生蛋白结构特性的影响规律,研究结果为超声波技术在花生蛋白的深加工利用以及食品加工业的发展中提供了理论依据。 1 材料与方法1.1 材料与仪器花生粕:青岛长寿食品有限公司。 SCIENTZ-IID 型超声波细胞粉碎机、DC-2006 节能型智能恒温槽:宁波新芝生物科技股份有限公司;90-2 型恒温磁力搅拌器:上海亚荣生化仪器厂;GL-20C 型高速冷冻离心机、TDL-5-A 型离心机:上海安亭科学仪器厂;DDY-6D 型电泳仪:北京市六一仪器厂;LGJ-25 型冷冻干燥机:北京四环科学仪器厂有限公司;K1100 全自动凯式定氮仪:海能仪器;PHS-3C pH 计:上海仪电科学仪器股份有限公司;FM200 型高剪切分散乳化机:上海弗鲁克科技发展有限公司;722S可见分光光度计:上海仪电分析仪器有限公司;WQF-510 型FTIR:北京瑞利分析仪器有限公司。 1.2 试验方法1.2.1 样品的制备 花生粕→按料液比1 ∶10(g/mL)加入三羟基甲基氨基甲烷-盐酸(Tris-HCl)缓冲液(pH 8.5)→搅拌分散→离心(20 min 5 000 r/min)→取上清液→调pH 值至4.5→离心(20 min 5 000 r/min)→收集沉淀→沉淀复溶→调pH 值到7.0→4 ℃透析24 h→冷冻干燥→样品至4 ℃保存 1.2.2 超声波处理 将超声波探头置于花生粕悬浮液(70 mL)液面下方3 cm 处,用低温水浴槽控制温度,超声波时间为10、20、30、40、50 min;温度为 5、15、25、35、45 ℃;超声波功率密度分别为 1.58、3.17、4.75、6.33、7.92 W/cm3;占空比为33%、50%、67%、80%、90%;超声波处理样品冻干后备用。 1.2.3 花生粕成分测定 蛋白质含量测定,参照GB/T 5009.5-2016《食品安全国家标准食品中蛋白质的测定》,转换系数为5.46;脂肪含量测定,参照GB/T 5009.6-2016《食品安全国家标准食品中脂肪的测定》;水分含量测定,参照GB/T 5009.3-2016《食品安全国家标准食品中水分的测定》;灰分含量测定,参照GB/T 5009.4-2016《食品安全国家标准食品中灰分的测定》。 1.3 花生蛋白功能性及结构的测定1.3.1 溶解度的测定 参考赵雪淞等[8]的方法,取花生蛋白样品0.25 g分散于10 mL 的去离子水中,搅拌1 h,将分散液在3 000 r/min 离心15 min,上清液及花生蛋白样品蛋白含量测定采用凯氏定氮法定氮,溶解度表达式为: 蛋白质的溶解度/%=上清液蛋白含量/原料中总蛋白含量×100 1.3.2 持水性及持油性测定 准确称取0.5 g 蛋白样品,加入10 mL 蒸馏水于50 mL 离心管中,搅拌均匀,于25 ℃室温放置30 min,然后在5 000 r/min 下离心10 min,除去上清液。 准确称取1 g 蛋白样品,加入5 mL 大豆色拉油,搅拌5 min,5 000 r/min 下离心20 min,弃去上层未吸附油,称质量。 1.3.3 起泡性及泡沫稳定性测定 准确称取1 g 样品置于烧杯中,再加入50 mL 去离子水配制成蛋白质溶液(V0),用磁力搅拌器搅拌1 h,再用高速剪切机以10 000 r/min 高速搅拌2 min 后,转移到100 mL 的量筒中,记录其在0 min 时的泡沫(V1)和下层液体(V2)体积。将液体体系静置30 min 后,再次记录起泡体积(V3)。
式中:V0为原始蛋白溶液体积,mL;V1为 0 min 时泡沫体积,mL;V2为 0 min 时下层液体体积,mL;V3为静置30 min 后泡沫的体积,mL。 1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE) 借鉴 Achouri 等[9]方法,利用 SDS-PAGE 凝胶电泳测定花生分离蛋白的分子量分布。采用12 %分离胶(pH 8.8)和 5 %浓缩胶(pH 6.8),蛋白样品溶解于0.05 mol/L 三羟基甲基氨基甲烷-盐酸(Tris-HCl)缓冲液中,沸水加热5 min 以使蛋白质变性,8 000 r/min 离心,上样10 μL,凝胶电泳于恒流下进行,在浓缩胶中电流为20 mA,进入分离胶后增至40 mA。凝胶用固定液固定1 h 后,以质量分数为0.1 %的考马斯亮蓝(R250)反应染色2 h,最后用含45%(体积分数)甲醇和10%(体积分数)冰乙酸的脱色液脱色至条带清晰(12 h),于凝胶成像系统进行成像处理。 1.3.5 傅里叶红外光谱 将0.01 g 干燥后的花生蛋白样品与1 g 干燥的溴化钾研磨至完全均匀,通过HY-12 型压片机和压片模具,将样品混合物压制成透明薄片,扫描其红外光谱。在分辨率4 cm-1、扫描次数16 次的条件下,采用全反射装置测定透明薄片在400 cm-1~4 000 cm-1范围内的吸收。 1.3.6 巯基和二硫键的测定 参照 Beveridge 等[10]和 Gong 等[11]的方法有所改进,称取0.18 g 花生蛋白用30 mL Tris-甘氨酸缓冲液和10 mL 8 mol/mL 的尿素混匀,磁力搅拌30 min,再10 000 r/min 离心10 min,收集上清液进行测定。测定巯基时,取 4 mL 上清液加入 160 μL Ellman’s试剂(4 mg/mL),在412 nm 处测定吸光度值,以未加蛋白的样品为空白对照。测定二硫键时,取4 mL 上清液加入 8 μL β-巯基乙醇,于 25 ℃保温 2 h,然后加 10 mL 12%三氯乙酸,在25 ℃恒温1 h,以10 000 r/min 离心10 min,沉淀用5 mL 12%三氯乙酸清洗3 次,将沉淀溶于6 mL Tris-甘氨酸缓冲液中,取上述4 mL 溶液加160 μL Ellman’s 试剂混匀后,取 1 mL 上清液加 4 mL Tris-甘氨酸缓冲液混合摇匀后,于412 nm 处测定吸光度值,以未加蛋白的样品为空白对照。
式中:A412为 412 nm 处吸光值;C 为样品浓度(mg(干物)/mL)。
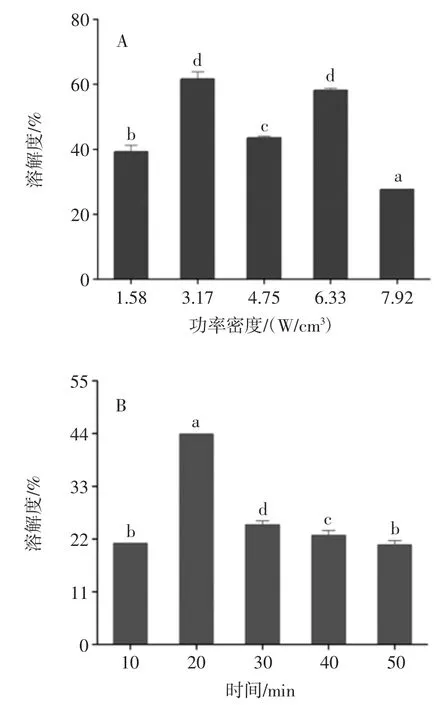
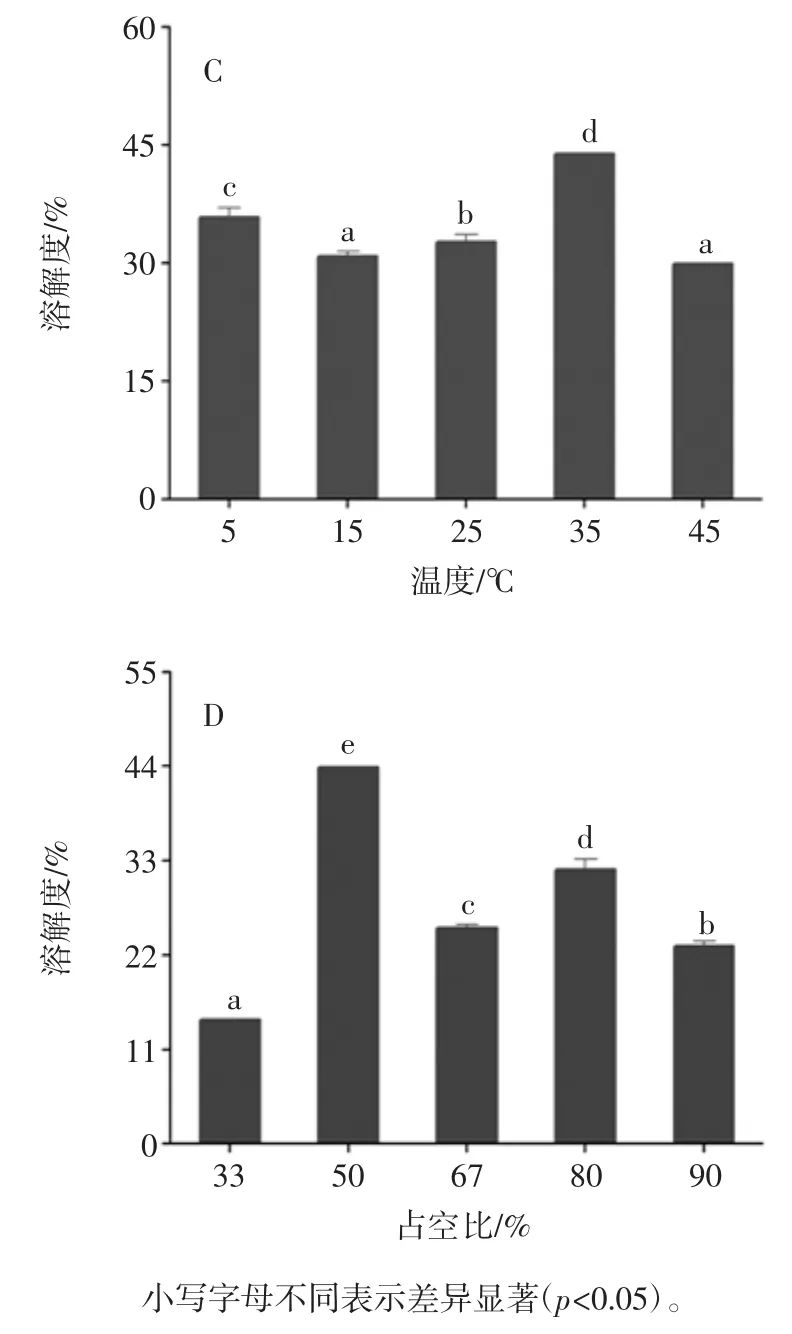
式中:Q1为还原前的巯基数;Q2为还原后的巯基数。 1.3.7 数据处理 每组试验数据取3 次结果的平均值,采用Origin-Pro8.5 软件绘图,并使用SPSS(20.0)对数据进行显著性分析。 2 结果与分析2.1 超声波辅助提取对花生蛋白功能性的影响2.1.1 超声波辅助提取对花生蛋白溶解度的影响 超声波辅助提取对花生蛋白溶解度的影响见图1。
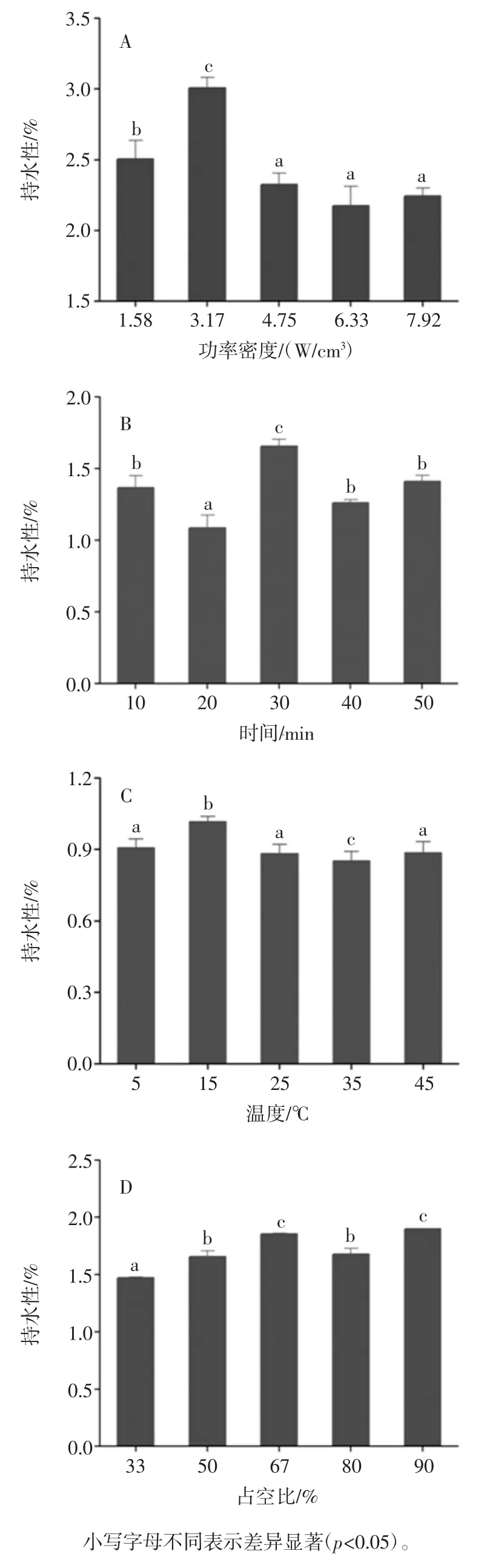
图1 超声波辅助提取条件对花生蛋白溶解度的影响Fig.1 Effect of ultrasound-assisted conditions on solubility of peanut protein 蛋白质的溶解度反映了蛋白质的变性和聚集,是蛋白质功能性的良好指标[12]。从图1 中可知,花生蛋白经超声波处理后溶解度呈现先增后减的趋势。在超声功率密度3.17 W/cm3、时间20 min、温度35 ℃以及占空比50%时,花生蛋白溶解度分别达到最大值。其中在功率密度3.17 W/cm3时,溶解度最大为61.62%,与碱溶酸沉(45.39%)相比提高了16.23%。蛋白质溶解度增加主要是因为超声波处理后蛋白质表面积增加导致其粒径减小和蛋白质-水相互作用增强[13],此结果与Flores-Jiméne 等[6]的研究一致。随着超声功率密度的增加,溶解度有所降低,且与超声时间、温度和占空比变化趋势相同,可能是由于变性蛋白质的聚集形成较高分子量的聚集体从而降低了花生蛋白的溶解度[14]。 2.1.2 超声波辅助提取对花生蛋白持水性的影响 超声波辅助提取对花生蛋白持水性的影响见图2。
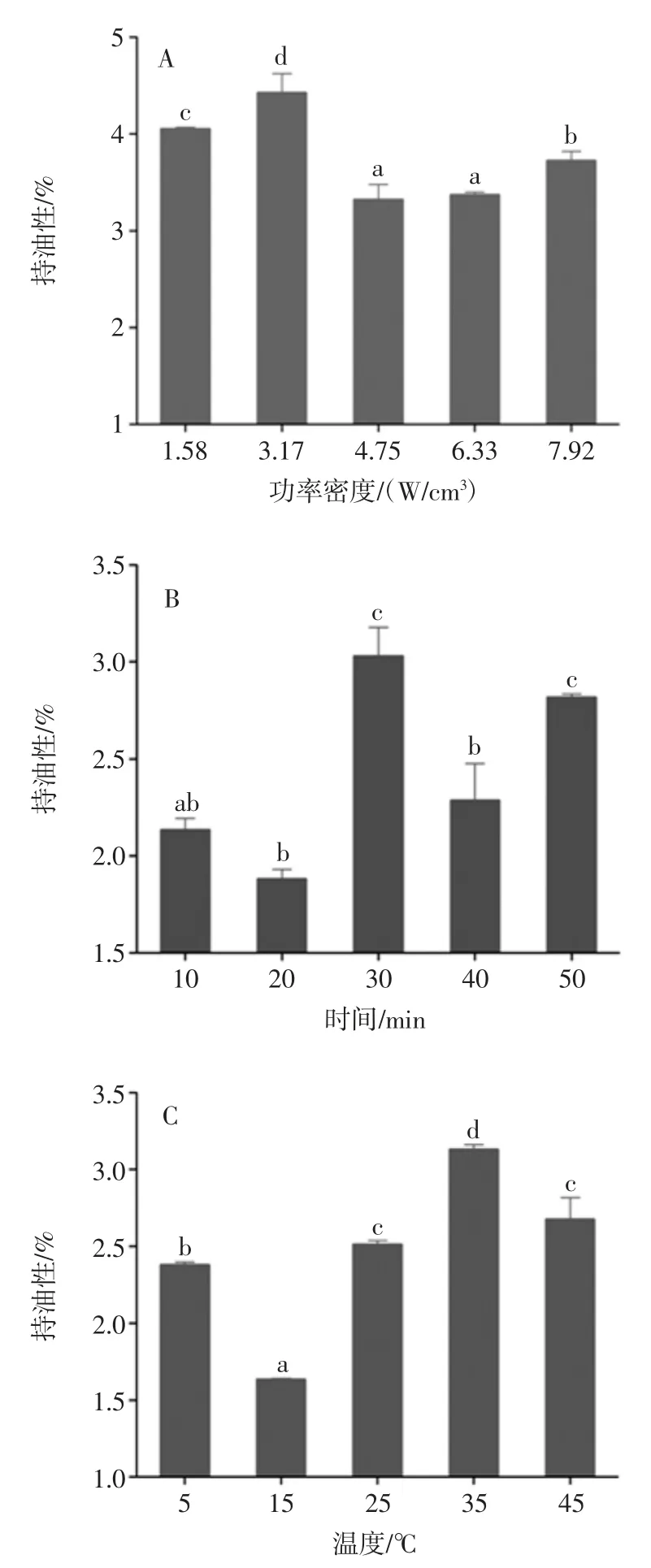
图2 超声波辅助提取条件对花生蛋白持水性的影响Fig.2 Effect of ultrasound-assisted conditions on water-holding of peanut protein 持水性是食品在加工过程中,对原料中的水分及参与产品加工的水分的保持能力。如图2 所示,随着超声功率密度的增加,花生蛋白的持水性呈现出先增加后减小的趋势,在超声功率密度为3.17 W/cm3时,花生蛋白的持水性达到最大值为3.01%,比碱溶酸沉(2.06%)增加了0.95%,这可能是因为超声作用破坏了蛋白质分子内部的非共价键使分子内部的疏水性基团暴露于分子表面,从而导致了蛋白质的持水性增大。而随着超声功率密度的继续增加,花生蛋白的持水性有所下降,持水性减小的原因可能是超声波处理使部分蛋白质变性,可能降低蛋白质与水的结合程度会增加蛋白质的结合程度并降低其表面疏水性[15]。 2.1.3 超声波辅助提取对花生蛋白持油性的影响 超声条件对花生蛋白持油性的影响见图3。 持油性是指蛋白产品吸附油脂的能力。如图3 所示,随着超声功率密度、时间、温度和占空比的增加,花生蛋白持油性总体上呈现出先上升后下降的趋势。其中超声功率密度对花生蛋白持油性的影响最为明显,在超声功率密度3.17 W/cm3时,持油性与对照组(碱溶酸沉)相比显著提高,可能是因于超声波与脂肪分子中的烃链相互作用后非极性残基侧链暴露于分子表面,从而导致油脂更易渗出[6]。随着超声功率密度的增加,花生蛋白持油性有所下降,与花生蛋白持水性一致,这可能是因为超声波处理使蛋白质部分变性,结构变得紧密,不溶性蛋白增多,导致其持油性下降,这与超声波对花生蛋白持水性的研究结果相一致。
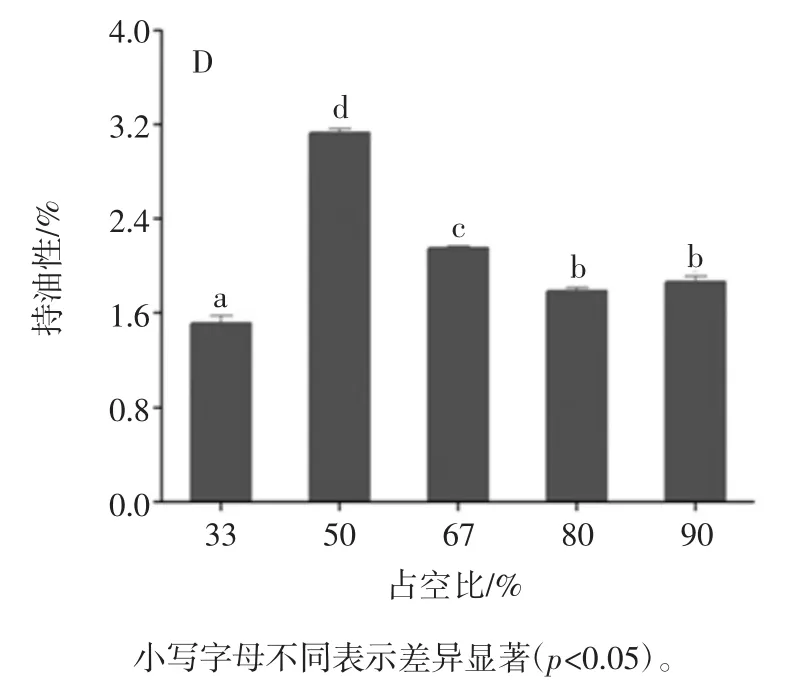
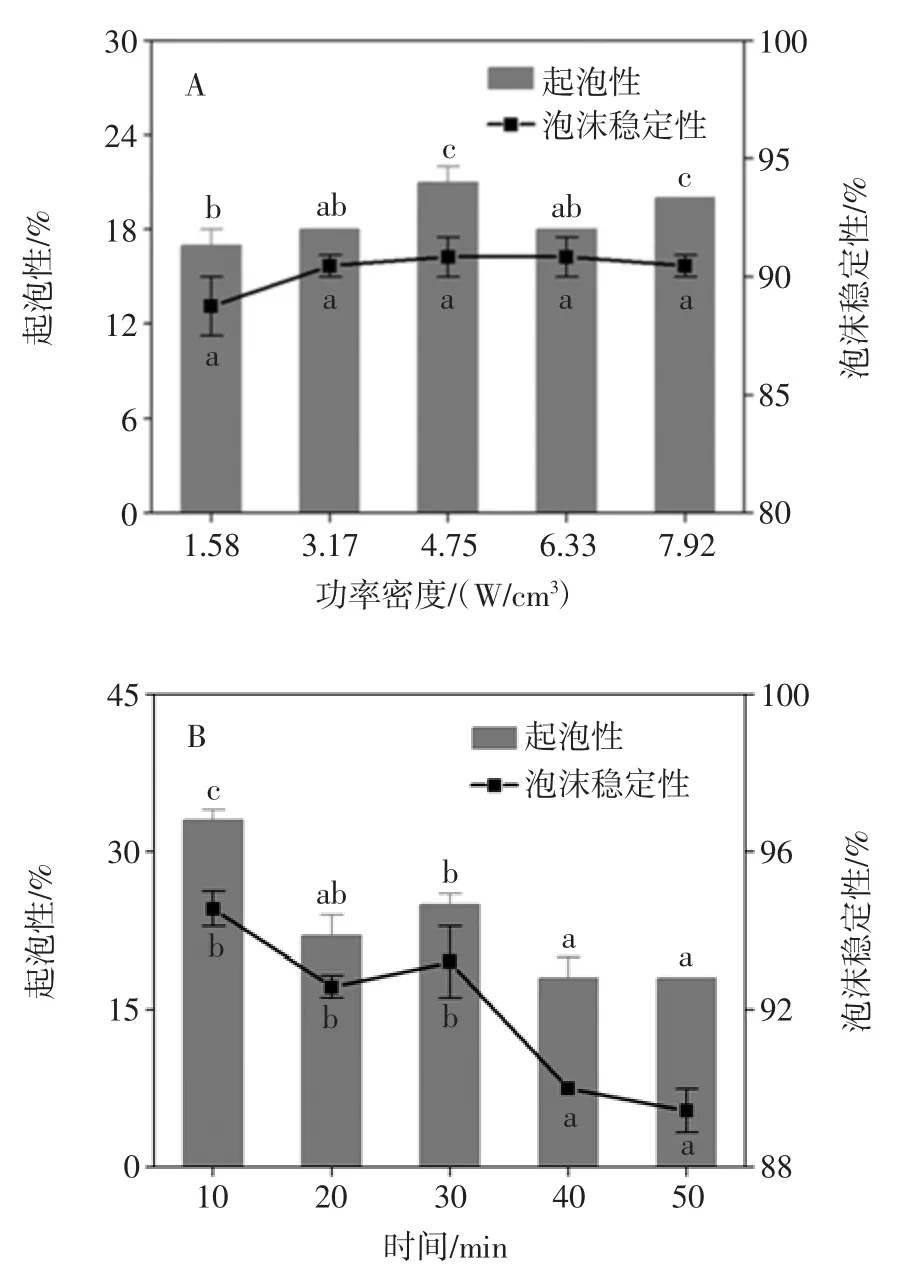
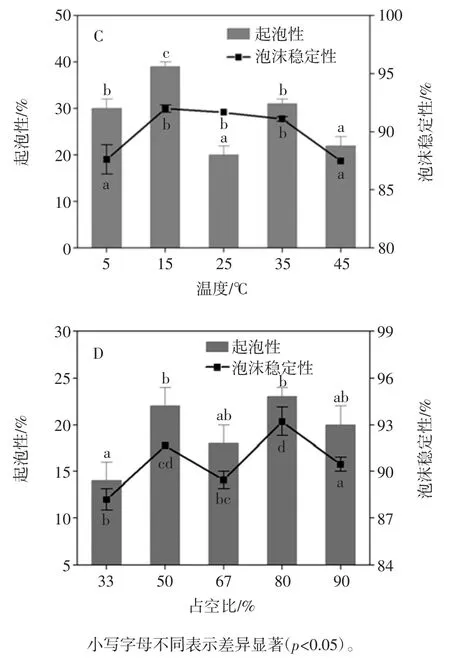
图3 超声波辅助提取条件对花生蛋白持油性的影响Fig.3 Effect of ultrasound-assisted conditions on oil-holding of peanut protein 2.1.4 超声波辅助提取对花生蛋白起泡性及泡沫稳定性的影响 超声波辅助提取对花生蛋白起泡性及泡沫稳定性的影响如图4 所示。
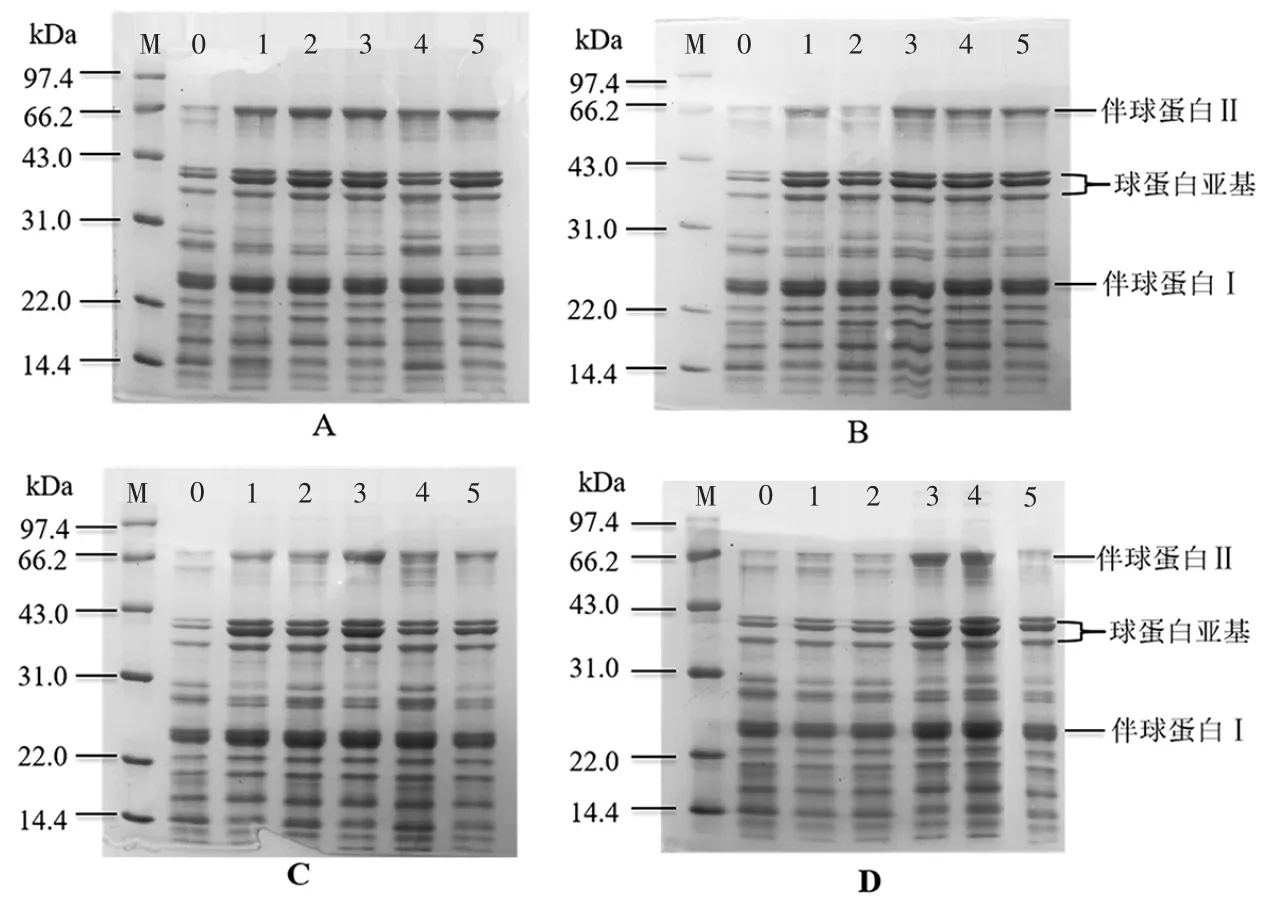
图4 超声波辅助提取条件对花生蛋白起泡性及泡沫稳定性的影响Fig.4 Effect of ultrasound-assisted conditions on foaming and foam stability of peanut protein 蛋白质的起泡性取决于蛋白质在气-液界面处的差异,而泡沫稳定性取决于在气泡周围形成厚粘性层[16]。由图4 所示,与对照组(碱溶酸沉)相比,经超声波处理后明显的改善了花生蛋白的起泡性及泡沫稳定性。其中超声时间和温度对花生蛋白起泡性和泡沫稳定性的影响较为显著,当超声时间10min 时,蛋白质起泡性和泡沫稳定性由21%和82.58%分别增加到33%和94.56%;与此同时,在超声温度15 ℃时,其起泡性和泡沫稳定性与对照组(碱溶酸沉)相比,分别提高了18%和9.41%;原因可能是超声波作用对花生蛋白的空间结构造成了破坏,暴露出更多的疏水性基团,同时降低了液体表面张力,使蛋白质能够充分展开于气-液界面处,从而提高蛋白质的发泡能力[17]。 2.2 超声波辅助提取对花生蛋白结构的影响2.2.1 超声波辅助提取对花生蛋白SDS-PAGE 电泳的影响 图5 表示为不同超声条件辅助提取的花生蛋白样品的SDS-PAGE 电泳图。
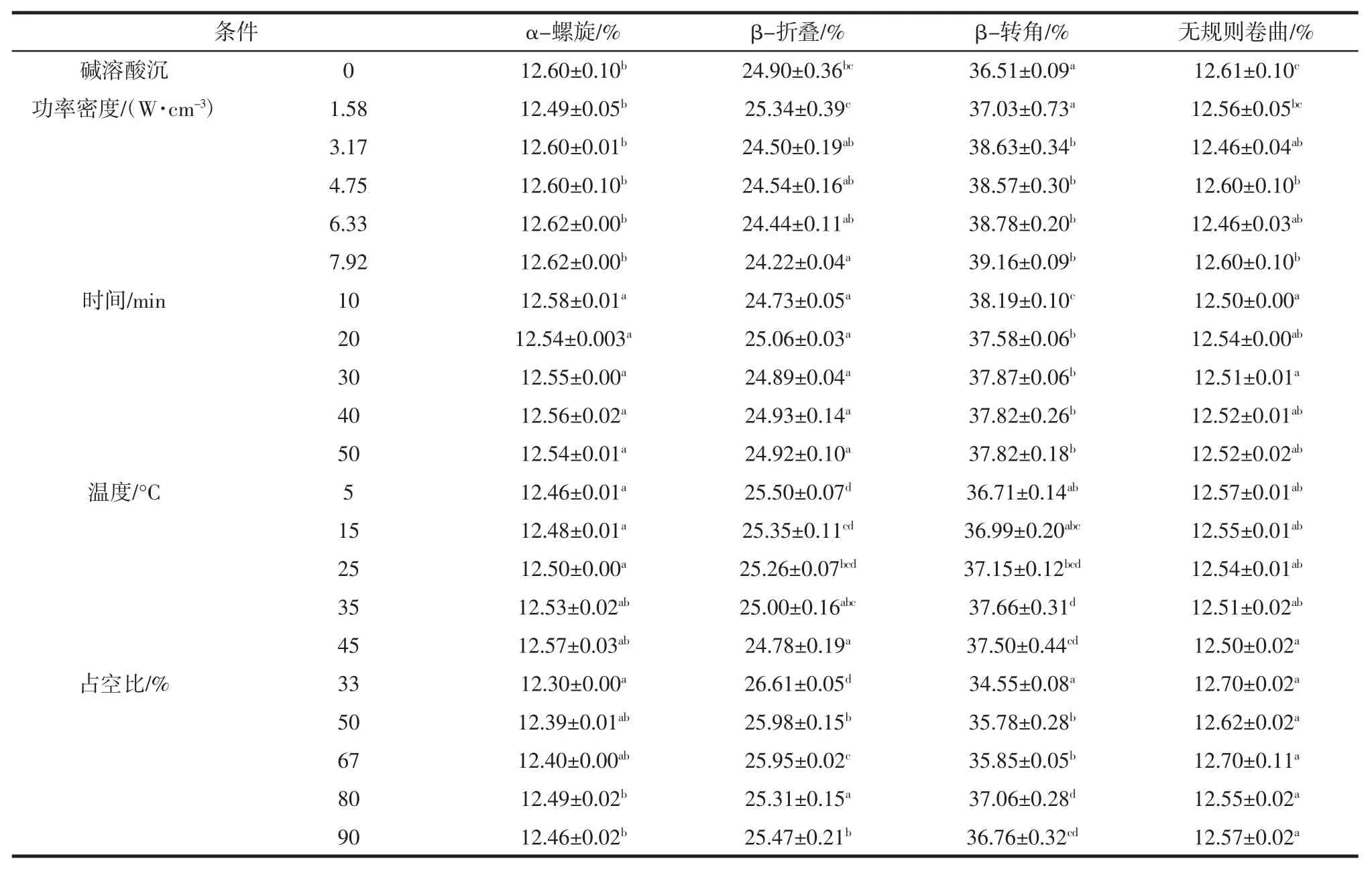
图5 超声波辅助提取条件对花生蛋白SDS-PAGE 的影响Fig.5 Effect of ultrasound-assisted conditions on SDS-PAGE of peanut protein 图5A 和5 图D 分别表示不同超声功率和超声占空比作用下花生蛋白的电泳图,从图中可以看出花生蛋白呈现出典型的花生球蛋白、伴花生球蛋白Ⅰ和伴花生球蛋白II 条带。与对照组(碱溶酸沉)相比,超声功率密度和占空比对花生蛋白的亚基并无显著影响。与对照组(碱溶酸沉)相比较,不同超声波时间(图5B)下提取的花生蛋白样品在分子量为66.2 kDa 附近条带增加,且分子量为14.4 kDa 处有新的条带形成。这可能是因为超声波作用产生的剪切应力和湍流效应,破坏蛋白质分子结构,导致部分蛋白亚基发生了降解[14],但随着超声波时间的延长造成了蛋白质因变性而发生聚基。此外,不同超声温度(图5 C)下提取的花生蛋白样品的条带在分子量66.2 kDa 处的条带略有增加,表明有大分子量的片段生成,这可能是由于超声作用时产生瞬时极端温度和压力使蛋白质发生变性,从而暴露出更多的疏水集团导致蛋白质之间发生聚集[18]。 2.2.2 超声波辅助提取对花生蛋白二级结构的影响 超声波对花生蛋白二级结构的影响见表1。
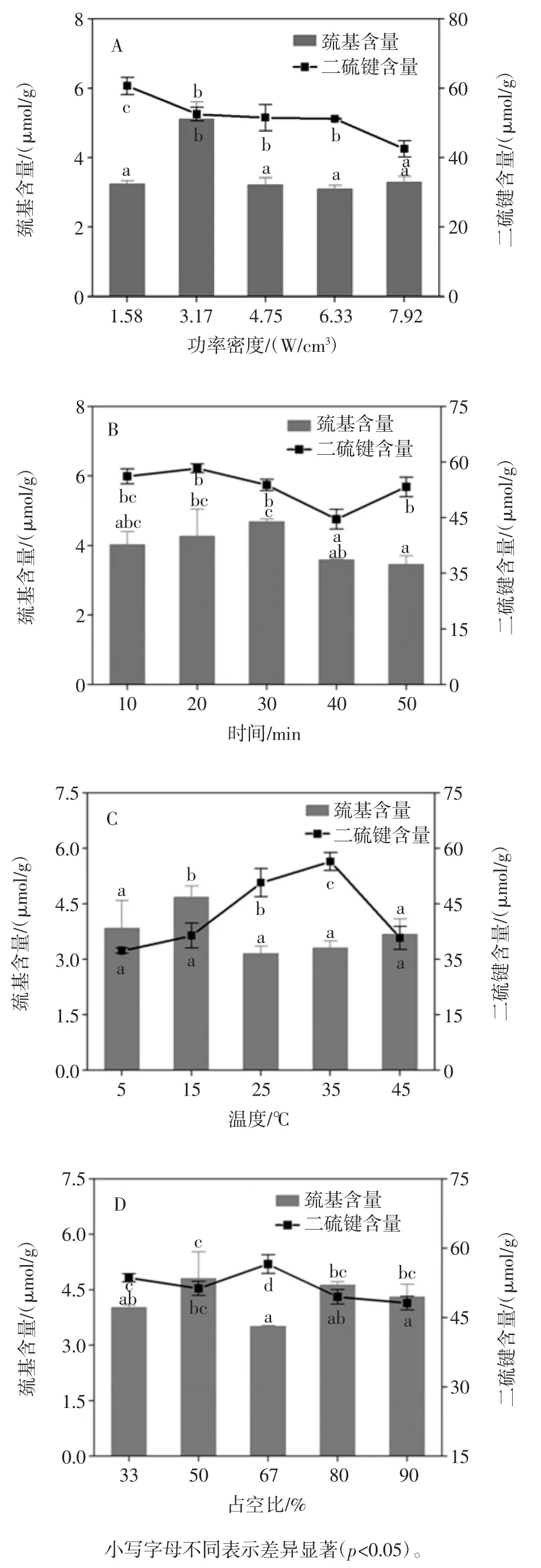
表1 超声波辅助提取对花生蛋白二级结构的影响Table 1 Effect of ultrasound-assisted on the secondary structure of peanut protein 表1 为不同超声条件辅助提取对花生蛋白二级结构的影响,在1 600 cm-1~1 700 cm-1范围内的吸收带是酰胺I 的特征吸收峰,各子峰与二级结构成分的对应关系为[19-20]:1 650 cm-1~1 658 cm-1,1 610 cm-1~1 640 cm-1,1 660 cm-1~1 700 cm-1,1 640 cm-1~1 650 cm-1处的波数分别对应α-螺旋、β-折叠、β-转角和无规卷曲结构。 由表1 可知,与对照组(碱溶酸沉)相比,超声辅助提取的花生蛋白的α-螺旋含量整体有下降的趋势,β-转角含量比例增加,β-折叠和无规卷曲结构比例无显著变化。从表中可以看出,超声功率密度对花生蛋白二级结构影响不大。随着超声时间的延长,花生蛋白的β-折叠和无规卷曲含量变化不显著,而α-螺旋含量略微减少,β-转角含量有降低的趋势,但与对照组(碱溶酸沉)相比仍有增加,在10 min 时花生蛋白β-转角含量达到最大值为38.19%,可能是超声作用破坏了蛋白质的空间结构,诱导蛋白质分子发生解折叠,其α-螺旋含量降低,蛋白质结构变得松散加[20],但随着超声时间的增加,蛋白质变性使疏水集团暴露,造成蛋白质聚集,进而使其比例下降。与碱溶酸沉提取的花生蛋白样品相比,超声温度下提取的花生蛋白的无规则卷曲含量无明显变化,而α-螺旋含量有所下降,β-折叠和β-转角含量增加,且β-转角含量在35 ℃达到最大值为37.66%,随着温度的升高,β-转角含量有下降的趋势,可能是加热过程中氢键断裂所致[21]。 2.2.3 超声波辅助提取对花生蛋白巯基(SH)和二硫键(-S-S)含量的影响 图6 表示为不同超声条件辅助提取的花生蛋白中巯基和二硫键含量。巯基和二硫键属于弱次级键并维持蛋白质三级结构的,其含量的变化反映了蛋白质的变性程度[11]。
图6 超声波辅助提取条件对花生蛋白巯基和二硫键含量的影响Fig.6 Effect of different ultrasound-asisted conditions on-SH and-S-S-contents of peanut protein 由图6 可知,对照组(碱溶酸沉)巯基和二硫键含量分别为 3.88 μmol/mL 和 57.23 μmol/mL,在超声功率密度3.17 W/cm3、时间30 min、温度15 ℃和占空比50%时,花生蛋白巯基含量分别达到最大值,与对照组相比均有不同程度的提高,在功率密度3.17 W/cm3时达到最大值为5.11 μmol/mL,这可能是因为超声波空化效应产生的高压和剪切力使蛋白质中埋藏的巯基暴露出来,因而造成了蛋白质巯基含量的增加[22]。然而随着超声功率密度不断增大时,花生蛋白巯基含量开始降低,可能是因为超声波使暴露出的巯基其他基团结合形成二硫键,导致蛋白质分子聚集,从而降低了巯基含量[23],其他超声条件与功率密度变化趋势相似。经过超声波辅助提取,花生蛋白中二硫键含量与对照组(碱溶酸沉)相比也有显著的提高,这表明超声处理后蛋白质分子内部的巯基暴露,增加了巯基与氧气结合形成二硫键的机会,因而造成了二硫键含量的增加。 3 结论研究结果表明,当超声功率密度为3.17 W/cm3、时间30 min、温度35 ℃和占空比50%时,花生蛋白的溶解度(43.85%)、持水性(1.65%)和持油性(3.13%)等功能特性较好。由SDS-PAGE 电泳结果显示,在超声10 min 时,花生蛋白样品在分子量为66.2 kDa 附近时条带开始增加,且在30 min 时条带最清晰,同时在分子量为14.4 kDa 处有新的条带形成。通过红外光谱对花生蛋白二级结构的表征发现,与碱溶酸沉法相比,超声波辅助提取的花生蛋白的α-螺旋含量减少、β-转角含量增加,而β-折叠和无规则卷曲含量没有显著变化。同时研究发现,超声波处理后花生蛋白巯基和二硫键含量增加,表明超声波处理后使花生蛋白发生不同程度的变性,进而影响其功能特性如溶解度的变化。本研究结果为超声波辅助提取蛋白质技术的开发和功能性蛋白产品上的应用提供了理论依据。 猜你喜欢 巯基功率密度溶解度 高功率密度电机在多电/全电飞机中的应用研究军民两用技术与产品(2021年5期)2021-07-28硫氨酯法合成巯基乙酸钠在铜钼分离中的运用中国金属通报(2021年20期)2021-03-11探究烫发剂中巯基乙酸的使用与危害中国化妆品(2020年6期)2020-07-22GC-MS法与HPLC法测定化妆品中巯基乙酸的方法比对商品与质量(2019年31期)2019-11-28例析溶解度试题的解法试题与研究·中考化学(2016年4期)2017-03-28溶解度曲线的理解与应用例析中学化学(2016年10期)2017-01-07高效液相色谱法测定香铃草子中还原型谷胱甘肽和总巯基含量分析科学学报(2016年2期)2016-10-15微波辐射参敛测试系统低功率密度测试为法研究火控雷达技术(2016年3期)2016-02-06溶解度曲线的涵义及应用中学生数理化·中考版(2015年11期)2015-09-10溶解度计算错误种种和对策中学化学(2015年5期)2015-07-13
|
【本文地址】
今日新闻 |
推荐新闻 |
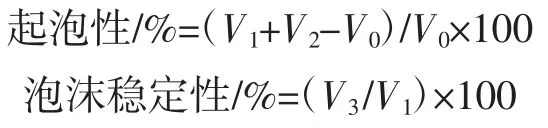
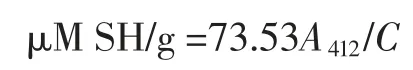
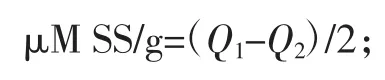
 食品研究与开发2020年9期
食品研究与开发2020年9期