DNA分子剪刀:各类基因编辑工具概述 |
您所在的位置:网站首页 › rna聚合酶能与基因的特定位点结合 › DNA分子剪刀:各类基因编辑工具概述 |
DNA分子剪刀:各类基因编辑工具概述
|
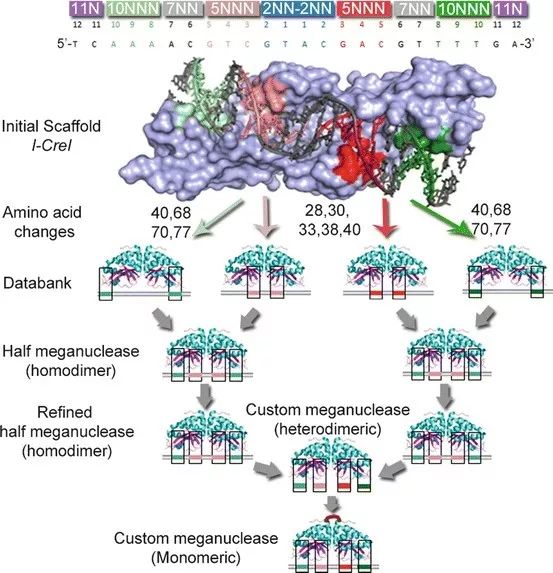
巨型核酸酶 在20世纪80年代后期发现的巨型核酸酶是限制性核酸内切酶家族中的酶,其特点在于能够识别和切割大DNA序列(14到40碱基对)的能力,由于识别长序列的特点,它们天然就具有高度的特异性。在巨型核酸酶中,LAGLIDADG核酸内切酶家族是过去十五年中研究基因组和基因组工程的有效工具。巨型核酸酶是“分子DNA剪刀”,可用于以高度特异性的方式替换、消除或修饰序列。研究人员通过蛋白质工程改变其识别序列,进而改变基因组上的目标序列。大范围核酸酶可用于修饰所有基因组类型,无论对象是细菌,植物还是动物。它们开辟了广泛的创新途径,特别是在人类健康领域,例如消除病毒遗传物质或使用基因疗法“修复”受损基因。 由于几乎没有可能找到作用于目标DNA序列所需的天然巨型核酸酶,它们几乎不可能用于科研工作。为了克服这样的困难,研究人员们使用诱变和高通量筛选的方法来产生识别特定序列的巨型核酸酶,同时也有研究人员采用融合不同大型核酸酶的方法来产生一些能够识别特定序列的杂交巨型核酸酶。巨型核酸酶具有高度特异性,使用其产生DSB的方法对细胞毒性造成的毒性很小,但要设计靶向特定序列的人工巨型核酸酶的过程却是昂贵且和耗时的,这也是巨型核酸酶基因编辑技术无法被广泛应用的原因。
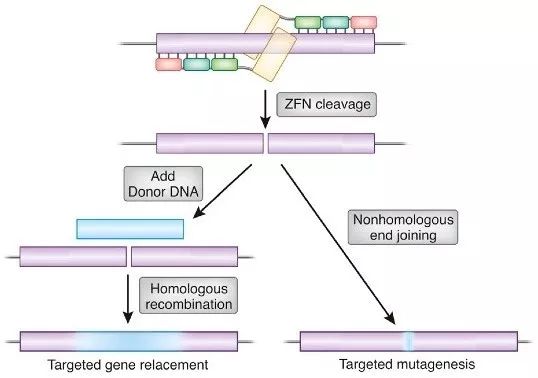
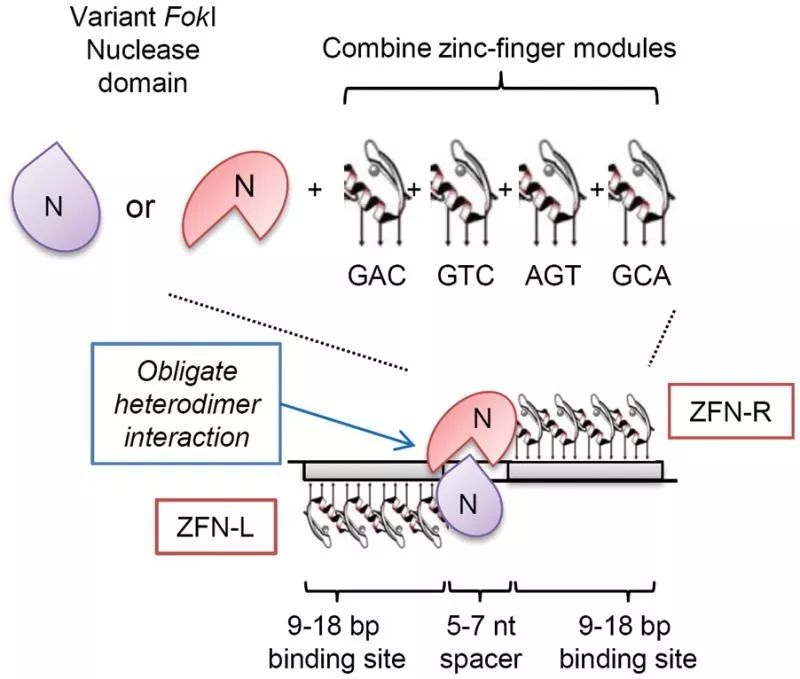
▲ 构建能够精确修饰的巨型核酸酶 锌指核酸酶 锌指核酸酶(Zinc finger nucleases, ZFN)是一种人工改造的核酸内切酶,由锌指蛋白(Zinc finger protein, ZFP)结构域和Fok Ⅰ核酸内切酶切割结构域人工融合而成。ZFP由多个锌指基序串联而成,识别并结合特定的DNA序列,因此我们可以通过设计锌指结构域以靶向复杂基因组内的特定DNA序列。由于Fok Ⅰ需要二聚化才能发挥功能,因此需要设计两个互补的ZFN分子,与靶位点特异结合后,两个ZFN分子间隔距离合适时,Fok Ⅰ二聚化发挥切割功能,造成靶位点断裂,启动体内的DNA损伤修复机制。Fok Ⅰ二聚化的过程是独立于DNA剪切的,因此两个不同ZFN分子形成的异二聚体和两个相同ZFN分子形成的同源二聚体均会导致DNA序列的剪切。可以想象,具有较低特异性的同源二聚体会切割基因组中的假回文序列。而且,在某些特定情况下,单一ZFN分子结合于DNA(识别序列只有9-12 bp)也会导致DNA序列的剪切。因此,两个不同ZFN分子总共可能产生七种不同识别序列的内切酶,这些非特异性的脱靶切割可导致较多的双链断裂并且超过DNA损伤修复的速度,产生染色体重排或细胞死亡。
▲ZFNs工作原理 Miller等和Szczeoek等(2007)分别改进了这一技术,他们构建了一系列偏爱异二聚体形式的Fok Ⅰ酶。研究人员构建了一对不对称的界面,他们通过审查Fok Ⅰ的晶体结构,均对介导两个ZFN分子结合的α螺旋上的氨基酸做了突变,以减少同源二聚体的形成。脱靶现象因此显著减少,但单个ZFN分子结合于DNA时发生的剪切仍然不可避免。
▲ 非同源二聚体ZFN作用机制 锌指核酸酶可用于操纵许多植物和动物的基因组,包括拟南芥,烟草,大豆,玉米,果蝇,秀丽隐杆线虫,海胆,家蚕,斑马鱼,青蛙和各种类型的哺乳动物细胞。研究人员发现CD4 +人T细胞中CCR5基因被ZFN破坏后,不能被HIV-1病毒识别,锌指核酸酶技术的出现可作为AIDS治疗的潜在手段。同样,锌指核酸酶技术在血友病等遗传病治疗方面也显现出巨大的应用前景。
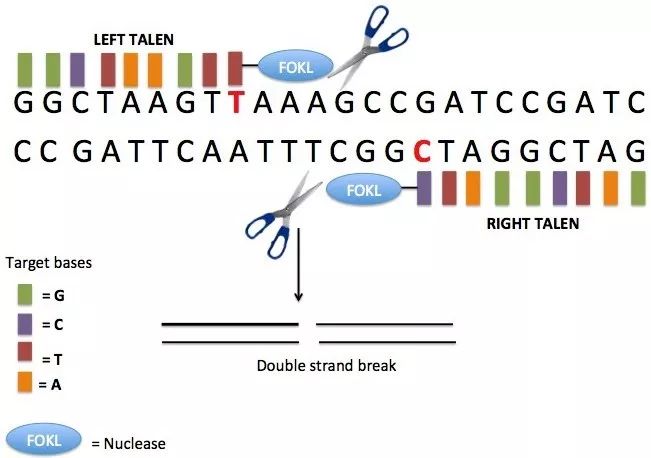
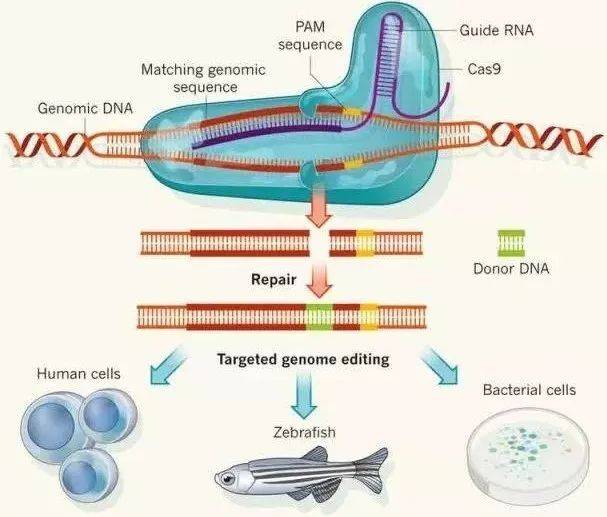
▲ TALEN工作原理 转录激活因子样效应核酸酶 转录激活因子样效应核酸酶(Tranion activator-like effector nucleases, TALEN)是特异性DNA结合蛋白,其特征在于33或34个氨基酸重复阵列。转录激活因子样效应物核酸酶 (TALENs) 由来自于植物病原菌黄单孢菌的类转录激活因子效应因子TALE和核酸内切酶Fok Ⅰ的催化区域融合而成。高度保守的33~35个氨基酸TALE重复组件决定了TALE结合DNA的识别特异性。转录激活因子样效应核酸酶性质与锌指核酸内切酶相似,识别特异的DNA序列,将其剪切形成双链缺口,通过同源修复或非同源末端连接修复,造成了基因插入或缺失。 TALEN相比于ZFNs来说,它的时间成本更低,操作简便,并且TALENs的识别位点更加广泛,几乎可以敲除所有基因,同时TALEN的剪切效率更高。TALEN技术已被广泛应用。TALEN被用于有效修饰植物基因组,创造具有良好营养品质的经济上重要的粮食作物;被用于产生敲除特定基因的秀丽隐杆线虫、大鼠、小鼠和斑马鱼;被用于产生敲入特定基因的生物,Wu等使用TALEN获得了Sp110基因敲入牛,以诱导结核病的抗性增加,研究人员也显微注射TALEN mRNA在单细胞胚胎中产生特定基因敲入大鼠。TALEN技术也用于纠正疾病遗传错误的实验研究中,它已被用于体外纠正导致紊乱的遗传缺陷(如镰状细胞病,大疱性表皮松解症)。 最近研究表明,TALEN可作为利用免疫系统对抗癌症的工具,TALEN介导的基因靶向改变可产生兼具抗肿瘤细胞活性和化疗药物抗性的T细胞。 CRISPR / Cas系统 CRISPR / Cas 系统作为细菌和古细菌的一种适应性免疫防御机制而被熟知,细菌和古细菌依靠此系统防御入侵的病毒和质粒,在消灭外来核酸同时,也将该外来核酸留在自身基因组中,当含有相同序列的外来核酸再次入侵时,机体能够识别,并对其进行切割,达到自我保护的目的,类似于免疫记忆。CRISPR是细菌用作一种获得性免疫以抵御病毒的遗传元件。它们由源自病毒基因组的短序列组成,并已整合到细菌基因组中。Cas(CRISPR相关蛋白)处理这些序列并切割匹配的病毒DNA序列。通过将含有Cas基因和特异性构建的CRISPR的质粒导入真核细胞,可在识别的位置处进行切割。
▲ CRISPR技术的基本原理,图片来自origene.com 随着对CRISPR / Cas系统研究的不断深入,这一系统的缺陷也被不断暴露出来,如严重的脱靶效应。对于CRISPR / Cas系统,其脱靶效应主要是由靶向DNA的前间区序列邻近基序(Protospacer adjacent motifs,PAM)造成。2015年9月,张锋研究组报道了一种不同于Cas9的新型II类CRISPR效应因子Cpf1。他们的研究表明,Cpf1是一种不依赖tracrRNA,由单个RNA介导的核酸内切酶。Cas9是在同一个位置同时剪切DNA分子的双链,形成的是平末端;而Cpf1剪切后形成的是两个不同长度的链,被称之为黏性末端。同时Cpf1能够识别富含胸腺嘧啶(T)的PAM序列,可扩展CRISPR的编辑范围,也相应地减弱了脱靶的效应。 许多已知的遗传疾病是由基因的点突变引起的,然而目前纠正点突变的方法效率较低且会引起随机缺失或者插入等缺陷,但随着人们对CRISPR系统的研究不断深入,一种新型的碱基编辑方法被发现。通过将胞嘧啶脱氨酶与CRISPR / Cas系统融合,就可以实现C→T(或者G→A)的转换,这样就大大提高了编辑效率,同时也减少了随机插入或缺失的风险。
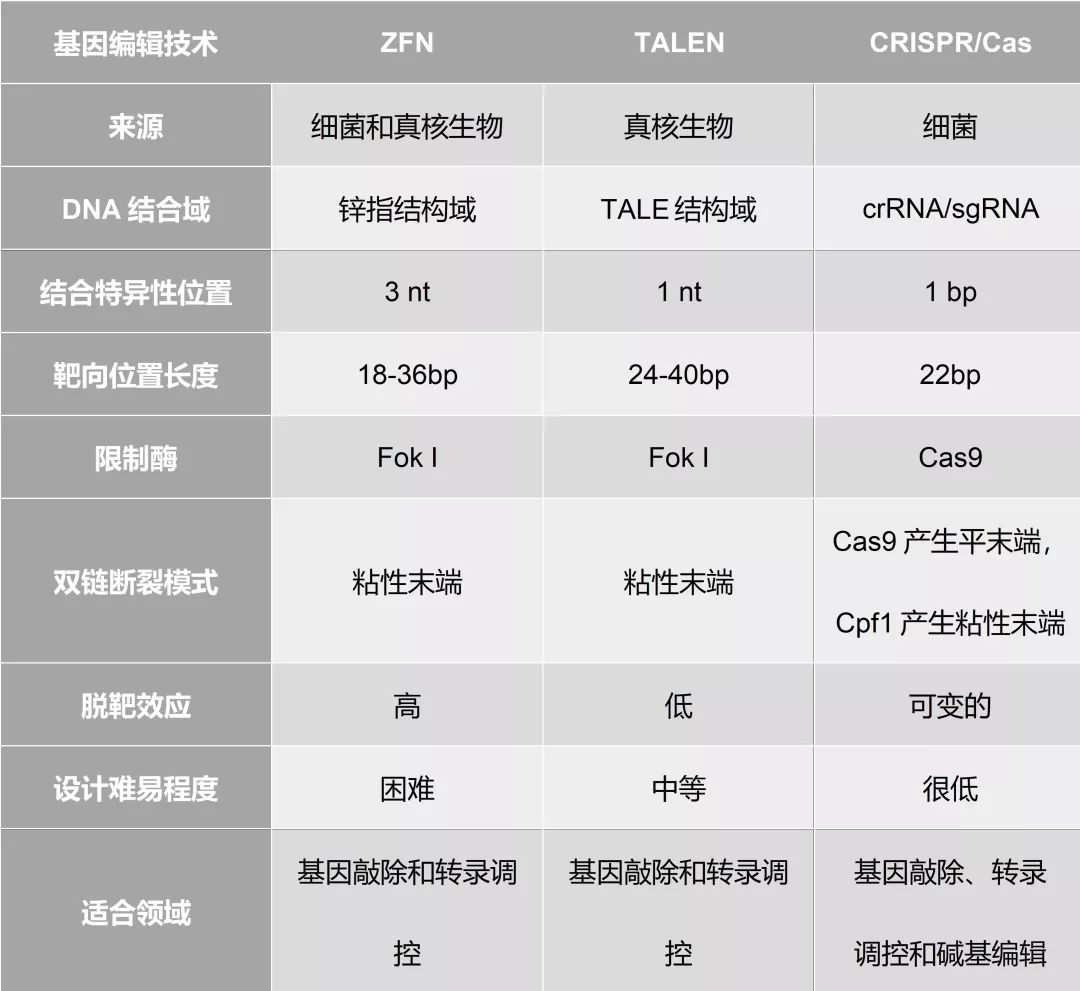
▲ ZFN,TALEN,CRISPR / Cas技术的比较 参考文献 [1] Hannes Lans et al: ATP-dependent chromatin remodeling in the DNA-damage response Epigenetics & Chromatinvolume 5, Article number: 4 (2012) [2] Fayza Daboussi et al: Engineering Meganuclease for Precise Plant Genome Modification Advances in New Technology for Targeted Modification of Plant Genomes pp 21-38 [3] Dana Carroll, D. Genome engineering with zinc-finger nucleases. Genetics Society of America, 2011, 188(4), pp 773-782. [4] Aron M. Geuts et al: Zinc-finger nucleases: new strategies to target the rat genome Clin Sci (Lond). 2010 Jul 6; 119(8): 303–311. [5] Thomas Gaj et al: ZFN, TALEN and CRISPR/Cas-based methods for genome engineering Trends Biotechnol. 2013 Jul; 31(7): 397–405.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |