RNA |
您所在的位置:网站首页 › rna与atp › RNA |
RNA
|
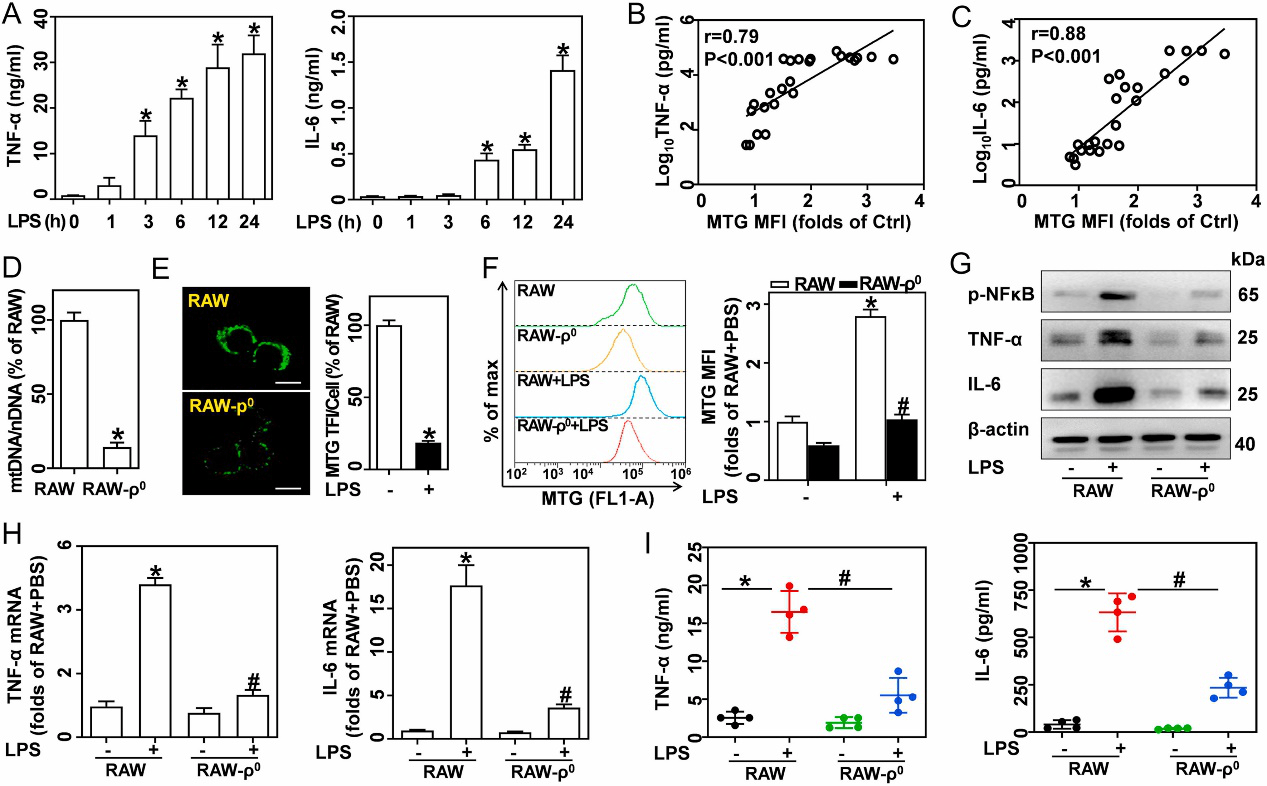
研 究 结 果 1、 LPS刺激的巨噬细胞中线粒体量增多,且有助于促炎因子释放 LPS处理的巨噬细胞培养上清液中TNF-α、IL-6和IL-1β积累,表明巨噬细胞促炎性分化。此状态下的巨噬细胞体积变大,荧光探针标记显示线粒体量较静息巨噬细胞中增加2-4倍,超微结构分析显示,这些线粒体发生形态改变:形态碎片化、长度更短、嵴更松(图1)。 接下来用0.5 μg/mL的LPS处理巨噬细胞 0、1、3、6、12和24小时,发现LPS有力地促进了包括TNF-α和IL-6的促炎细胞因子的表达。相关分析显示,上清中TNF-α(图2B)和IL-6(图2C)均与线粒体量呈正相关。反之,抑制线粒体DNA,则巨噬细胞线粒体的量不再响应LPS的刺激,且TNF-α和IL-6的表达量也降低(图2)。 以上结果说明,促炎症分化巨噬细胞拥有更多的线粒体,且其形态发生了深刻的重构,另外线粒体量的增加有助于促炎细胞因子的释放。
图1 促炎分化巨噬细胞比静息巨噬细胞显示更高的线粒体量和更低的膜电位
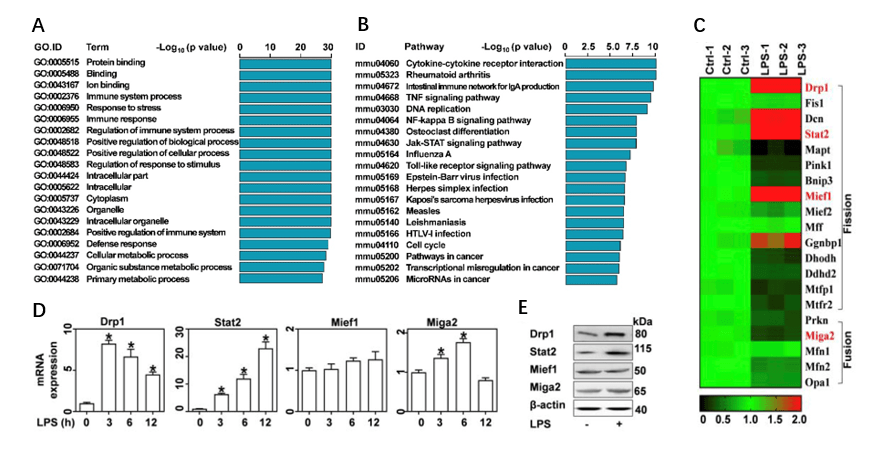
图2 线粒体量的增加有助于脂多糖激活的巨噬细胞中炎症细胞因子的释放 2、 转录组测序结果提示Stat2和Drp1在巨噬细胞促炎分化中起重要作用 为了阐明LPS导致的线粒体量增加分子机制,分别对PBS(对照组)和LPS处理的巨噬细胞进行转录组测序(图3)。数据显示,两组间共鉴定到3919个差异表达基因(1882个上调和2037个下调)。然后对其进行GO和KEGG富集分析,以明确差异基因的生物途径和功能。 KEGG富集分析显示有50条显著富集的通路,而排名前20的通路与肿瘤坏死因子、NF-κB、Toll样受体和JAK-STAT信号通路相关。值得注意的是,GO富集分析发现有28个显著富集的GO条目与调节线粒体的功能相关。一般来说,线粒体量是由裂变和融合的平衡决定的。这里,GO富集分析表明20个基因可能调节线粒体分裂和融合:LPS导致线粒体裂变的阳性调节因子增加了2倍以上,包括Drp1、Stat2、Mief1和Dcn。逆转录聚合酶链反应和蛋白质印迹证实LPS显著增强Drp1和Stat2的表达,但对Mief1无影响。因此进一步研究Stat2和Drp1在调节线粒体稳态中的作用。
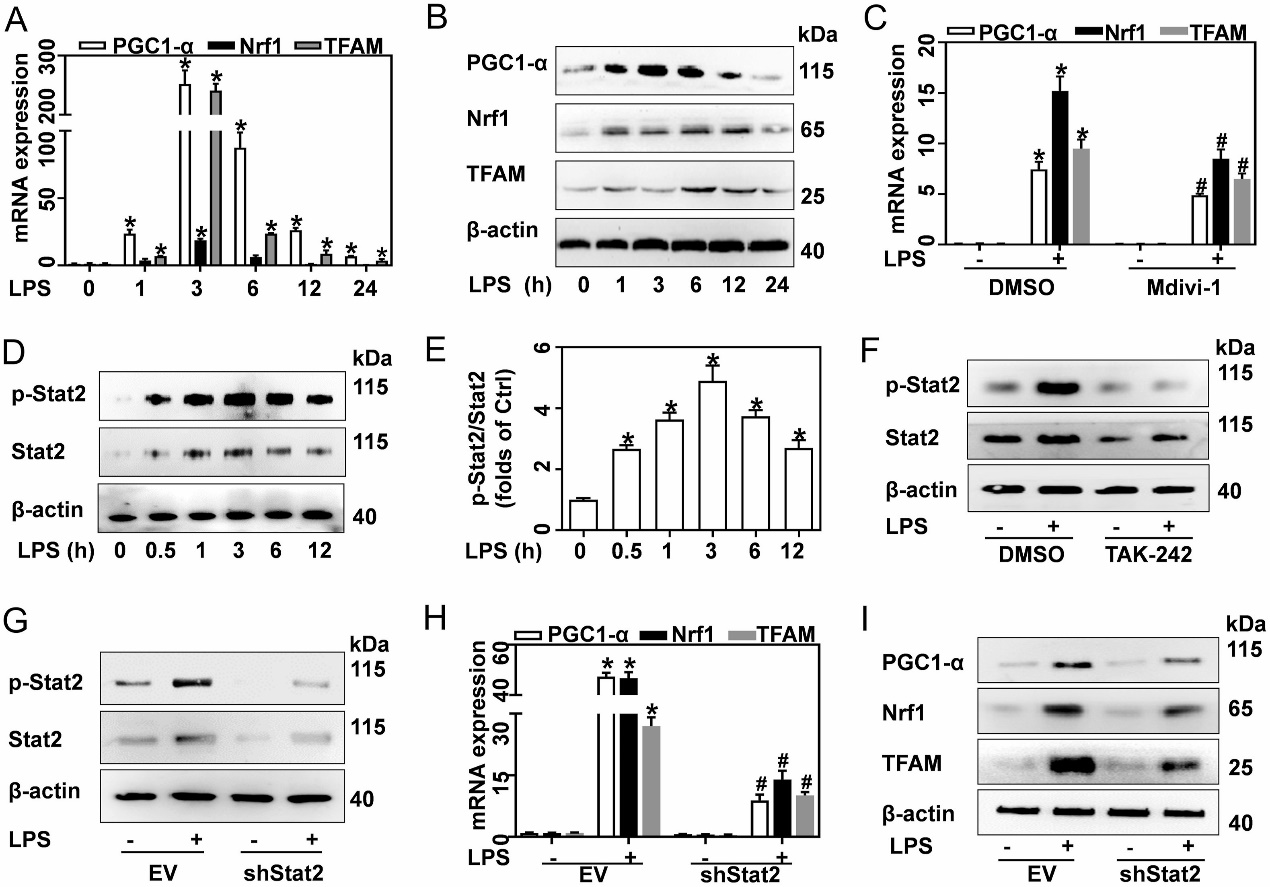
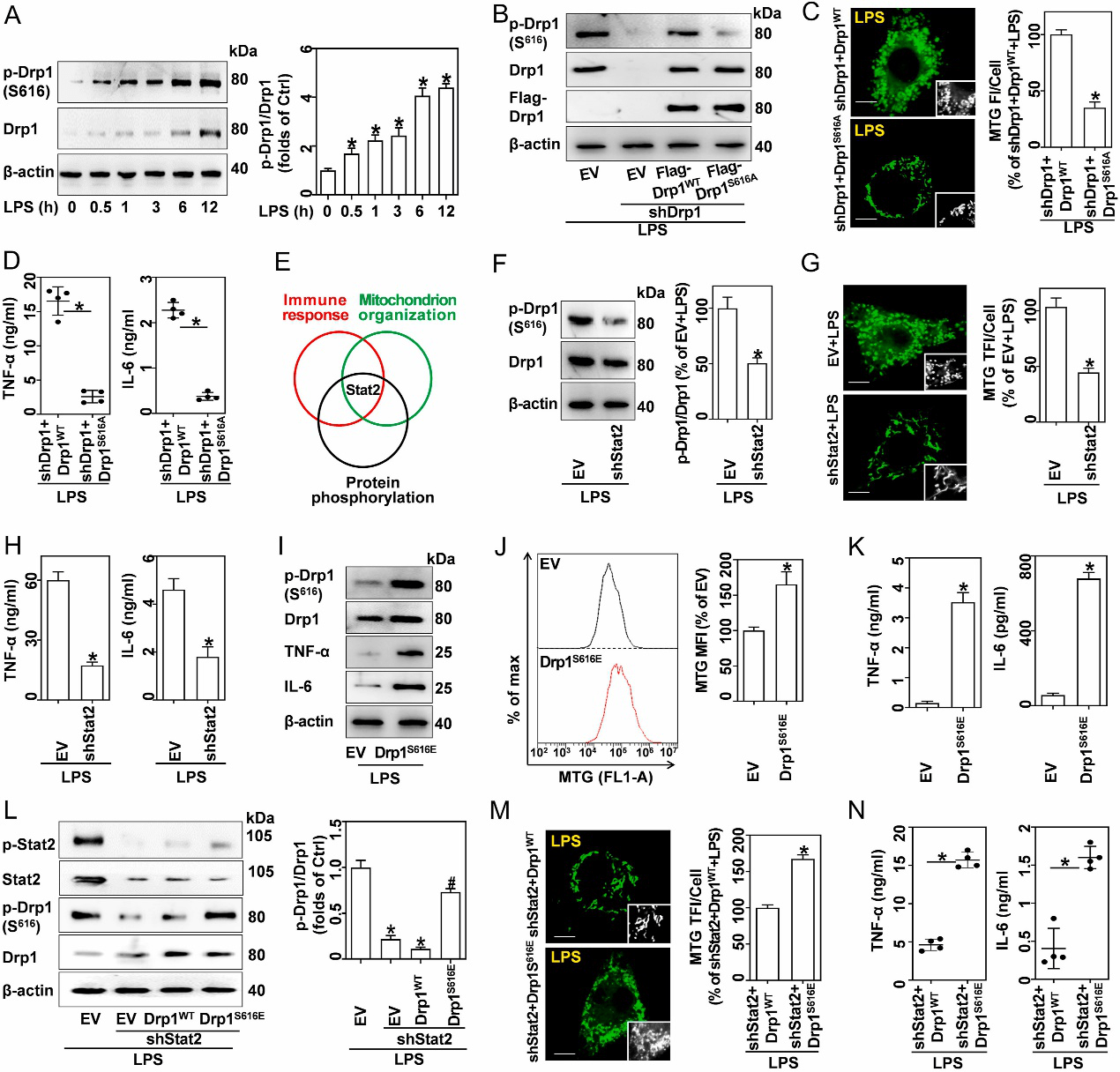
图3 转录组测序结果提示Stat2和Drp1在巨噬细胞促炎分化中起重要作用 3、 上调表达的Stat2和Drp1有助于产生更多的线粒体 线粒体量的增加需要由线粒体和核基因组编码的大量蛋白质。线粒体生物发生是负责这些蛋白质合成的关键机制,由几个转录因子控制,包括PGC-1α、Nrf1和TFAM。在LPS处理后,这3个转录因子的mRNA和蛋白表达量在6小时内迅速增加,而抑制Drp1或敲除Stat2均可解除PGC-1α、Nrf1和TFAM对LPS处理的响应(图4)。这说明LPS以Stat2和Drp1依赖的方式促进线粒体的生物发生,从而使线粒体量增多。 Drp1是一种GTP酶,它具有多个磷酸化位点,其中S616位点的磷酸化可促进其向线粒体募集,这是线粒体裂变所必需的。免疫荧光结果表明,LPS诱导Drp1向线粒体募集,而设计一种S616位点不可磷酸化的突变型Drp1则可减弱LSP诱导的线粒体量和促炎细胞因子的增加。另一方面,转录组分析表明Stat2同时富集于调节免疫反应、线粒体组织和蛋白质磷酸化相关的通路。同时,敲除Stat2显著逆转了LPS介导的Drp1 S616位点磷酸化和线粒体量的增加(图5)。这说明LPS诱导的线粒体量和促炎细胞因子的增加与Stat2对于Drp1 S616位点的磷酸化作用密切相关。
图4 LPS以Drp1和Stat2依赖的方式促进线粒体生物发生
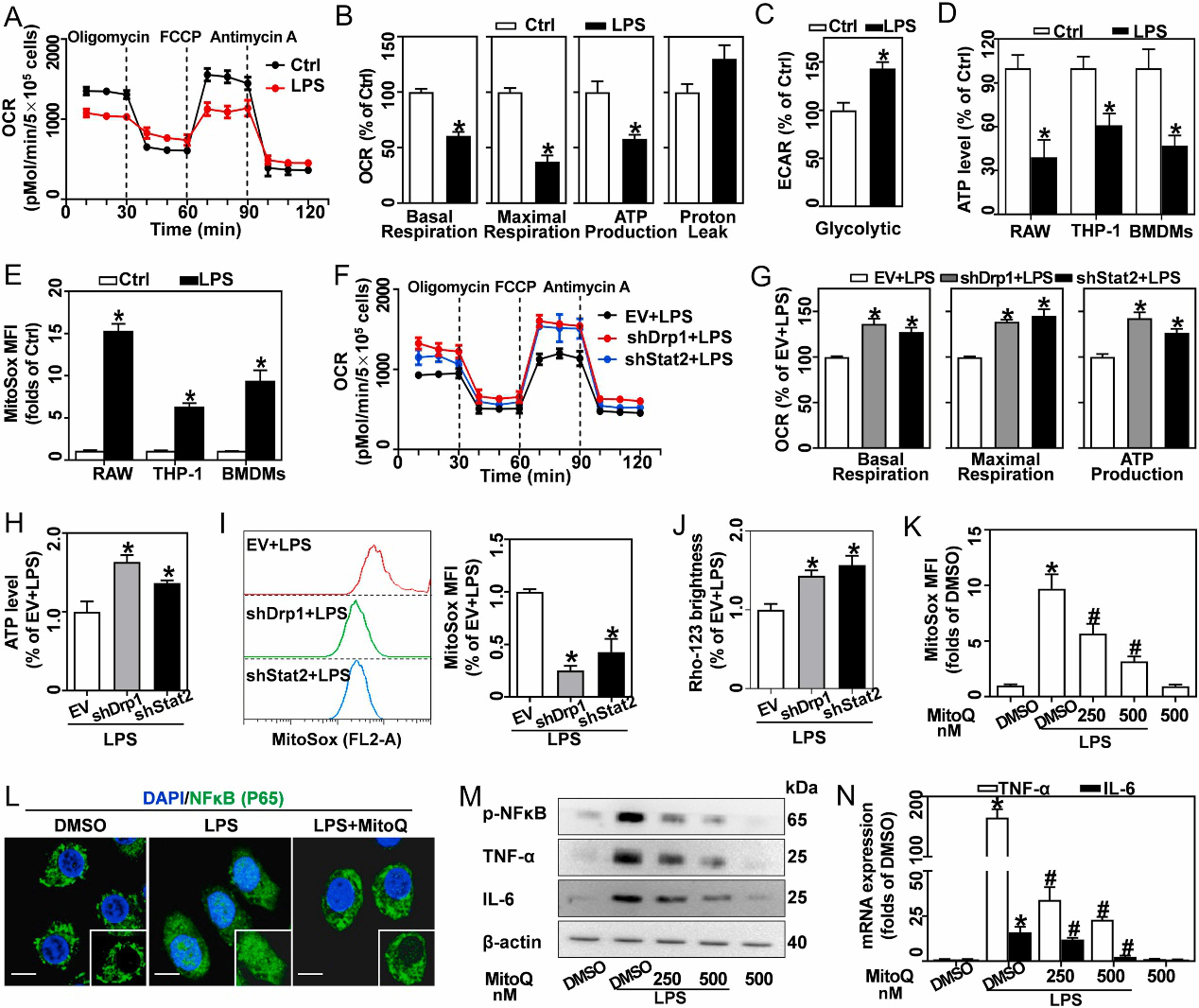
图5 Stat2对于Drp1 S616位点的磷酸化的是LPS诱导的线粒体量和炎性细胞因子积累所必需的 4、 Stat2-Drp1轴诱导LPS激活的巨噬细胞中的线粒体代谢重编程 促炎分化巨噬细胞经历从氧化磷酸化到有氧糖酵解的代谢程序。实验表明,ATP在LPS处理的巨噬细胞中含量减少,而ROS增加了7-15倍,且线粒体ROS与LPS激活的巨噬细胞中的线粒体量平行增加。然而,敲除Drp1和Stat2可逆转由LPS诱导的ATP减少和ROS增加,说明了Stat2-Drp1通路是与巨噬细胞的线粒体功能转换有关。 先前的研究表明,ROS可能作为线粒体氧化还原信号来驱动炎症,NF-κB磷酸化和核募集是其活化的必要条件。实验证明,LPS促进巨噬细胞的NF-κB磷酸化和核移位,清除ROS钝化了这些过程。此外,抑制线粒体ROS产生也抑制了LPS诱导的TNF-α和IL-6的表达。
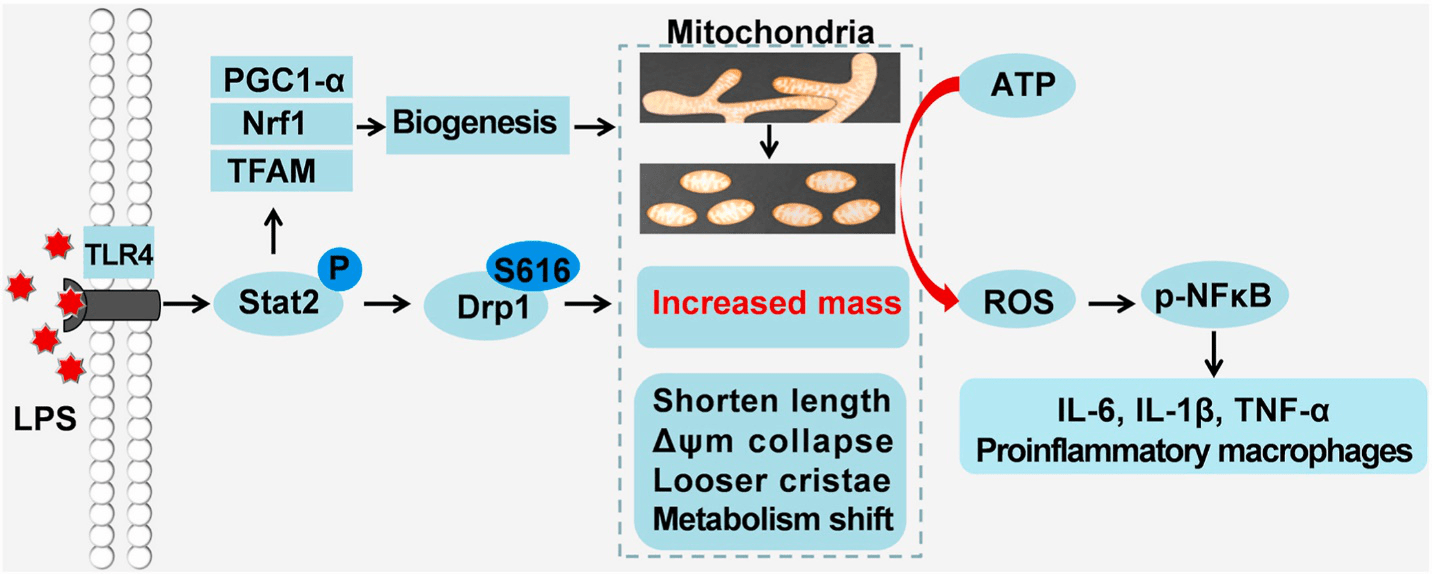
图6 Stat2-Drp1诱导LPS激活的巨噬细胞中的线粒体产生ROS而不是ATP,然后驱动炎症 总 结 Stat2-Drp1诱导线粒体量增加在促进巨噬细胞促炎症分化中的作用见下图。简单地说,LPS激活的巨噬细胞通过诱导Stat2-Drp1依赖的线粒体分裂和生物发生而拥有更多的线粒体。然而,这些线粒体发生了深刻的重构,包括碎片化的形态、松散的嵴、减少的膜电位以及发生代谢重编程,从而诱导ATP合成向ROS生成的功能转移,并进一步推动NF-κB依赖的炎症细胞因子的生成。
本研究的转录组测序和数据分析工作由上海派森诺生物科技股份有限公司完成。 原文链接:https://doi.org/10.1016/j.redox.2020.101761返回搜狐,查看更多 |
【本文地址】