替米沙坦对胰岛素抵抗大鼠冠状动脉Rho/ROCK信号通路的影响* |
您所在的位置:网站首页 › rhoa激动剂 › 替米沙坦对胰岛素抵抗大鼠冠状动脉Rho/ROCK信号通路的影响* |
替米沙坦对胰岛素抵抗大鼠冠状动脉Rho/ROCK信号通路的影响*
|
丁晓松 李卫萍 沈絮华 武 星 李虹伟 冠心病患者常合并糖代谢异常,糖尿病作为冠心病的等危症可通过胰岛素抵抗、氧化应激等机制引起内皮功能障碍及血管舒缩功能异常[1]。RhoA/ROCK信号通路是近年来研究较多的一个参与血管舒缩功能调节的信号通路。RhoA通过激活ROCK使肌球蛋白轻链活化并抑制其失活,导致平滑肌细胞(VSMC)收缩[2]。肾素-血管紧张素系统(RAAS)和Rho/ROCK通路均可通过影响NO合成酶(eNOS)和NO导致血管功能紊乱[3]。有研究显示具有部分过氧化物酶体增殖物激活受体(PPAR)-γ激动作用的血管紧张素Ⅱ(AngⅡ)1型受体(AT1)阻滞剂替米沙坦能改善糖尿病时血管内皮功能[4]。本文旨在通过观察替米沙坦对胰岛素抵抗大鼠冠状动脉RhoA及ROCK表达水平的影响,初步探讨Rho/ROCK通路是否参与替米沙坦对糖代谢异常时血管内皮功能调节的机制。 1 材料与方法1.1 材料 8周龄清洁级雄性Sprague-Dawley(SD)大鼠34只,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,于中国医学科学院药物研究所动物部进行喂养。尼康SMZ645体视解剖显微镜,Mastercycler普通 PCR仪,Gene Amp PCR DG-II暗箱式紫外透箱仪,Mini-PROTEAN 3 Elecreophoresis Cell电泳仪 ,山羊抗大鼠 ROCK1抗体(SANTA,sc-6055),山羊抗大鼠 ROCK2抗体(SANTA,sc-1851),家兔抗大鼠 RhoA 抗体 (Bioworld,BS1782),替米沙坦(Tel)片购于上海勃林格殷格翰药业有限公司。逆转录聚合酶链反应(RT-PCR)试剂盒购于Invitrogen生物技术有限责任公司。总蛋白提取试剂盒购于ProMab公司,天然膜蛋白抽提试剂盒和天然浆/核蛋白分离抽提试剂盒购于MERCK公司。 1.2 方法 1.2.1 胰岛素抵抗大鼠模型建立 34只大鼠,每笼3只分笼喂养,置于温度22℃~24℃,湿度60%,每日光照12 h,自由饮水的环境中适应性喂养1周后,随机抽取24只大鼠予高果糖饲料喂养,高果糖饲料购自中国医学科学院实验动物研究所。喂养4周后,腹腔注射链脲佐菌素(streptozotocin,STZ)25 mg/kg,2周后禁食12 h进行剪尾法采血,测定空腹血糖(FBG)浓度,放射免疫法测定空腹血清胰岛素(FSI)浓度,并计算胰岛素敏感指数(ISI),ISI=-ln(FBG×FSI),ISI≤ -4.88 说明造模成功。共20只大鼠造模成功,3只造模失败,1只死亡。将造模成功的20只大鼠随机分为2组,每组10只,胰岛素抵抗(IR)组给予生理盐水灌胃,替米沙坦干预(Tel)组给予替米沙坦5 mg/(kg·d)灌胃,干预4周,干预结束后分离冠脉进行后续实验。未造模的10只大鼠为对照组。 1.2.2 测定冠状动脉组织中RhoA、ROCK1及ROCK2 mRNA表达的水平 干预结束后,无菌条件下取出3组大鼠心脏,在尼康SMZ645体视解剖显微镜下迅速分离冠状动脉放入冻存管中,置于液氮中保存。组织匀浆后按照Trizol试剂说明书提取冠脉组织总RNA,用RT-PCR法分别测定冠状动脉组织中 RhoA、ROCK1和 ROCK2的 mRNA表达水平。根据GenBank搜索结果以Primer 5.0程序设计引物。RhoA引物序列: 上游 5′-CATCCCAGAAAAGTGGACTCCA-3′, 下游 5′-CCTTGTGTGCTCATCATTCCG-3′, 扩增片段长度 103 bp。ROCK1引物序列:上游5′-GAATGACATGCAAGCGCAAT-3′,下游 5′-GTCCAAAAGTTTTGCACGCA-3′,扩增片段长度 113 bp。ROCK2引物序列: 上游 5′-GAAACAACTGG ATGAAGCTAATGC-3′, 下游 5′-GTTTCAAGCAGGCAGTTTT TATCTT-3′,扩增片段长度150 bp。PCR反应条件95℃50 s,60℃ 60 s,72℃60s,循环45次。 1.2.3 Western blotting测定RhoA、ROCK1和ROCK2蛋白表达水平 采用Total protein Extraction Kit组织裂解提取总蛋白,采用天然膜蛋白抽提试剂盒ProteoExtractTM(M-PEK)提取膜蛋白,采用天然浆/核蛋白分离抽提试剂盒NucBusterTMProtein Exaction Kit提取浆/核蛋白,采用 10%进行 SDSPAGE,山羊抗大鼠 ROCK1 抗体(1∶500),山羊抗大鼠 ROCK2抗体(1∶500)4℃封闭过夜后再与二抗兔抗山羊 IgG/HRP(1∶40 000)孵育 2 h。兔抗大鼠 RhoA 抗体(1∶500)4℃封闭过夜后再与二抗山羊抗小鼠IgG/HRP1∶50 000孵育2 h。免疫印迹用化学发光法显示,经Gel pro4.0版凝胶光密度分析软件分别计算RhoA/GAPDH、ROCK1/GAPDH、ROCK2/GAPDH的比值。1.3 统计学方法 应用SPSS 13.0进行统计分析,计量资料采用均数±标准差(±s)表示,多组资料间比较采用单因素方差分析,组间多重比较采用LSD-t检验,方差不齐时采用Kruskal-Wallis秩和检验,P 2 结果2.1 3组间糖代谢指标比较 与对照组比较,IR组大鼠FBG、FSI均升高,而ISI明显降低,达到胰岛素抵抗水平。Tel组较IR组FBG降低,ISI升高,差异有统计学意义,而FSI无明显变化,见表1。 Table 1 Comparison of glucose metabolism index between three groups表1 3组间糖代谢指标比较 (n=10,±s)
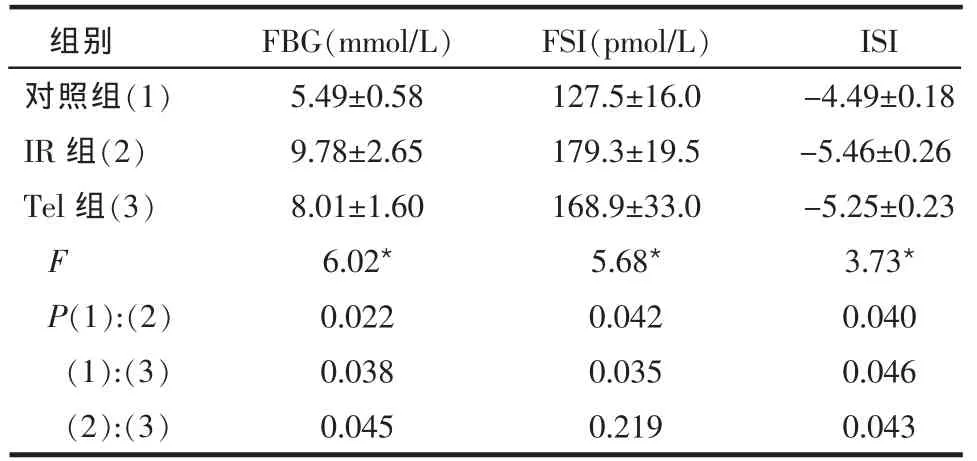
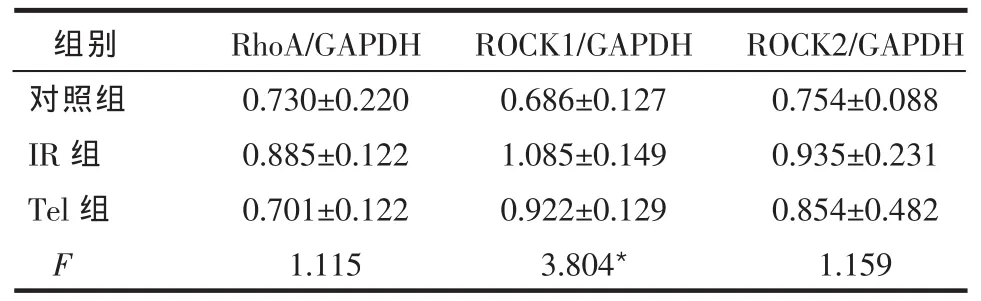
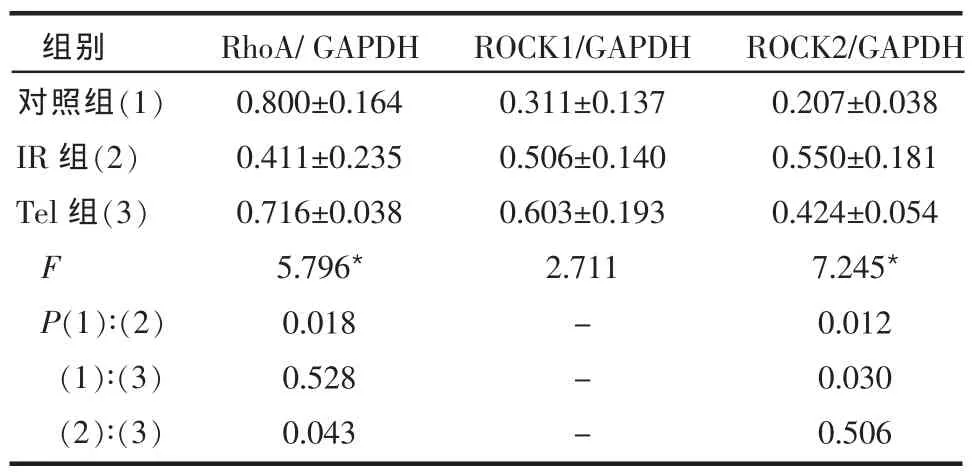
Table 1 Comparison of glucose metabolism index between three groups表1 3组间糖代谢指标比较 (n=10,±s) *P ? 2.2 3 组间 RhoA、ROCK1、ROCK2 mRNA 水平的比较 3组大鼠冠状动脉RhoA和ROCK2 mRNA表达水平接近,差异无统计学意义。IR组大鼠ROCK1 mRNA表达水平较对照组升高,差异有统计学意义(P=0.042)。而其他各组之间ROCK1 mRNA表达水平差异无统计学意义,见表2、图1。 2.3 3组间RhoA、ROCK1、ROCK2蛋白表达水平比较 IR组大鼠RhoA蛋白表达水平较对照组和Tel组明显降低,差异有统计学意义(P0.05),见表3、图2。ROCK1 蛋白表达水平在3组间差异均无统计学意义(P>0.05)。IR组和Tel组ROCK2蛋白表达水平较对照组升高,差异有统计学意义,而IR组和Tel组间ROCK2蛋白表达水平差异无统计学意义,见表3、图3。 Table 2 Comparison of RhoA,ROCK1 and ROCK 2 mRNA expressions between three groups表2 3组间RhoA、ROCK1、ROCK2 mRNA水平比较(n=10,±s)
Table 2 Comparison of RhoA,ROCK1 and ROCK 2 mRNA expressions between three groups表2 3组间RhoA、ROCK1、ROCK2 mRNA水平比较(n=10,±s) ?
Figure 1 RT-PCR detection of ROCK1图1 ROCK1 RT-PCR结果 Table 3 Comparison of RhoA,ROCK1 and ROCK 2 protein expressions between three groups表3 3组间RhoA、ROCK1、ROCK2蛋白表达水平比较(n=10,±s)
Table 3 Comparison of RhoA,ROCK1 and ROCK 2 protein expressions between three groups表3 3组间RhoA、ROCK1、ROCK2蛋白表达水平比较(n=10,±s) ?
Figure 2 Westen blotting detection of RhoA protein expression图2 RhoA蛋白表达Westen blotting结果
Figure 3 Westen blotting detection of ROCK2 protein expression图3 ROCK2蛋白表达Westen blotting结果 3 讨论Rho/ROCK信号通路是近些年心血管系统研究的热点,在冠心病、高血压、动脉粥样硬化等疾病发病机制中起到一定作用[2,5]。有研究显示血管紧张素Ⅱ受体可能参与内皮及血管平滑肌细胞Rho/ROCK信号通路的激活并有可能通过该途径影响血管舒缩功能[6]。Rho是一种小分子G蛋白,在细胞的信号转导通路中作为信号转换器或分子开关,Rho激酶是小G蛋白下游的效应器之一,通过使肌球蛋白轻链磷酸化和肌球蛋白轻链磷酸酶(myosin light chain phosphatase,MLCP)的肌球蛋白结合亚基(myosin binding subunit,MBS)磷酸化,导致平滑肌细胞收缩[5]。Rho/ROCK激酶信号通路可以通过对VSMC的作用介导血管紧张度的改变,调节血管阻力,参与高血压的发生和发展[7]。自发性高血压大鼠(SHRs)在高血压发生之前 Rho激酶的表达和活性都有所提高[8]。ROCK抑制剂Y-27632可降低多种系统性高血压大鼠模型的全身血压,但对正常动物的血压并没有显著影响,提示Rho/ROCK通路很大程度上参与了高血压的发病机制[7]。Y-27632类似物Fasudil的治疗效果在给予长期输入血管紧张素Ⅱ造成的高血压和冠状血管病变特征的大鼠模型中也得到证实[2,5],提示Rho/ROCK信号途径可能与RASS系统存在相互作用,而血管紧张素受体阻断剂(ARB)类药物可能对Rho/ROCK信号途径具有调节作用。 在VSMC中AngⅡ是通过何种机制导致RhoA活化尚不清楚。Sayk等[9]研究发现在糖尿病发病初期AT1蛋白表达水平即明显上调。Rho GDI是调节RhoA活性的小分子蛋白,起抑制RhoA活化作用[10]。Bian等[11]分别给予AngⅡ和AT1阻滞剂L158809处理培养的SHR和WKY大鼠主动脉平滑肌细胞后,AngⅡ使SHR大鼠主动脉平滑肌细胞RhoGDIα表达上调,而L158809使其表达下调。据此推测,抑制AT1受体激活可降低RhoGDIα表达,而RhoA表达应上调。本研究发现胰岛素抵抗大鼠的冠状动脉RhoA蛋白表达水平下调与此研究结果一致。给予替米沙坦干预后,胰岛素抵抗大鼠冠状动脉RhoA蛋白表达水平降低被逆转。 近期的研究显示ROCK上调在人和动物血管痉挛中发挥重要作用[8]。对心绞痛患者冠脉内使用法舒地尔可以显著抑制乙酰胆碱诱导的冠脉痉挛及其相关的心肌缺血,提示了Rho激酶很大程度上参与了冠脉痉挛的发病[12]。另外,法舒地尔在微血管心绞痛患者也有一定的治疗效果,说明Rho激酶参与介导了冠脉微血管的高反应性[13]。AngⅡ刺激可使人冠状动脉平滑肌细胞ROCK的功能和表达水平上调[14]。本研究中胰岛素抵抗大鼠ROCK1 mRNA表达水平上调,但给予替米沙坦干预后RhoA、ROCK1、ROCK2 mRNA表达水平和ROCK1、ROCK2蛋白表达水平与对照组比较差异无统计学意义,与以上研究结果相类似。由于本研究未检测RhoA和ROCK活性,对其功能变化尚需进一步研究证实。 [1]Kampoli AM,Tousoulis D,Briasoulis A,etal.Potential pathogenic inflammatory mechanisms of endothelial dysfunction induced by type 2 diabetes mellitus[J].Curr Pharm Des,2011,17(37):4147-4158. [2]Surma M,Wei L,Shi J.Rho kinase as a therapeutic target in cardiovascular disease[J].Future Cardiol,2011,7(5):657-671. [3]Javier C,Susanne L,Yuxi F,etal.AngiotensinⅡmodulates VEGF-driven angiogenesis by opposing effects of type 1 and type 2 receptor stimulation in the microvascular endothelium [J].Cellular Signalling,2012,24(6):1261-1269. [4]Kobayashi N,Ohno T,Yoshida K,etal.Cardioprotective mechanism of telmisartan via PPAR-gamma-eNOS pathway in dahl saltsensitive hypertensive rats[J].Am JHypertens,2008,21(5):576-581. [5]Zhou Q,Gensch C,Liao JK.Rho-associated coiled-coil-forming kinases (ROCKs): potential targets for the treatment of atherosclerosis and vascular disease[J].Trends Pharmacol Sci,2011,32(3):167-173. [6]Wynne BM,Chiao CW,Webb RC.Vascular smooth muscle cell signaling mechanisms for contraction to angiotensin II and endothelin-1[J].JAm Soc Hypertens,2009,3(2):84-95. [7]Loirand G,Pacaud P.The role of Rho protein signaling in hypertension[J].Nat Rev Cardiol,2010,7(11):637-647. [8]Dong M,Yan BP,Liao JK,etal.Rho-kinase inhibition:a novel therapeutic target for the treatment of cardiovascular diseases[J].Drug Discovery Today,2010,15(16):622-629. [9]Sayk F,Iwen KA,Lehnert H.Diabetes and hypertension[J].Dtsch Med Wochenschr,2009,134(45):2296-2301. [10]Cole WC,Welsh DG.Role of myosin light chain kinase and myosin light chain phosphatase in the resistance arterial myogenic response to intravascular pressure [J].Arch Biochem Biophys,2011,15(2):160-173. [11]Bian YL,Qi YX,Yan ZQ,etal.A proteomic analysis of aorta from spontaneously hypertensive rat:RhoGDI alpha upregulation by angiotensin II via AT(1)receptor[J].Eur JCell Biol,2008,87(2):101-110. [12]Hung MJ,Cherng WJ,Hung MY,etal.Increased leukocyte Rhoassociated coiled-coil containing protein kinase activity predicts the presence and severity of coronary vasospastic angina[J].Atherosclerosis,2012,221(2):521-526. [13]Yoku K,Satoshi Y,Kentaro A,etal.Enhanced Rho-kinase activity in circulating neutrophils of patients with vasospastic angina[J].JACC,2011,58(12):1231-1237. [14]Hiroki J,Shimokawa H,Higashi M.Inflammatory stimuli upregulate Rho-kinase in human coronary vascular smooth muscle cells[J].J Mol Cell Cardiol,2004,37(2):537-446. 猜你喜欢 米沙坦组间通路 达格列净对预混胰岛素治疗血糖控制不达标的2型糖尿病患者的疗效和安全性研究健康之友(2022年23期)2022-12-29氢氯噻嗪联合替米沙坦用于高血压治疗的有效性分析世界最新医学信息文摘(2021年12期)2021-06-09数据组间平均数、方差关系的探究中学生数理化·七年级数学人教版(2019年6期)2019-06-25要背沟,不要“虎背熊腰”家庭百事通·健康一点通(2018年4期)2018-05-16更 正中华皮肤科杂志(2018年4期)2018-01-22胰岛素抵抗OLETF大鼠血清IL-18水平变化及替米沙坦的干预研究天津医科大学学报(2015年2期)2015-12-22Kisspeptin/GPR54信号通路促使性早熟形成的作用观察中国病理生理杂志(2015年8期)2015-12-21proBDNF-p75NTR通路抑制C6细胞增殖医学研究杂志(2015年3期)2015-06-10替米沙坦对慢性肾脏病患者血清BMP-7的影响中国当代医药(2015年16期)2015-03-01替米沙坦和缬沙坦治疗原发性高血压的临床效果及最小成本分析中国当代医药(2015年7期)2015-03-01
|
【本文地址】



 天津医药2012年12期
天津医药2012年12期