【“石”力精准】周三读文献|韩昱晨教授:通过DNA和RNA测序检测NSCLC非典型RET基因融合的探索 |
您所在的位置:网站首页 › ret融合基因检测 › 【“石”力精准】周三读文献|韩昱晨教授:通过DNA和RNA测序检测NSCLC非典型RET基因融合的探索 |
【“石”力精准】周三读文献|韩昱晨教授:通过DNA和RNA测序检测NSCLC非典型RET基因融合的探索
|
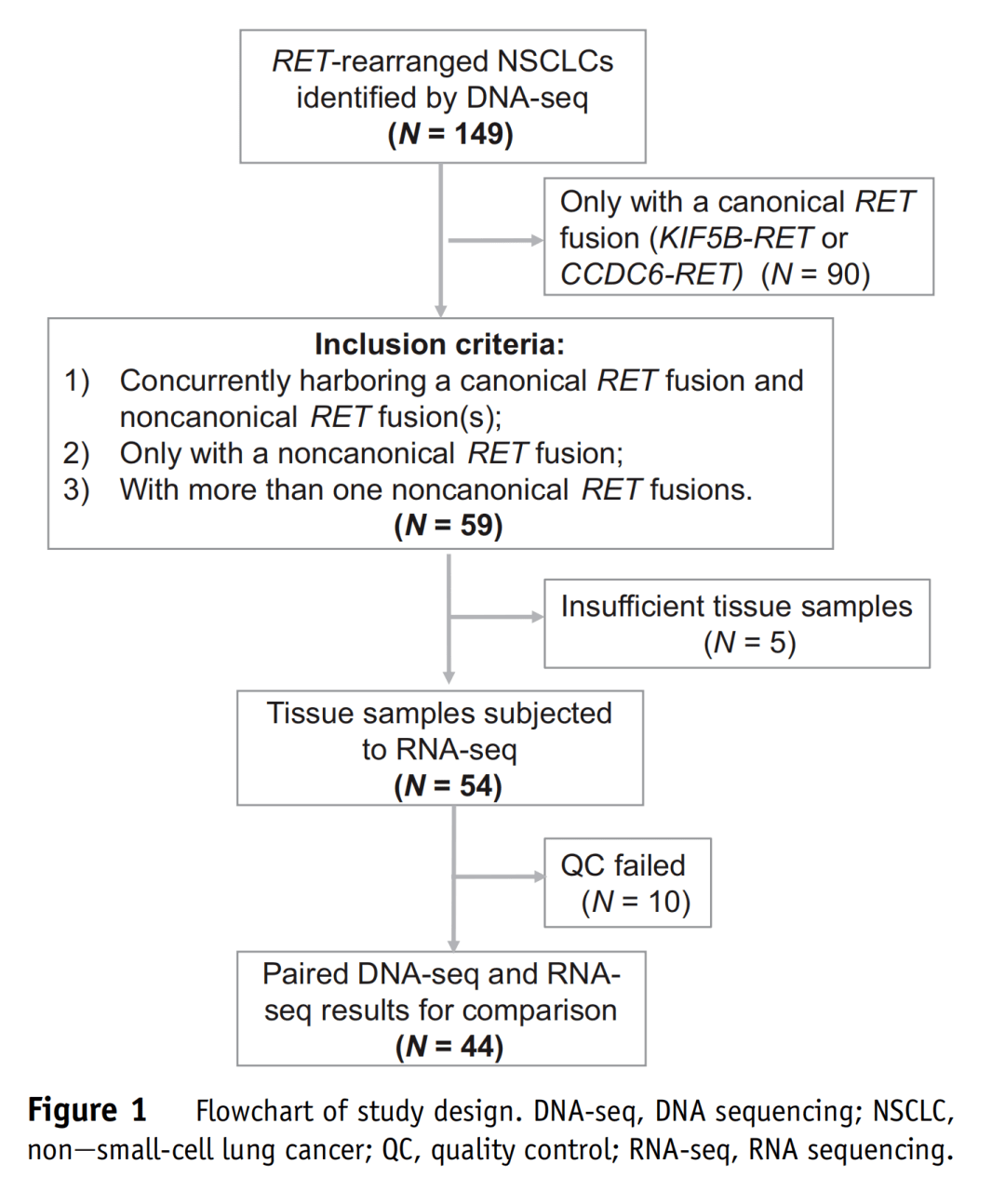
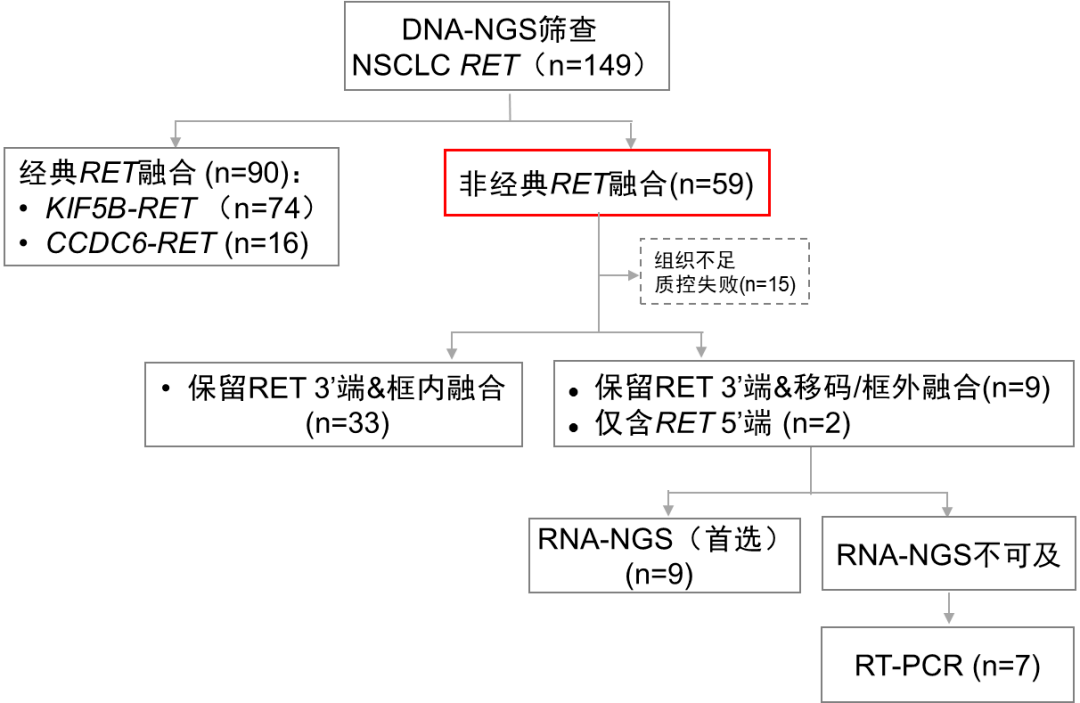
上海市胸科医院病理科主任 国际肺癌研究组织(IASLC)病理委员会 委员 中华医学会病理学分会 胸部学组 副组长 中华医学会病理学分会 分子病理学组 委员 上海市医学会分子诊断专科分会 委员 上海市医学会病理分会 委员 上海市医师学会病理委员会 委员 中华病理学杂志通讯编委 日本庆应大学医学部病理系 世川奖学金研修 美国匹兹堡大学医学部病理系 博士后 研究概述 一、研究方法 研究团队对上海市胸科医院的149例经DNA-seq证实为RET融合阳性的NSCLC病例进行回顾性分析,图1为研究设计流程图。KIF5B-RET和CCDC6-RET融合被认为是典型RET融合,其他归类为非典型RET融合。根据DNA-seq结果,排除仅携带单一典型RET融合的病例,其余病例纳入进一步分析,包括携带非典型RET融合的病例以及同时携带典型RET融合和非典型RET融合的病例。对有足够的福尔马林固定石蜡包埋(FFPE)组织的肿瘤样本进行RNA-seq,对合格测序数据进行DNA-seq和RNA-seq结果的描述和比较。
图1 研究设计流程 二、研究结果 (1)研究队列 在通过DNA-seq结果筛选出的149例RET融合阳性NSCLC中,54例非典型性RET融合病例的肿瘤样本进行了RNA-seq检测,44例产生合格测序数据的样本被纳入了DNA-seq和RNA-seq结果的平行比较(图1)。 表1总结了44例NSCLC的基本特征,中位年龄为54.2岁,72.7%无吸烟史,63.6%为男性。42例(95.5%)为肺腺癌,1例为神经内分泌癌,1例NSCLC非特指型。30例(68.2%)分期为早期(0~Ⅱ期),14例(31.8%)为晚期(Ⅲ~Ⅳ期)。
表1 研究队列基本特征 (2)DNA测序与RNA测序结果对比
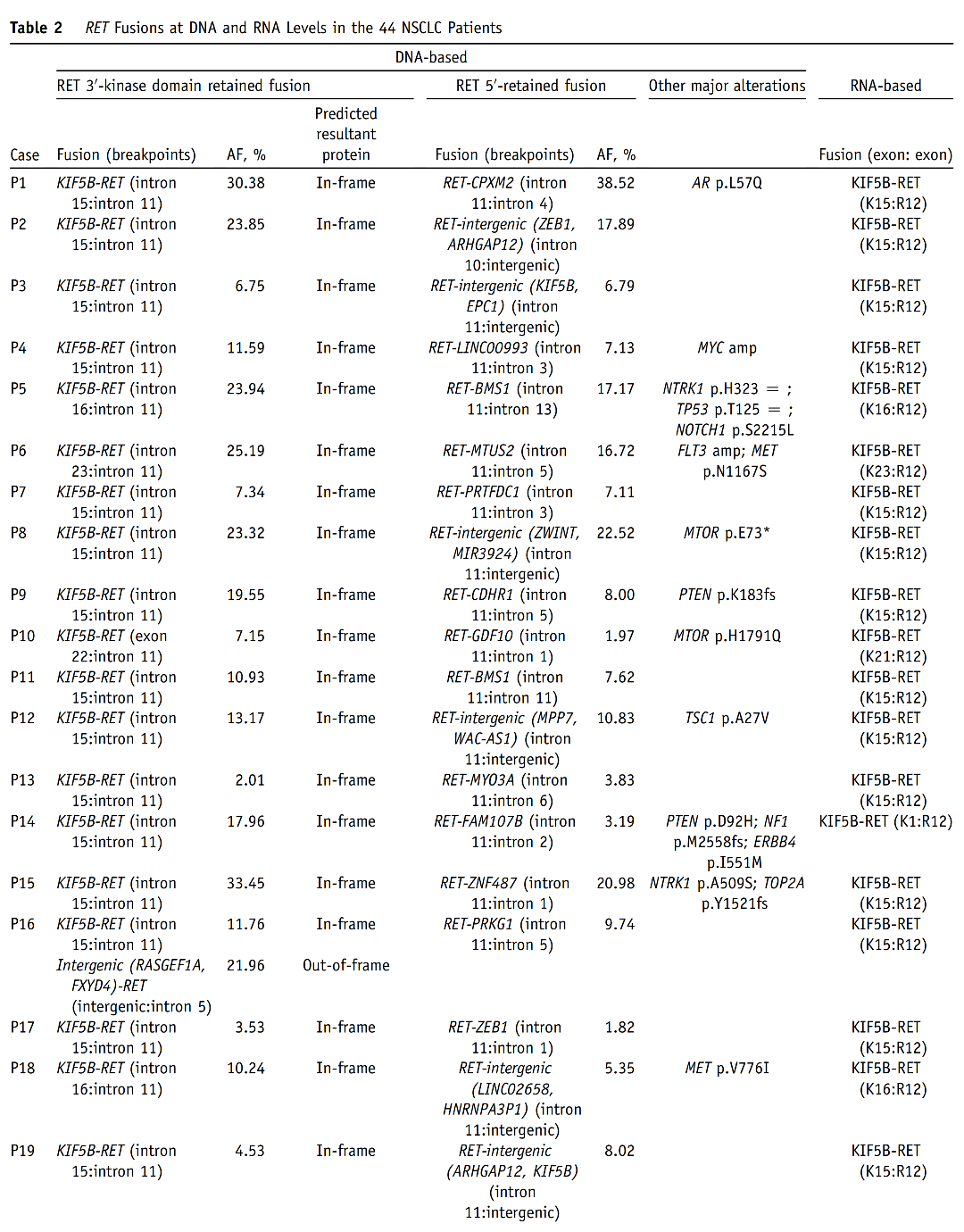
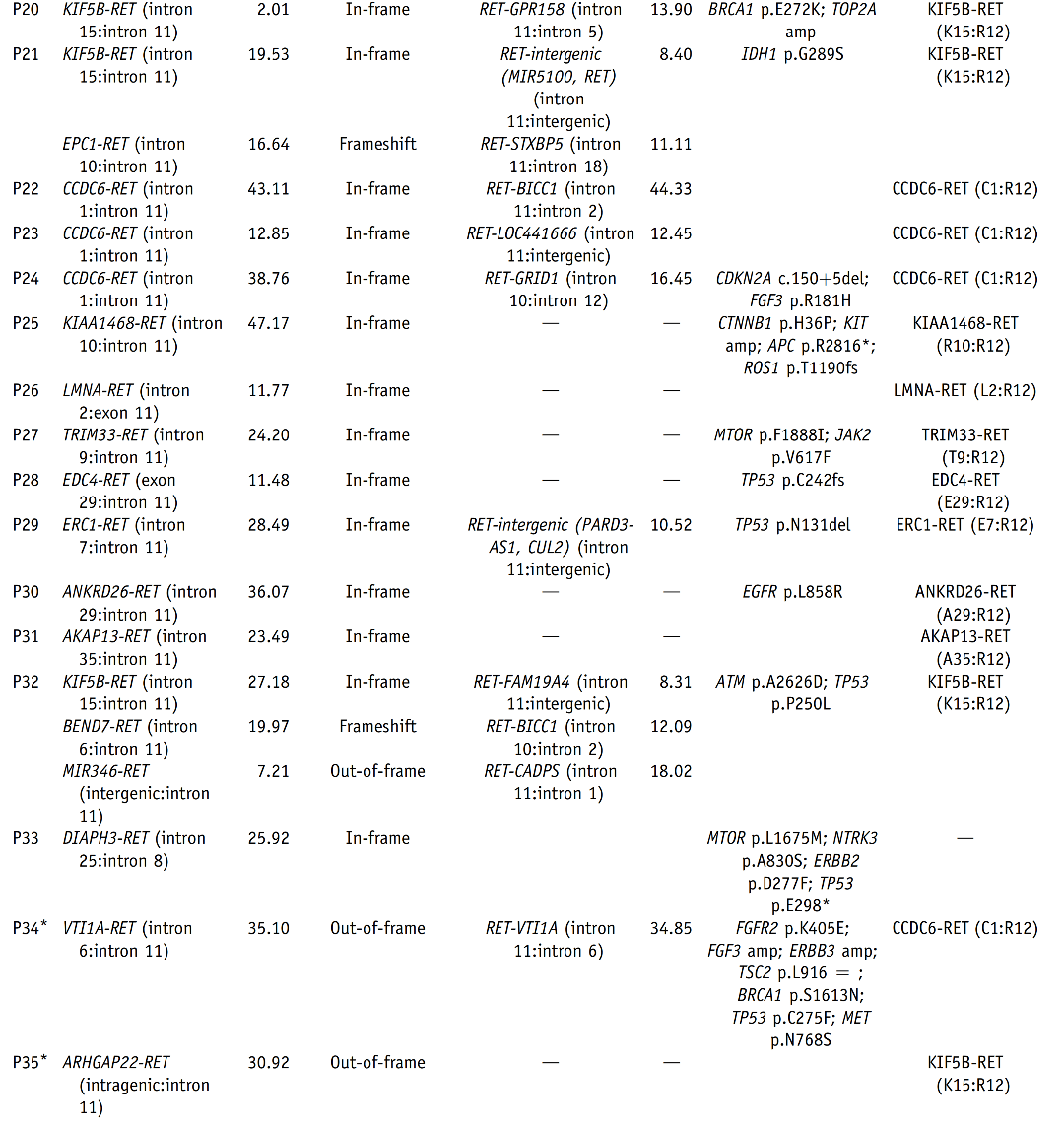
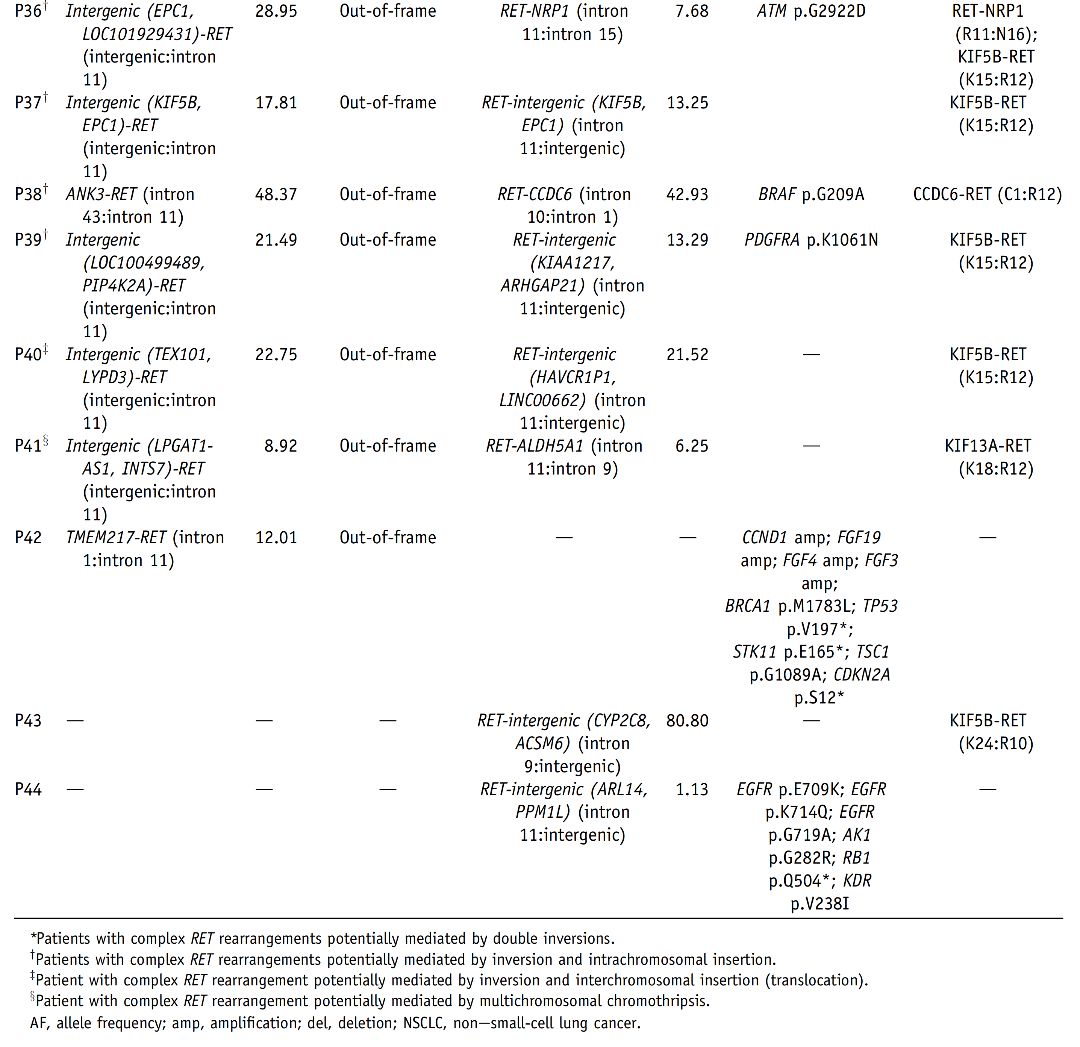
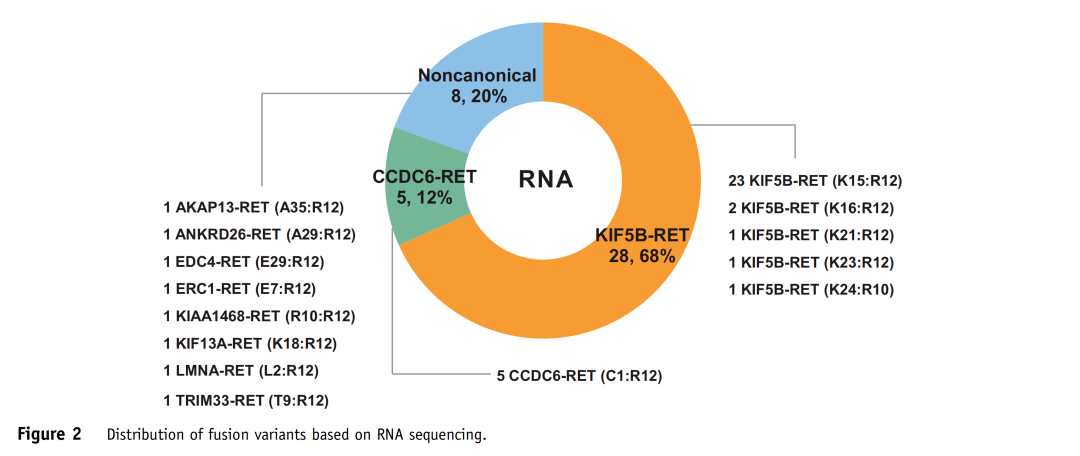
表2 44例样本DNA-seq与RNA-seq检测结果的平行对比 DNA水平NGS结果显示,在44例RET融合阳性NSCLC中,25例(56.8%)同时存在典型RET融合和非典型RET融合(P1~P24、P32),11例(25.0%)存在一种非典型RET融合(P25~P28、P30、P31、P33、P35、P42、P43、P44),8例(18.2%)存在一种以上非典型RET融合(P29、P34、P36~P41)(表2)。 RNA-seq结果显示,44例样本中41例RET融合阳性,与DNA-seq的符合率为93.2%。这41例样本中,28例(68.3%)为KIF5B-RET融合,5例(12.2%)为CCDC6-RET融合,8例(19.5%)为非典型伴侣融合(详见图2)。
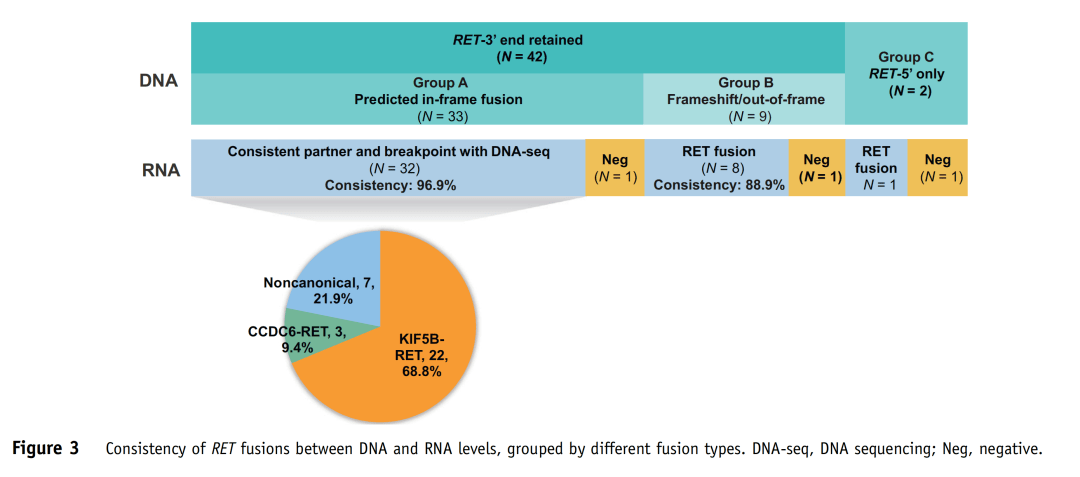
图2 基于RNA-seq检测的RET融合类型分布 根据DNA-seq结果将44例病例分为三组。A组:33例(75.0%,P1~P33)融合片段保留RET基因的3'端(含完整的激酶结构域),且预测可产生框内蛋白;B组:9例(20.5%,P34~P42)融合片段保留RET基因的3'端,且预测可产生移码/框外蛋白;C组:2例(4.5%,P43和P44)仅检测到融合片段保留RET基因的5'端,不含激酶结构域(图3和表2)。
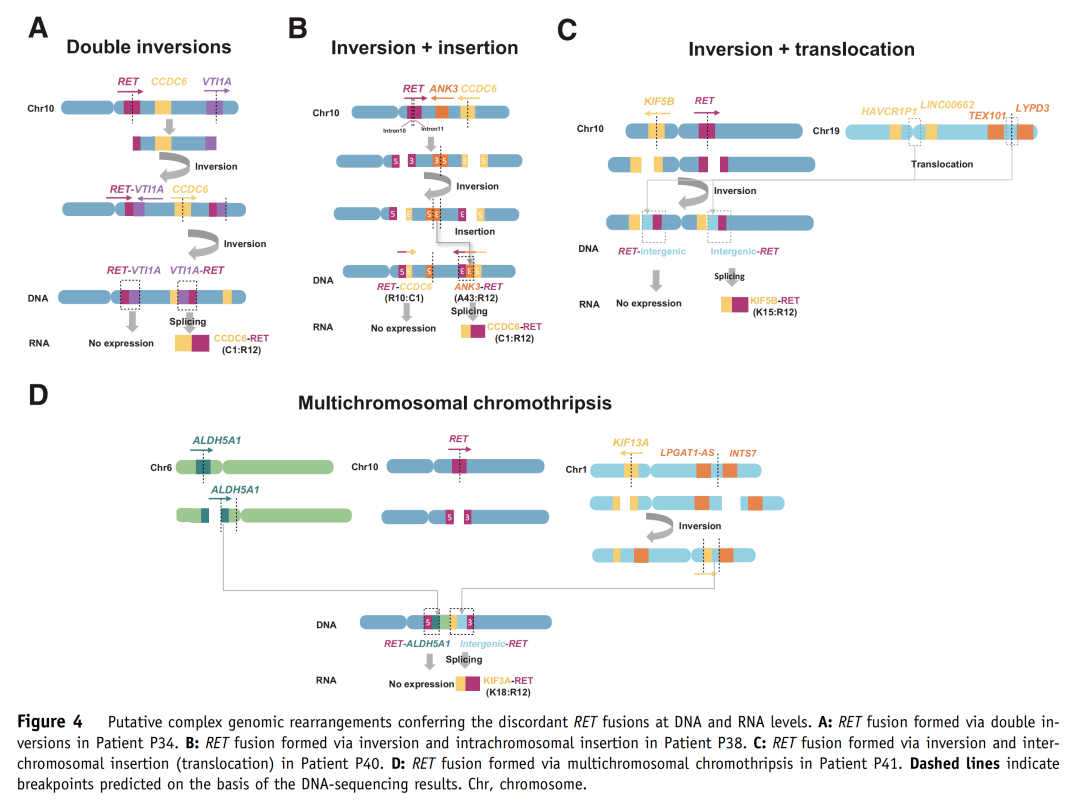
图3 DNA-seq与RNA-seq检测结果分组对比 A组33例中,有32例(96.9%)RNA-seq与DNA-seq检测到相同的RET融合伴侣和断裂点。其中,25例为典型融合(KIF5B-RET,n=22;CCDC6-RET,n=3),7例为非典型融合,包括KIAA1468-RET、LMNA-RET、TRIM33-RET、EDC4-RET、ERC1-RET、ANKRD26-RET和AKAP13-RET(图3和表2)。值得注意的是,其中26例样本,DNA-seq检测到reciprocal RET 5'端融合(与primary RET 3'端融合的伴侣不同),而RNA-seq未检测到其转录本(表2)。此外,病例P16、P21和P32含有额外的移码/框外3'端RET融合,也未被转录。病例P33经DNA-seq证实为框内融合,而RNA-seq未能检测到其融合转录本,这可能是因为该样本质量差(测序质控的部分参数为警戒值)导致RNA-seq未检出。 B组9例中,有8例(88.9%)RNA-seq检测出功能性RET融合转录本,与DNA-seq检测到的RET断裂点相同(图3和表2)。其中,7例为典型融合(KIF5B-RET,n=5;CCDC6-RET,n=2),1例为非典型融合KIF13A-RET。有趣的是,病例P36被DNA-seq预测为无功能的RET 5'端融合也产生了相应的RNA转录本(RET-NRP1)(表2)。病例P42在DNA水平预测产生反义TMEM217-RET融合(两个基因转录方向相反的融合),这可能是导致未检测到融合转录本的原因(表2)。 C组中,RNA-seq在病例P43中检测到KIF5B-RET转录本,其RET断裂点与DNA水平相同(表2),这表明DNA-seq未检测到相应的RET 3'端融合。病例P44未检测到融合转录本,而该样本在DNA水平上RET融合基因频率较低(1.13%),EGFR驱动突变频率较高(33%);因此,DNA-seq检测到的RET融合更有可能是乘客变异,而非驱动变异。 (3)DNA与RNA水平RET融合检测结果不一致的机制分析 为了探讨DNA与RNA水平RET融合检测结果不一致的潜在机制,研究者进一步针对在DNA水平预测产生框外融合但在RNA水平检测到框内融合转录本的8例样本(P34~P41)测序结果进行了分析。根据RET融合形成的可能机制,这8例可分为四类(表2,图4)。 首先,P34和P35的RET重排可能是由10号染色体上的双倒位介导的。例如,在P34中,第一次倒位产生了DNA-seq检测到的RET-VTI1A融合。第二次倒位发生在CCDC6基因和未翻转的VTI1A基因之间,在DNA水平上产生了CCDC6-VTI1A-RET融合。经剪接,最后形成CCDC6-RET(C1:R12)转录本(图4A)。 P36、P37、P38和P39的RET重排则可能是通过倒位和插入形成的(表2)。如图4B所示,病例P38断裂点发生在RET内含子10、11以及CCDC6内含子1。倒位产生了可被DNA-seq检测的RET-CCDC6(R10:C1),并形成了一个reciprocal RET 3'端融合。同时,重组时在CCDC6 5'端和RET 3'端之间随机插入一段ANK3基因片段,产生了被DNA-seq检测到的另一个ANK3-RET(A43:R12)重排。最后ANK3片段在转录过程中被剪切,产生CCDC6-RET(C1:R12)转录本。相似地,倒位和染色体间插入(易位)导致了病例P40中检测到的RET重排(图4C)。 在病例P41中观察到的RET重排则可能是通过多染色体碎裂形成的。如图4D所示,10号染色体上的RET基因在内含子11发生断裂,6号染色体上的ALDH5A1基因片段与RET 5'端相连,导致DNA水平上的RET-ALDH5A1重排。另一方面,在1号染色体上发生臂间倒位,将KIF13A 5'端与LPGAT1-AS1和INTS7的基因间区相连。然后,1号染色体破碎,KIF13A-intergenic片段与10号染色体上的RET 3'端重组,从而使得在DNA水平上检测到(LPGAT1-AS1,INTS7)-RET重排。经剪接,以上基因间区被移除,最后产生KIF3A-RET(K18:R12)转录本。
图4 基因组复杂的结构重排可能导致DNA-RNA水平检出RET融合伴侣的不一致 (4)在DNA水平有RET双重融合的患者可受益于RET抑制剂 病例P14为IV期骨转移患者,接受了多线化疗及纳武利尤单抗免疫治疗。免疫治疗失败后,基于DNA的NGS在该病例的肿瘤样本中检测到了双重融合:KIF5B-RET(intron15:intron11;等位基因频率,17.96%)和RET-FAM107B(intron11:intron2,等位基因频率,3.19%)(表2)。随后,患者开始接受高选择性RET抑制剂治疗,目前已维持治疗13个月,且仍在治疗中。 专家解析 2021年3月,国家药品监督管理局(NMPA)批准RET选择性酪氨酸激酶抑制剂(RET-TKI)普拉替尼用于既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性NSCLC成人患者的治疗,为我国RET融合NSCLC患者带来了福音。精准治疗,检测先行,NGS-DNA/RNA已被推荐为晚期NSCLC患者RET基因变异的主要检测方法之一,然而其性能指标,如敏感性、特异性、阳性预测值和阴性预测值,特别是在检测非典型RET融合方面,尚未被系统研究和充分阐明。因此,我们开展了本项研究,以期为NSCLC患者RET基因检测的标准化提供一定参考。 首先,本研究显示DNA-seq判定为RET融合的44例NSCLC患者中,41例RNA-seq检测出了功能融合转录本,即DNA-seq的阳性预测值为93.2%。不过,我们未纳入仅携带单一典型RET融合的病例,这可能低估了真实世界中的实际阳性预测值。 第二,通过对A组病例RNA-seq与DNA-seq结果的对比,本研究发现无论5'端融合伴侣是否是典型的,DNA-seq鉴定的框内RET 3'端融合有96.9%产生了功能RNA转录本(图3),这一类别中唯一的假阳性病例很可能归因于RNA样本的质量较差。这表明,如果DNA-seq预测到会产生框内蛋白的RET 3'端融合,则可能并不必要进行RNA-seq验证。此外,A组33例中有26例存在reciprocal 5'端融合,其伴侣与其3'端primary融合不同且未发生转录。而Li等人也观察到,在基于DNA-seq检测到的21例ALK/RET primary/reciprocal融合患者中,仅有primary融合在RNA水平上表达,以上研究提示reciprocal融合可能仅是乘客变异 [1] 。 第三,通过对B组病例RNA-seq与DNA-seq结果的对比,本研究发现DNA水平预测可产生框外嵌合蛋白的3'端RET融合有8例(88.9%)被检测到产生了框内转录本(图3和表2)。并且这8个病例在RNA水平上具有与DNA不同的5'端融合伴侣(7例典型和1例KIF13A),推测这可能是由于肿瘤基因组在转录过程中发生了复杂的结构重排和转录修饰(图4)。Li等人也在他们的研究队列中发现 [2] ,在16例DNA-seq检测到仅携带一个基因间区断点融合的NSCLC病例中,有11例表达融合转录本;但DNA水平的断点位置并不能预测RNA水平的断点,他们推测可能是由复杂的重排、选择性剪接或相互重排导致。在他们的队列中,5例样本RNA水平检测为融合阴性,其中4例通过DNA-seq鉴定产生了反义重排,这与本研究中B组唯一的假阳性病例一致(P42)。 此外,C组两个病例的RNA-seq与DNA-seq对比研究显示,尽管DNA-seq只检测到reciprocal融合(RET 5'端),但RNA-seq验证发现其中一例存在primary融合转录本(RET 3'端)。 综上所述,该研究提示,如果基于DNA的测序检测出携带KIF5B/CCDC6-RET以外的非典型RET重排,那么可以根据以下说明选择是否进行RNA水平的验证(图5):1)DNA-seq检出的RET重排如果保留RET 3’端,且预测可以产生框内融合,那么在RNA水平检出相同RET融合的可能性非常高,对于这类样本建议可以不进行RNA水平的验证;2)DNA-seq检出的RET重排如果保留RET 3’端且预测产生移码/框外融合或者DNA-seq只检测出RET 5’端的重排,在RNA水平则可能具有与DNA水平不同的融合伴侣和融合位点。这类样本建议进行进一步RNA水平的验证,如果不具备RNA-seq的条件,可以选择更经济便捷的RT-PCR法进行验证。
图5. NGS检测RET融合的建议流程 参考文献 [1]Li W, Guo L, Liu Y, Dong L, Yang L, Chen L, Liu K, Shao Y, Ying J: Potential unreliability of uncommon ALK, ROS1, and RET genomic breakpoints in predicting the efficacy of targeted therapy in NSCLC. J Thorac Oncol 2021, 16:404e418. [2]Li W, Liu Y, Li W, Chen L, Ying J: Intergenic breakpoints identified by DNA sequencing confound targetable kinase fusion detection in NSCLC. J Thorac Oncol 2020, 15:1223e1231. 关爱生命,精准诊疗 | 卢凯华教授:【“石”力精准】RET学院正式开讲! 【“石”力精准】周三读文献 | 任重道远,卢凯华教授谈中国晚期RET融合阳性NSCLC患者诊疗现状 【“石”力精准】周三读文献 | 从基因组学到治疗预后,史美祺教授思辨RET重排NSCLC患者的临床诊疗 【“石”力精准】周三读文献 | 马树东教授:中国RET融合肺癌患者面面观 【“石”力精准】周三读文献 | 马树东教授:前沿探索,RET抑制剂获得性耐药机制 【“石”力精准】周三读文献 | 陈丽昆教授:明察秋毫,中国NSCLC患者驱动基因特征 【“石”力精准】周三读文献 | 陈丽昆教授:从作用机制到前沿进展,全面认识RET驱动的肿瘤诊疗 【“石”力精准】周三读文献 | 吴骏教授:精准靶向,带来GIST后线治疗曙光 【“石”力精准】周三读文献 | 崔久嵬教授:从ASCO指南更新看驱动基因阳性非小细胞肺癌的精准治疗 【“石”力精准】周三读文献 | 沉谋研虑,邱海波教授:阿伐替尼治疗晚期GIST的最佳治疗策略 【“石”力精准】周三读文献 | 崔久嵬教授:循证固本,免疫治疗并非RET阳性变异患者的治疗优选 【“石”力精准】周三读文献 | 周晓燕教授:精准治疗,检测先行,解读《中国非小细胞肺癌 RET 基因融合临床检测专家共识》 【“石”力精准】周三读文献 | 周清教授:普拉替尼治疗RET融合阳性NSCLC研究结果重磅发布于Lancet Oncol 【“石”力精准】周三读文献 | 滕晓东教授:慎思明辨,全面认知PDGFRA D842V突变胃肠间质瘤 【“石”力精准】周三读文献 | 王宇教授:里程碑式进展,普拉替尼书写RET变异甲状腺癌精准治疗新篇章 【“ 石”力精准】周三读文献 | 黄媚娟教授:追本溯源,从临床前研究到落地实践,领略普拉替尼治疗RET变异肿瘤的精准之美 【“石”力精准】周三读文献 | 金时教授:方兴未艾,奥希替尼获得性耐药机制及联合普拉替尼治疗策略探索 【“石”力精准】周三读文献 | 唐源教授:分子病理指导实践,ESMO建议:精准RET检测引领精准靶向治疗 【“石”力精准】周三读文献 | 王佳蕾教授:步履不停,RET抑制剂耐药机制探索 【“石”力精准】周三读文献 | 蔡晓虹教授:三思而后行,再看免疫治疗RET融合阳性NSCLC无显著获益 【 “石”力精准】周三读文献 | 谢可教授:上下求索,驱动基因共突变NSCLC患者的诊疗之路 【“石”力精准】周三读文献 | 刘雨桃教授:星星之火,双靶向联合或是RET抑制剂耐药患者的未来 【“石”力精准】周三读文献 | 龙健婷教授:未来可期,双靶向联合带来EGFR-TKI获得性耐药新希望 【“石”力精准】周三读文献 | 吴焕文教授:病理指导实践,RET融合检测面面观 【“石”力精准】周三读文献 | 汪进良教授:纵览全局,获得性基因融合导致EGFR TKIs耐药的探索 【“石”力精准】周三读文献 |李咏生教授:见微知著,不同驱动基因突变NSCLC患者接受免疫治疗的疗效差异及相关影响因素分析 【“石”力精准】周三读文献 | 邢镨元教授:前沿新知,RET抑制剂耐药机制蓝图初显 【“石”力精准】周三读文献 | 周建娅教授:基础研究再看普拉替尼的药代动力学特征 【“石”力精准】周三读文献 | 金波教授:RET融合阳性女性肺癌患者 的基因特征及临床预后 【“石”力精准】周三读文献 | 丁翠敏教授:探索不止,RET变异肿瘤的现在和未来 【“石”力精准】周三读文献 | 谢聪颖教授:审时度势,关注普拉替尼合并用药时的安全问题 【“石”力精准】周三读文献 | 刘东颖教授:罕见驱动基因突变NSCLC患者谨慎选择免疫单药治疗 【“石”力精准】周三读文献|欧阳能太教授:精准治疗,检测先行,解读《甲状腺癌基因检测与临床应用广东专家共识》 【“石”力精准】周三读文献|叶峰教授:真实世界研究显示RET融合阳性NSCLC患者预后不佳,高选择性RET抑制剂带来希望 【“石”力精准】周三读文献|梁军教授:ESMO联合EURACAN、GENTURIS发布2021版GIST临床实践指南 【“石”力精准】周三读文献|周承志教授:RET融合阳性NSCLC对免疫一线治疗反应差,普拉替尼改变治疗格局 【“石”力精准】周三读文献|曾瑄教授:Break-Apart FISH检测甲状腺乳头状癌RET融合的探索 【“石”力精准】周三读文献|沈波教授分析普拉替尼与结核病之间的因果关系 【“石”力精准】周三读文献|王廷教授:从RET基因的“前世今生”,全面认识RET驱动的甲状腺癌靶向治疗 【“石”力精准】周三读文献|于雁教授:初识RET变异NSCLC的免疫特征,谨慎选择免疫治疗为一线方案 【“石”力精准】周三读文献|吴贤江教授畅谈普拉替尼治疗甲状腺癌的探索历程及临床应用 【“石”力精准】周三读文献|精准治疗,检测先行,解读《甲状腺癌RET基因检测与临床应用专家共识(2021)版》 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |