从弥漫性大B细胞淋巴瘤治疗的两次飞跃,看罗氏在血液肿瘤领域的创新与超越 |
您所在的位置:网站首页 › r-dhap方案副作用 › 从弥漫性大B细胞淋巴瘤治疗的两次飞跃,看罗氏在血液肿瘤领域的创新与超越 |
从弥漫性大B细胞淋巴瘤治疗的两次飞跃,看罗氏在血液肿瘤领域的创新与超越
|
原创 BioTalker 奇点网 收录于合集 #癌症 195个 *仅供医学专业人士阅读参考   淋巴瘤是严重威胁人类健康的常见恶性肿瘤之一。 虽然我国淋巴瘤发病率较西方国家低,但是由于我国人口基数较大,每年发病人数仍较多。 从国家卫生健康委发布的数据来看,我国2020年新发淋巴瘤约10万例,其中93%是非霍奇金淋巴瘤[1];而在非霍奇金淋巴瘤中,25%-50%是弥漫性大B细胞淋巴瘤(DLBCL)[2]。不难发现,DLBCL是对我国居民健康威胁最大的淋巴瘤。 在过去的三十年里,DLBCL的治疗经历了两次大飞跃,第一次是R-CHOP(利妥昔单抗联合环磷酰胺、阿霉素、长春新碱、泼尼松)方案的横空出世,第二次是维泊妥珠单抗、利妥昔单抗和化疗组成的Pola-R-CHP方案诞生。 值得一提的是,这两次飞跃都与罗氏的创新密不可分。在今年的“罗氏血液学术周”期间,罗氏制药中国医学与个体化医疗部副总裁李滨和罗氏中国转化医学部门负责人张景宇,向奇点网分享了罗氏团队在血液肿瘤领域的创新,以及罗氏如何借助转化医学在血液肿瘤领域飞得更高。 两次伟大的飞跃 1997年,是癌症治疗史上的一个重要分水岭。 那一年,靶向CD20的利妥昔单抗(美罗华)获得美国FDA获批上市,让人类首次拥有了一种比传统化疗更有效、副作用更小的抗癌药物[3-5]。癌症的治疗从此进入了精准治疗时代。 巧的是,第一个用上精准治疗药物的癌症就是DLBCL。大量的临床研究证明,R-CHOP可以让DLBCL患者的5年生存率和10年生存率大幅提升[6]。这是DLBCL治疗领域近30年的第一次飞跃。 “利妥昔单抗是DLBCL近20年来的治疗基石,将DLBCL的5年生存率从30%-40%提高到了50%-60%。”李滨告诉奇点网。2000年4月,罗氏的利妥昔单抗获得国家药品监督管理总局(NMPA)的批准,在我国正式上市。  罗氏制药中国医学与个体化医疗部副总裁李滨 虽然利妥昔单抗对于DLBCL的治疗而言属于颠覆式创新,但是罗氏围绕CD20的创新没有止步于此。 他们先推出了免疫原性低、稳定性高、细胞杀伤效应更强的人源化II型抗CD20单抗奥妥珠单抗(佳罗华),并成为滤泡淋巴瘤治疗的重要标准。 随后,他们又在“调动人体自身免疫系统更好地杀伤肿瘤”这一科学理念的指导下,推出了两款能连接T细胞和癌细胞的双特异性抗体。一个是全球首个上市用于淋巴瘤治疗CD20/CD3双抗Mosunetuzumab,另一个是拥有独特2:1的抗体结构设计并且即将进入中国的CD20/CD3双抗Glofitamab。 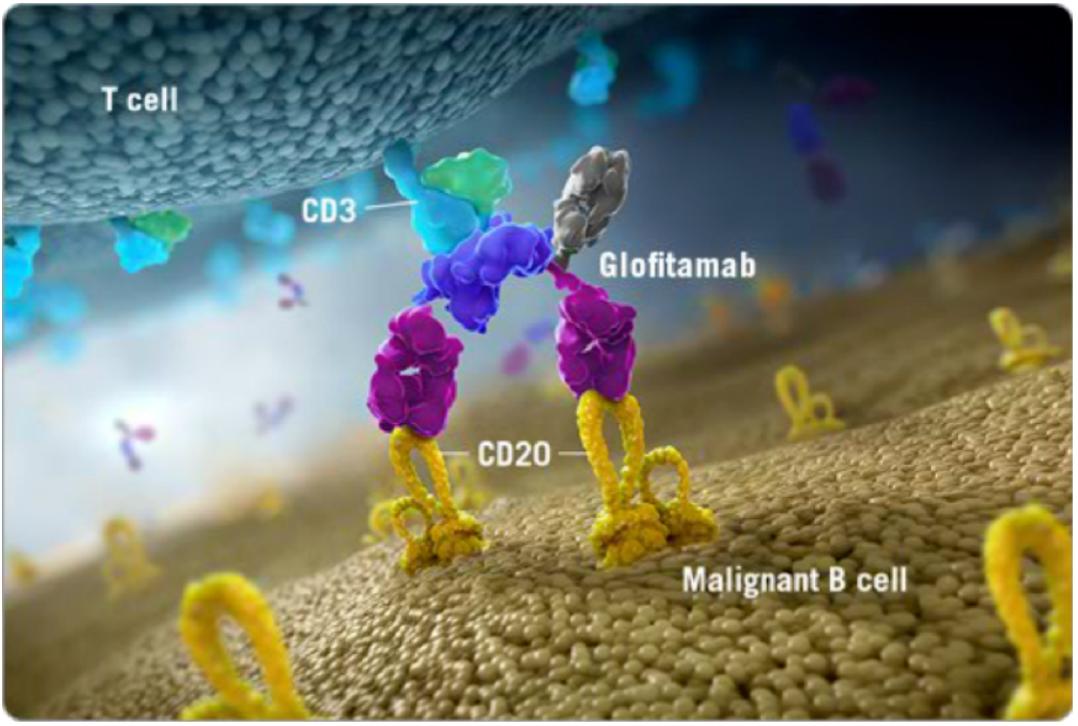 Glofitamab示意图 不过,罗氏研究人员面前还摆着一个大问题:尽管R-CHOP让60%左右的DLBCL实现了临床治愈,仍有40%的患者不响应治疗或复发。“这是免疫化疗方案的局限性,我们一直在考虑用什么样的方式能够实现更好的疗效突破。”李滨说。 实际上,有很多研究团队也思考过这个问题,并开展了很多R-CHOP+X方案的治疗探索。遗憾的是,它们都没能超越R-CHOP方案。也就是说,在R-CHOP方案的前面,是一片“无人区”。要想穿越这片“无人区”,非颠覆式创新不可。 在这样的背景下,全球第一个靶向CD79b的抗体偶联药物(ADC)维泊妥珠单抗(优罗华,Pola)诞生,并成为突破DLBCL治疗瓶颈的关键。 登顶《新英格兰医学杂志》的POLARIX研究显示,在28.2个月的中位随访时间里,Pola-R-CHP组DLBCL患者的2年无进展生存率为76.7%,显著优于R-CHOP组的70.2%[7]。这意味着,患者疾病进展、复发或死亡风险相对下降了27%。DLBCL治疗领域近30年的第二次飞跃就此出现了。  CD20和CD79b “维泊妥珠单抗是DLBCL治疗领域近20多年来一线治疗的第一个突破。”李滨告诉奇点网,“实际上,罗氏的产品设计都是在不断挑战临床金标准,挑战我们自己,以期为患者带来更好的临床疗效和长期获益。” 飞得更高,飞得更远 如果说罗氏研发团队通过研发利妥昔单抗和维泊妥珠单抗,实现了DLBCL治疗的两次飞跃;那么罗氏转化医学团队正借助于转化医学的力量,让DLBCL患者获益更大,让罗氏在这个领域飞得更高、更远。 DLBCL是一种异质性很强的恶性肿瘤[8],罗氏中国转化医学部门负责人张景宇认为,围绕疾病分型、患者对药物治疗的反应和预后,以及复发和耐药等生物学的研究,是转化医学助力药物研发和精准治疗的关键。  罗氏中国转化医学部门负责人张景宇 已经有研究发现,DLBCL的临床和分子特征与患者的预后有关。因此,在这些研究的基础上,也诞生了一些对患者进行风险分层的预后工具。 其中最值得介绍的,是循环肿瘤DNA(ctDNA)。早在2018年,斯坦福大学医学院的研究人员发起的一项回顾性研究发现,治疗前后ctDNA水平的变化与DLBCL患者的无事件生存(EFS)和总生存(OS)有关[9]。 在这个研究的启发下,研究人员在设计POLARIX研究的时候,前瞻性地纳入了ctDNA的检测,分别在基线时、治疗的C2D1(第2个治疗周期的第1天)和C5D1、治疗结束时(EOT),以及随访的第6-24月时(每6个月1次)。 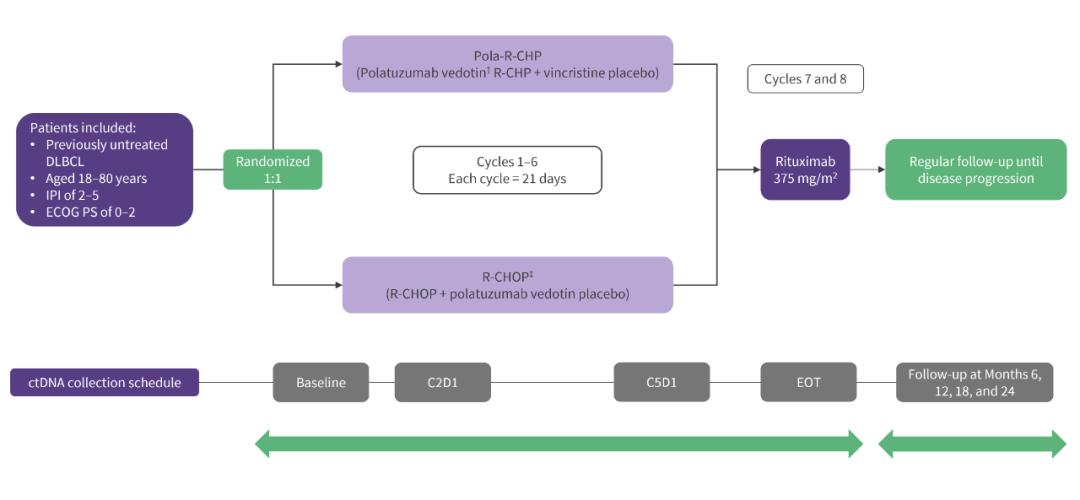 POLARIX研究设计 在去年的美国血液学会(ASH)年会上,研究人员发布的初步探索性分析结果表明,ctDNA检测对既往未经治疗的DLBCL患者具有预后价值,在接受一个周期的Pola-R-CHP治疗后(C2D1),ctDNA水平变化的LFC<2.5(下降较少)和/或ctDNA未清除的患者预后(PFS和OS)较差[10]。 在去年的美国临床肿瘤学会(ASCO)年会,研究人员又报告了C5D1和EOT时ctDNA的清除与PFS和OS之间的关系。他们发现,在C5D1和EOT时达到ctDNA清除,是DLBCL患者PFS和OS延长的预后指标[11]。 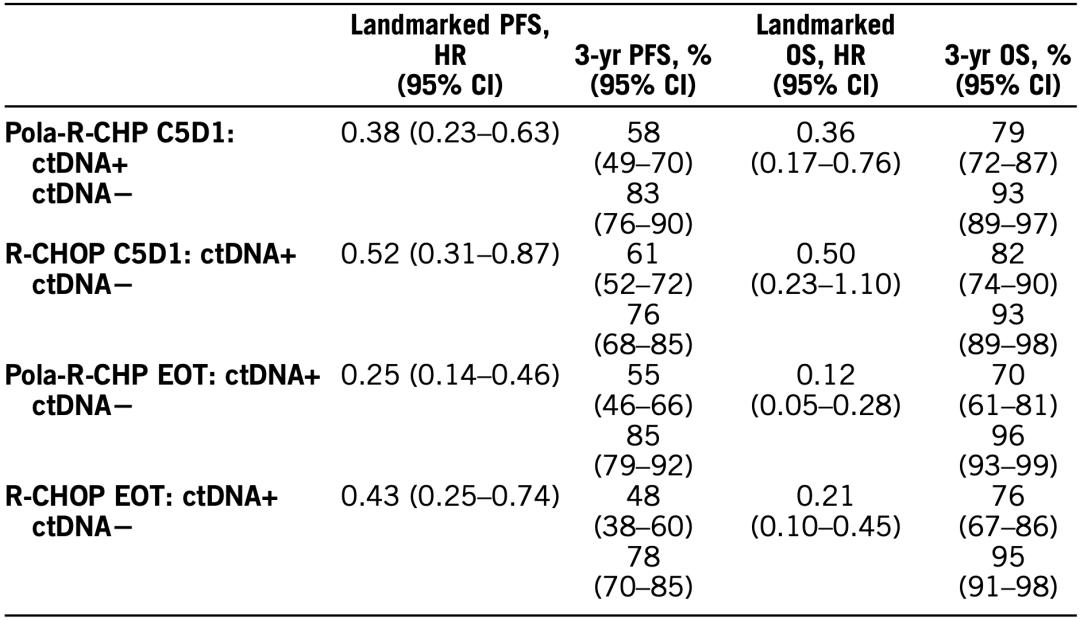 C5D1和EOT时ctDNA的状态与PFS和OS的关系 “标志物对DLBCL患者的分层和预后很重要,包括罗氏在内的研究团队发现,ctDNA的变化与预后和药物的疗效有关。”张景宇告诉奇点网,“我们希望通过创新的、严谨的、以及无边界(不仅仅是生物学,还有数据和临床等)的转化医学方法和工具,来催化和加速我们的新药研发和精准治疗,以实现对治疗策略有革新性的改善,最终让患者获益。” 不难看出,利妥昔单抗和维泊妥珠单抗等创新性药物的出现,让DLBCL患者有了疗效更好的标准基础疗法;而转化医学领域的研究,又帮助罗氏往精准化/个体化治疗迈出了一大步。 总的来说,对于坚持以患者为中心的罗氏而言,突破自我就是颠覆式创新。 参考文献: [1].中华人民共和国国家卫生健康委员会,《淋巴瘤诊疗指南(2022年版)》 [2].中华人民共和国国家卫生健康委员会,《弥漫性大B细胞淋巴瘤诊疗指南(2022年版)》 [3].https://www.drugs.com/newdrugs/rituxan-rituximab-first-new-non-hodgkin-s-lymphoma-decade-receives-fda-clearance-marketing-4823.html [4].Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med. 2002;346(4):235-242. doi:10.1056/NEJMoa011795 [5].Habermann TM, Weller EA, Morrison VA, et al. Rituximab-CHOP versus CHOP alone or with maintenance rituximab in older patients with diffuse large B-cell lymphoma. J Clin Oncol. 2006;24(19):3121-3127. doi:10.1200/JCO.2005.05.1003 [6].NCCN Clinical Practice Guidelines in Oncology, B-Cell Lymphomas, Version 2.2019. [7].Tilly H, Morschhauser F, Sehn LH, et al. Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma. N Engl J Med. 2022;386(4):351-363. doi:10.1056/NEJMoa2115304 [8].Sehn LH, Salles G. Diffuse Large B-Cell Lymphoma. N Engl J Med. 2021;384(9):842-858. doi:10.1056/NEJMra2027612 [9].Kurtz DM, Scherer F, Jin MC, et al. Circulating Tumor DNA Measurements As Early Outcome Predictors in Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2018;36(28):2845-2853. doi:10.1200/JCO.2018.78.5246 [10].Herrera A F, McCord R, Kimes P, et al. Risk Profiling of Patients with Previously Untreated Diffuse Large B-Cell Lymphoma (DLBCL) By Measuring Circulating Tumor DNA (ctDNA): Results from the POLARIX Study[J]. Blood, 2022, 140(Supplement 1): 1297-1300. [11].Herrera A F, Tracy S, Sehn L H, et al. Circulating tumor DNA (ctDNA) status and clinical outcomes in patients (pts) with previously untreated diffuse large B-cell lymphoma (DLBCL) in the POLARIX study[J]. 2023.   本文作者丨BioTalker 阅读原文 |
【本文地址】
今日新闻 |
推荐新闻 |