PD |
您所在的位置:网站首页 › pd—1什么意思 › PD |
PD
|
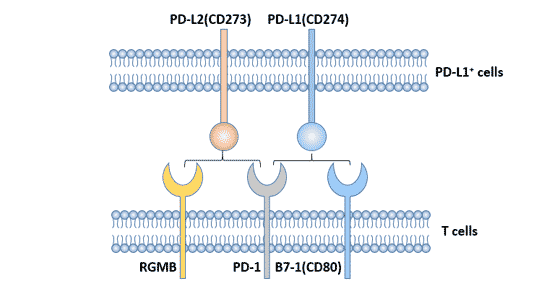
图1 PD-1的配体
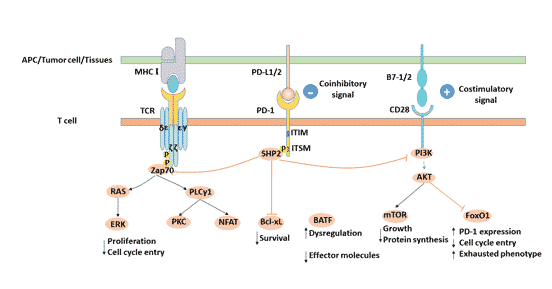
3.1 PD-L1 PD-L1(B7-H1、CD274)是PD-1的配体,该基因位于人类染色体9p24。 它是由Dong等[3]于1999年发现的,是B7家族的新成员。 3.1.1 PD-L1的结构 PD-L1是一种40kDa的I型跨膜糖蛋白,由胞外段、疏水跨膜段和短的胞质结构域组成。 胞膜外区有1个免疫球蛋白恒定区(IgC)结构域和1个免疫球蛋白可变区(IgV)结构域。PD-L1细胞质区含有一个蛋白激酶C磷酸化位点,但胞内区的信号转导基序目前尚不明确。 3.1.2 PD-L1的表达 CD274在心脏、骨骼肌、胎盘和肺中高表达,在胸腺、脾脏、肾脏和肝脏中弱表达。PD-L1表达于T细胞、B细胞、巨噬细胞、树突状细胞、间质干细胞和培养的骨髓衍生肥大细胞上,且在活化后的细胞上表达明显上调。 在非造血系统中,PD-L1表达于血管内皮细胞、上皮细胞、成纤维细胞网状细胞、胰岛细胞、骨骼肌细胞、胚胎滋养层细胞、星形胶质细胞、肝细胞、胎盘,视网膜色素上皮细胞等。 PD-L1在多种肿瘤细胞中表达,如人肺癌、卵巢癌、结肠癌、肾癌和黑色素瘤等。 3.2 PD-L2 PD-L2是由Freeman实验室鉴定出来的[4]。人PD-L2(B7-H2、CD273)基因同样位于染色体9p24,编码247个氨基酸的I型跨膜蛋白。PD-L1和PD-L2两者的同源性为40%。PD-L2与PD-1的亲和力是PD-L1的2~6倍。 与PD-L1相比,PD-L2的表达相对较局限,PD-L2诱导性表达于树突细胞、巨噬细胞、骨髓来源肥大细胞等细胞表面[5] [6]。人的PD-L2也表达在血管内皮细胞上。 4. PD-L1/PD-1信号通路 PD-1与其配体PD-L1结合后,PD-1胞质区ITSM结构域中的酪氨酸发生磷酸化,招募SHP2磷酸酶类分子至胞膜内侧[7],发挥对下游信号的负调控,进一步抑制PI3K/PKB介导的Zap-70/CD3ζ和PKCθ磷酸化,抑制T细胞增殖、分化和细胞因子产生[8] [9]。 图2 PD-L1/PD-1信号通路
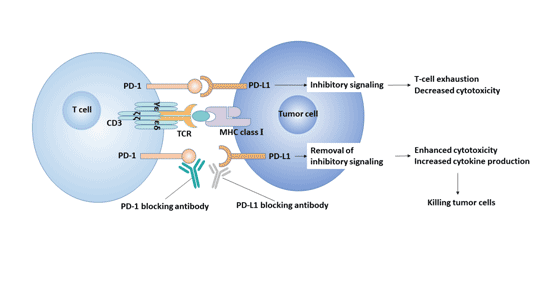
4.1 PD-1/PD-L1信号通路的功能 IFN-γ上调正常组织细胞和不同肿瘤组织细胞表面的PD-L1,通过诱导PD-L1表达来下调肿瘤微环境的免疫应答。PD-1在T细胞受到炎症信号刺激后被诱导产生,并且在以感染和肿瘤为主的多种外周组织中限制T细胞的功能,由此可限制免疫反应的放大和持续时间,从而避免正常组织的损伤。 虽然PD-L1和PD-1上调的生理功能是为了避免炎症扩大,降低组织损伤,但是肿瘤微环境中诱导产生的PD-L1会促进活化的T细胞凋亡,也会刺激人外周血T细胞产生IL-10来调节免疫抑制。 PD-1/PD-L1的相互作用在体内抑制T细胞方面起到重要作用。PD-L1与T细胞膜上的受体PD-1结合产生抑制信号,可阻止CD4+T细胞、CD8+T细胞增殖、活化,下调一些抗凋亡分子和促炎因子的表达,改变肿瘤微环境,使机体对肿瘤细胞的监视及清除能力减弱,产生免疫逃逸,从而让肿瘤细胞能在机体内无限增殖[10]。因此,阻断PD-1/PD-L1通路可以恢复免疫系统对肿瘤细胞的杀伤作用。 4.2 PD-1/PD-L1信号通路与疾病 PD-1与其主要配体PD-L1结合形成PD-1/PD-L1信号通路,该信号通路在维持外周耐受和调节抗原特异性T细胞活性及其介导的炎症性疾病中发挥着重要的作用,是感染性疾病慢性化和自身免疫性疾病的重要影响因素。 PD-1/PD-L通路对自身免疫性疾病和移植排斥反应有积极的调控作用,但在抗病毒、抗肿瘤方面则起到消极的作用。 4.2.1 PD-1/PD-L1信号通路与慢性病毒感染 病毒感染可导致抗原特异性T细胞表面PD-1、PD-L1表达升高,抑制CD4+和CD8+T细胞的增殖,减少细胞因子白细胞介素2(IL-2)、干扰素γ(IFN-γ)分泌或扩散,引起特异性T淋巴细胞免疫功能降低,甚至衰竭。这削弱宿主的抗感染免疫反应,导致靶器官损伤,最终引起病毒持续感染等相关疾病的发生。这表明PD-1/PD-L1通路可能是慢性病毒感染以及疾病慢性化的主要原因之一。 PD-1/PD-L通路被证实与HIV、HBV、HCV感染[11]等T细胞相关的慢性病毒感染有关。 在慢性病毒感染中,用抗体阻滞PD-1,CD8+T细胞能重新活化、增殖和分化,并恢复其杀病毒能力,使病毒滴度下降[12]。 4.2.2 PD-1/PD-L与自身免疫病 作为一个关键的共抑制分子,PD-1的基因多态性与自身免疫病的易感性存在联系,表明PD-1可能在自身免疫病的发生和发展中起重要作用[13]。 系统性红斑狼疮(systemic lupus erythematosus,SLE)这是一类系统性自身免疫病。研究发现[14],PD-1基因在人染色体上的位点恰好是SLE发生的高敏感性候选位点。 PD-1基因位点频率异常引起PD-1表达下降,从而使PD-1/PD-L信号通路调节异常而导致SLE发生。 PD-1的表达下降与PD-1.3A/G等位基因有关,可能是因为PD-1.3的基因多态性破坏了Runt相关蛋白1的DNA结合位点,使PD-1基因转录水平下降,引起T细胞等异常活化和增殖,从而诱导SLE发生。 PD-1/PD-L与类风湿性关节炎类风湿性关节炎(RA)是一种慢性炎性自身免疫病,该疾病的基本病理特点为慢性滑膜炎和滑膜增生。 T细胞参与了RA发生,外周血T细胞的异常增殖分化启动RA的发生,同时促进慢性炎性反应。 RA病人CD4+和CD8+T细胞表面表达的PD-1和血清中可溶性PD-1(soluble PD-1,sPD-1)的水平均降低[15]。这表明PD-1通过调节T细胞的活性参与了风湿性关节炎的发生。 4.2.3 PD-1/PD-L与肿瘤 在人体内,肿瘤组织上表达的抗原虽然可被宿主的T细胞识别,但不一定被清除。原因之一就是肿瘤微环境中PD-L1和PD-1的上调表达。PD-L1在肿瘤组织(如淋巴瘤、绒毛膜癌、黑色素瘤、食管癌)中的表达以及PD-1在肿瘤浸润淋巴细胞上的表达上调参与了相关的免疫抑制信号传导。 PD-1/PD-L1信号通路的激活抑制了CD4+T细胞、CD8+T细胞增殖、活化,抑制细胞因子的表达,改变肿瘤微环境,使机体对肿瘤细胞的监视及清除能力减弱,促进肿瘤细胞逃避机体免疫监视和杀伤[16]。因此,PD-1/PD-L通路成为治疗肿瘤的新的作用靶点。 图3 PD-1/PD-L1信号通路与肿瘤的关系
5. PD-1/PD-L在治疗方面的应用 PD-1和PD-L1信号通路在感染免疫、肿瘤免疫、移植免疫中起着重要作用,这使得靶向PD-1/PD-L1信号通路成为治疗肿瘤的研究热点。 免疫检查点阻滞剂PD-1/PD-L1抗体类药物的研发是目前肿瘤治疗领域的研究热点。PD-1/PD-L1抗体作为肿瘤免疫治疗方法之一,通过阻断PD-1/PD-L1信号通路,逆转肿瘤免疫微环境,增强内源性抗肿瘤免疫效应。 作用于PD-1/PD-L1信号通路的抗体分为两类,包括抗PD-1抗体和抗PD-L1抗体。抗PD-1抗体能够阻断PD-1与PD-L1及PD-L2的相互作用,而抗PD-L1抗体仅能阻断PD-1与PD-L1的相互作用,却不能阻断PD-1与PD-L2的相互作用。目前主要的抗PD-1/PD-1抗体有nivolumab、Pembrolizumab、ipidilizumab、(avelumab、atezolizumab和durvalumab)。其中nivolumab和pembrolizumab是PD-1抗体,avelumab、atezolizumab和durvalumab是PD-L1抗体。 Nivolumab已被批准用于非小细胞肺癌(NSCLC)、肾细胞癌(RCC)、膀胱癌(BC)、微卫星不稳定性或错配修复缺陷(MSI-H/dMMR)的结直肠癌(CRC)、肝细胞癌(HCC)、经典霍奇金淋巴瘤(cHL)、黑色素瘤和头颈部鳞状细胞癌(HNSCC)的治疗。 Pembrolizumab已经被批准用于黑色素瘤、HNSCC、宫颈癌、cHL、NSCLC、BC、胃癌和胃食道癌,以及所有被归类为MSI-H/dMMR的晚期实体肿瘤。 Avelumab已被批准用于治疗默克尔细胞癌和BC。 Atezolizumab已经被批准用于NSCLC和膀胱癌。 Durvalumab已经被批准用于治疗膀胱癌和NSCLC (III期)。 在黑色素瘤Ⅲ期临床试验中,PD-1抗体nivolumab和Pembrolizumab这两种药物的疗效都得到了认可。此外,PD-1抗体在肺癌和卵巢癌也得到了应用。 6. PD-1抑制剂毒副反应 PD-1抑制剂虽然有惊人疗效,但是也诱发了免疫相关的毒副反应(immune-related adverse events, irAEs)。 这可能与免疫检查点通路维持人体免疫稳态的作用被破坏相关[17]。即通过靶向阻断免疫检查点等负调节因子,增强T细胞的活性,导致免疫过强化,在达到抗肿瘤效果的同时不可避免产生对正常组织的损伤。 References [1] Ishida Y, Agata Y, Shibahara K, et al. Induced expression of PD‐1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death [J]. The EMBO journal, 1992, 11(11): 3887-3895. [2] Hams E, McCarron M J, Amu S, et al. Blockade of B7-H1 (programmed death ligand 1) enhances humoral immunity by positively regulating the generation of T follicular helper cells [J]. The Journal of Immunology, 2011, 186(10): 5648-5655. [3] Dong H, Zhu G, Tamada K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion [J]. Nature medicine, 1999, 5(12): 1365. [4] Latchman Y, Wood C R, Chernova T, et al. PD-L2 is a second ligand for PD-1 and inhibits T cell activation [J]. Nature immunology, 2001, 2(3): 261. [5] Ghiotto M, Gauthier L, Serriari N, et al. PD-L1 and PD-L2 differ in their molecular mechanisms of interaction with PD-1 [J]. International immunology, 2010, 22(8): 651-660. [6] Keir M E, Butte M J, Freeman G J, et al. PD-1 and its ligands in tolerance and immunity [J]. Annu. Rev. Immunol., 2008,26: 677-704. [7] Sheppard K A, Fitz L J, Lee J M, et al. PD‐1 inhibits T‐cell receptor induced phosphorylation of the ZAP70/CD3ζ signalosome and downstream signaling to PKCθ [J]. FEBS letters, 2004, 574(1-3): 37-41. [8] Chemnitz J M, Parry R V, Nichols K E, et al. SHP-1 and SHP-2 associate with immunoreceptor tyrosine-based switch motif of programmed death 1 upon primary human T cell stimulation, but only receptor ligation prevents T cell activation [J]. The Journal of Immunology, 2004, 173(2): 945-954. [9] Riley J L. PD‐1 signaling in primary T cells [J]. Immunological reviews, 2009, 229(1): 114-125. [10] Ramsay A G. Immune checkpoint blockade immunotherapy to activate anti‐tumour T‐cell immunity [J]. British journal of haematology, 2013, 162(3): 313-325. [11] Hofmeyer K A, Jeon H, Zang X. The PD-1/PD-L1 (B7-H1) pathway in chronic infection-induced cytotoxic T lymphocyte exhaustion [J]. BioMed Research International, 2011, 2011. [12] Watanabe T, Bertoletti A, Tanoto T A. PD-1/PD-L1 pathway and T-cell exhaustion in chronic hepatitis virus infection [J]. Journal of viral hepatitis, 2010, 17(7): 453-458. [13] Suarez-Gestal M, Ferreiros-Vidal I, Ortiz J A, et al. Analysis of the functional relevance of a putative regulatory SNP of PDCD1, PD1.3, associated with systemic lupus erythematosus [J]. Genes and immunity, 2008, 9(4): 309. [14] Prokunina L, Castillejo-López C, öberg F, et al. A regulatory polymorphism in PDCD1 is associated with susceptibility to systemic lupus erythematosus in humans [J]. Nature genetics, 2002, 32(4): 666. [15] Li S, Liao W, Chen M, et al. Expression of programmed death-1 (PD-1) on CD4+ and CD8+ T cells in rheumatoid arthritis [J]. Inflammation, 2014, 37(1): 116-121. [16] Quezada S A, Peggs K S. Exploiting CTLA-4, PD-1 and PD-L1 to reactivate the host immune response against cancer [J]. British journal of cancer, 2013, 108(8): 1560. [17] Michot J M, Bigenwald C, Champiat S, et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review [J]. European journal of cancer, 2016, 54: 139-148.返回搜狐,查看更多 |
【本文地址】