重磅 |
您所在的位置:网站首页 › pdl1检测费用是多少一次 › 重磅 |
重磅
|
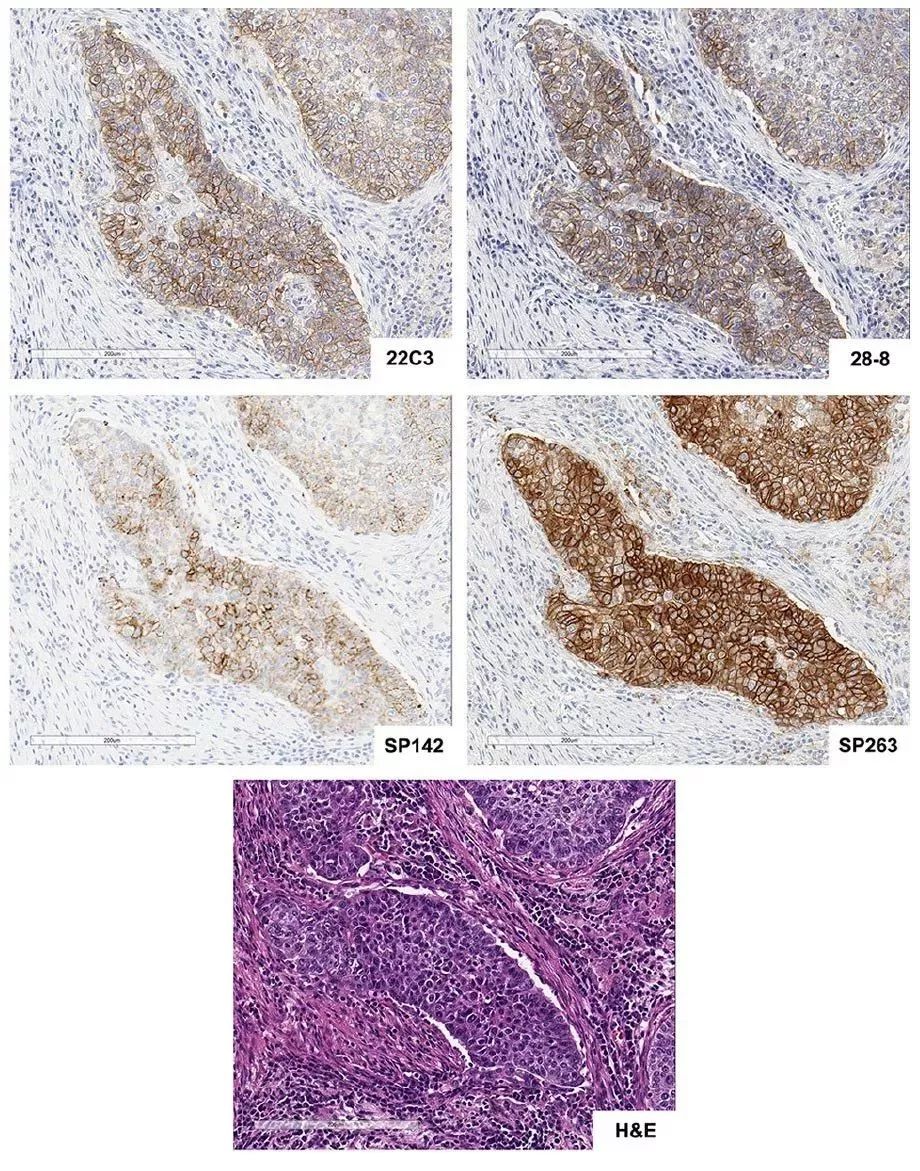
从国际上已报道的研究来看,针对以上4种PD-L1表达检测,2017年发布在《Clinical Cancer Research》杂志上的一项研究显示,SP263和22C3、28-8具有较好的一致性,在PD-L1肿瘤细胞膜染色不同阈值(1%、10%、25%和50%)的比较上,三种方法的总体一致率>90%。由国际肺癌研究协会(IASLC)发起的Blue Print 1和Blue Print 2研究显示出相似的结果。相比之下,SP142检测肿瘤细胞PD-L1表达需要更高的阈值,但在免疫细胞的检测上具有更好的敏感性,从最新的研究更新来看,SP142在需要或仅需要评估免疫细胞PD-L1表达水平的适应症上具有显著优势。值得注意的是,VENTANA PD-L1(SP263)可以同时检测细胞膜和细胞浆中的PD-L1表达,欧盟体外诊断医疗器械(CE IVD)认证批准可同时指导nivolumab、pembrolizumab和durvalumab治疗是目前国际上关联药物最多的检测。
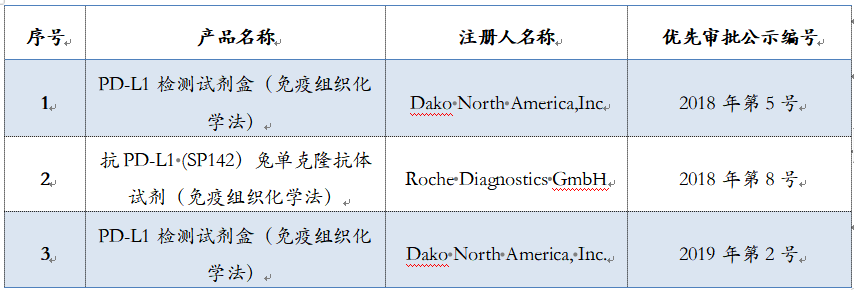
图1:非小细胞肺癌(NSCLC)组织HE染色 (20X) 及4种FDA/CE IVD认证获批PD-L1检测染色图示(20X). Hirsch, Fred R., et al. Journal of Thoracic Oncology12.2 (2017): 208-222.(图片取自肿瘤资讯) 2018年是中国免疫治疗的元年,截止目前,先后5款PD-1单抗类药物先后获批上市(默沙东、BMS、君实、信达、恒瑞医药),但5种PD-1/PD-L1抑制剂临床研究中应用的检测抗体均未在我国获得上市批准,这对于临床医生在制定治疗决策时,如何评估患者从PD-1/PD-L1单抗类药物治疗方案获益情况提出了挑战。目前,克隆号为SP263、SP142和22C3的抗体试剂在我国已进入注册申请过程,其中部分申报产品进入优先审查程序。
进入优先审评阶段的PD-L1检测试剂盒(整理:Medialliance) 医学进入精准医学时代,精准的诊断尤为重要
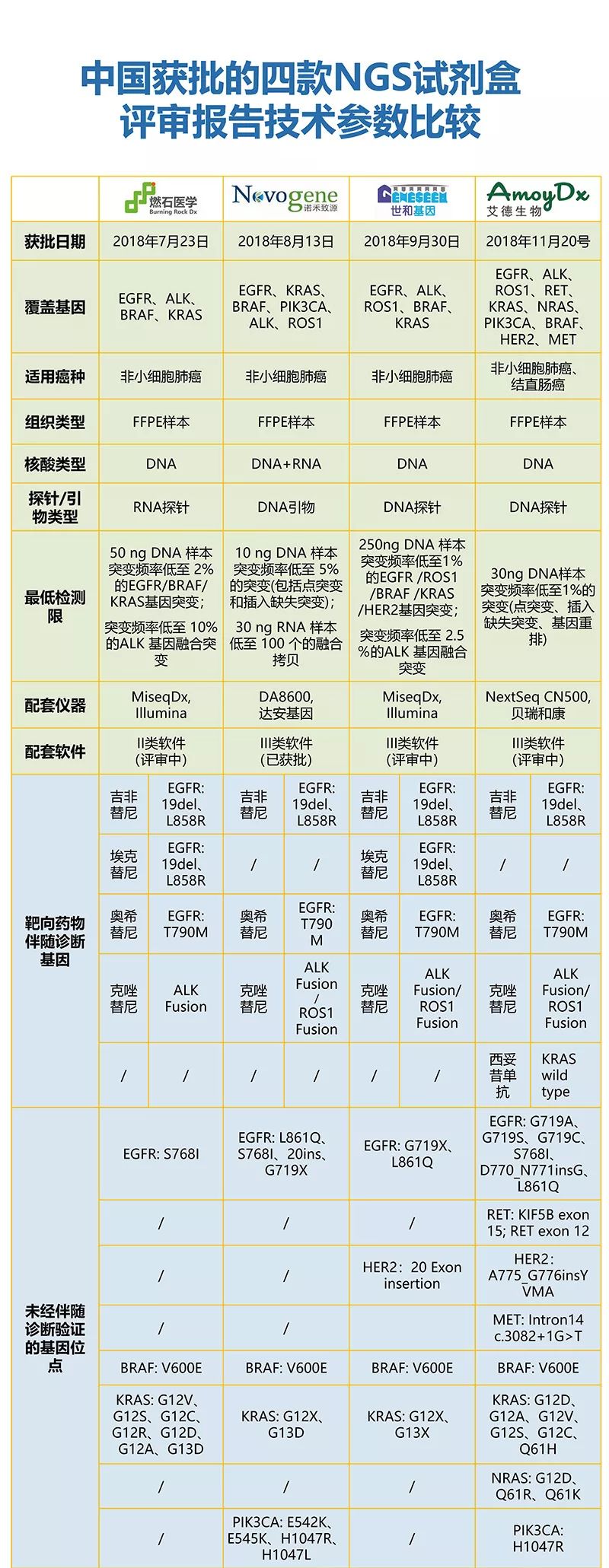
在过去的一年多,就有多款伴随诊断试剂盒获批,2018年下半年,我国肿瘤NGS检测领域喜讯连连。燃石医学、诺禾致源、世和基因以及艾德生物四家诊断公司开发的肿瘤NGS检测试剂盒,先后在不到五个月内获得我国监管部门批准。审批速度的提升在短时间内极大程度地丰富了肿瘤基因诊断产品的临床选择。
值得关注的是,四家公司的肿瘤NGS检测检测产品均拿到“创新医疗器械”这一加速条件,这无疑加速了这一类NGS产品的获批速度;此外,相较传统体外诊断产品,这四款NGS产品又均按照“伴随诊断”标准与已获批的伴随诊断试剂进行一致性比较以及所需伴随的药物有效性分析,进一步加强了这些产品在临床应用中的可靠性。可以说,NMPA这样的双重举措实现了“创新”与“安全有效”之间的平衡。
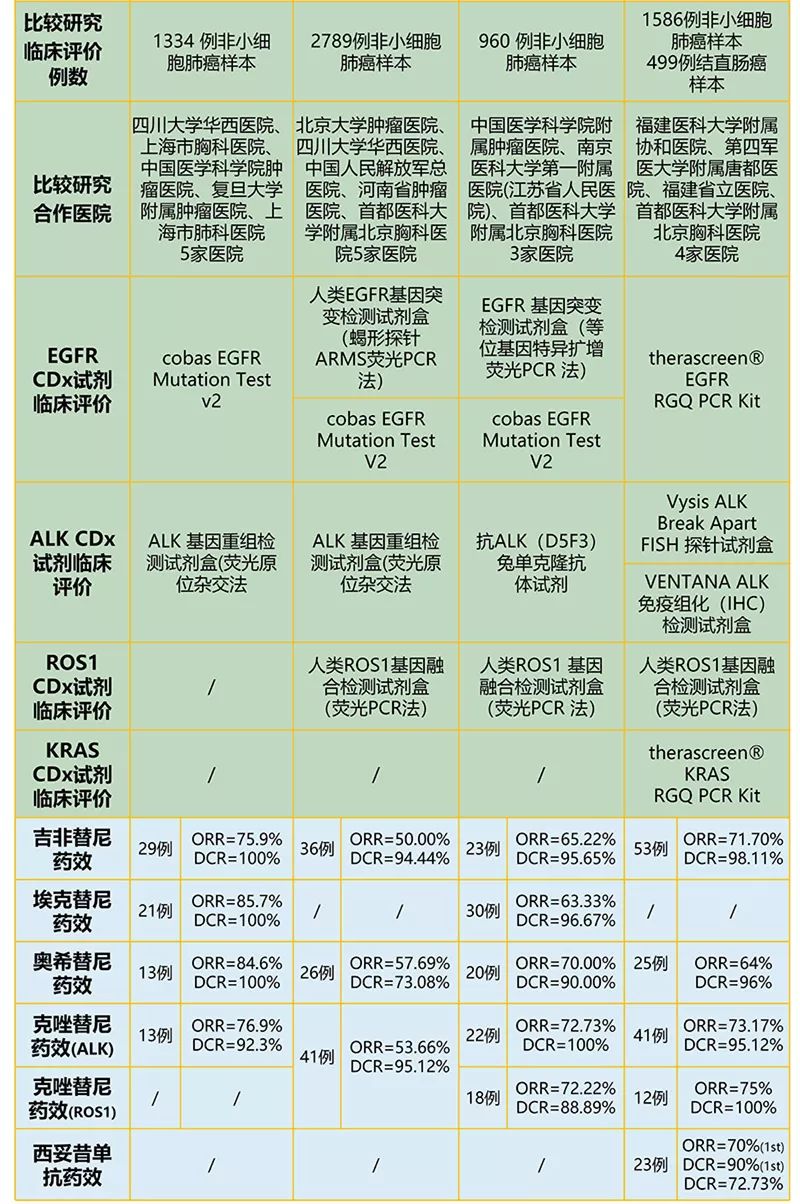
从上图中我们可以看出,四款肿瘤NGS检测产品都是同时申报多个基因、“One CDx,More Treatments”的开发模式,充分体现出NGS高通量的特点。这样高通量的基因检测可以较为全面地评估肿瘤患者可能的用药靶点,实现精准诊断、精准治疗。同时,相比于前三款产品较为一致地聚焦在非小细胞肺癌的基因诊断,第四款肿瘤NGS检测产品被获批用于非小细胞肺癌和结直肠癌的跨癌种检测,同时覆盖两个癌种中有诊断意义的基因,而且这两个癌种也是目前中国精准诊断最关注的两大癌种,这无疑是一次质的飞越。 四款产品在配套测序仪的选择上各有不同。燃石医学、世和基因的肿瘤NGS检测试剂盒都选择在Illumina MiSeqDx平台上进行注册,而且第一款肿瘤NGS Panel的获批也推动了MiSeqDx平台在中国的临床获批;诺禾致源的试剂盒选择在Life DA8600平台上注册,与其他三家的选择并不相同;艾德生物的试剂盒则是在Illumina NextSeq CN500平台上进行注册,这与其试剂盒的更大基因通量相匹配。这一测序仪目前在中国仅获批应用于NIPT领域,相信会在近期拓展至肿瘤基因临床诊断领域。 在检测基因位点对应的肿瘤靶向药物方面,四款产品均覆盖吉非替尼、奥希替尼、克唑替尼(ALK融合)的基因检测;燃石医学、世和基因的试剂盒又包括阿法替尼的基因检测;诺禾致源、世和基因、艾德生物的试剂盒又同时涵盖克唑替尼(ROS1融合)的基因检测。以上这些药物均获批用于非小细胞肺癌领域,仅有艾德生物的产品覆盖西妥昔单抗的基因检测,而这一药物则被应用于结直肠癌的临床治疗。 在试剂盒注册试验的样本数目方面,四款产品都经过了大量样本的性能验证和临床验证,性能验证方面少则960例,多则2789例,从中可以看出监管法规的严格以及注册过程中所需付出的艰辛。 通过四款NGS试剂盒的获批,我们可以看到中国NMPA对NGS技术在肿瘤诊断领域的临床应用有了更进一步的认可。 就在2019年8月29日,首个基于国产高通量测序仪的肿瘤基因检测试剂盒也获批
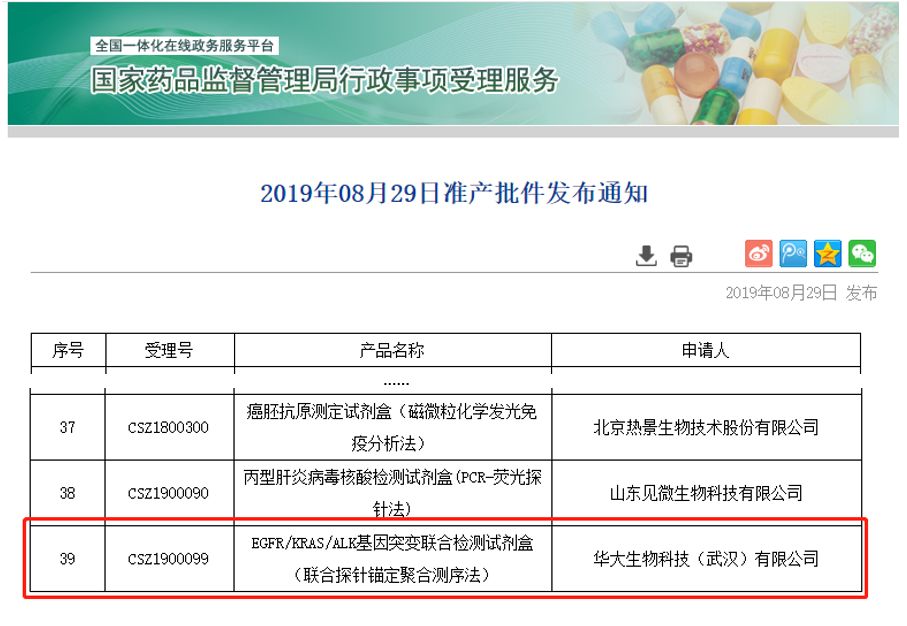
2019年8月29日,国家药品监督管理局官网公示,深圳华大基因股份有限公司(股票代码:300676)全资子公司华大生物科技(武汉)有限公司生产的 “EGFR/KRAS/ALK基因突变联合检测试剂盒(联合探针锚定聚合测序法)”,通过三类医疗器械产品的注册审批(注册证编号:国械注准20193400621)。 这是中国首个基于国产高通量测序仪的肿瘤基因检测试剂盒,或将打破进口测序仪在肿瘤基因检测试剂盒领域的垄断局面,意味着国产高通量测序仪以其核心技术和过硬质量在肿瘤临床领域实现重大突破。 该试剂盒用于定性检测非小细胞肺癌患者FFPE组织样本中EGFR/KRAS/ALK基因上发生的变异,可用于吉非替尼、盐酸埃克替尼、克唑替尼药物的非小细胞肺癌适应症的伴随诊断检测。 该试剂盒可配套使用的三款高通量测序仪:MGISEQ-2000、MGISEQ-200、BGISEQ-500,均已获得医疗器械注册证。三款测序仪具有不同大小通量和运行时间,用户可根据自身情况灵活选择。检测流程可搭载自动化建库系统、自动化分析平台以及“华大时珍”肿瘤数据库,实现从样本到报告的全自动流程,尤其适合医院自主使用,无需依赖专业技术人员。值得一提的是,这也是国内首个配备多测序平台的肿瘤高通量基因检测试剂盒,相比国外仪器,具有更高的灵活性,更能满足国内用户的多样化需求。 肺癌多基因检测试剂盒的上市,表明在肿瘤临床基因检测领域,国产高通量测序仪已完全具备和进口测序仪相当的竞争力。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |