做个数字 PCR 实验不用那么折腾吧,都是有套路的好不好 |
您所在的位置:网站首页 › pcr退火温度过高过低 › 做个数字 PCR 实验不用那么折腾吧,都是有套路的好不好 |
做个数字 PCR 实验不用那么折腾吧,都是有套路的好不好
|
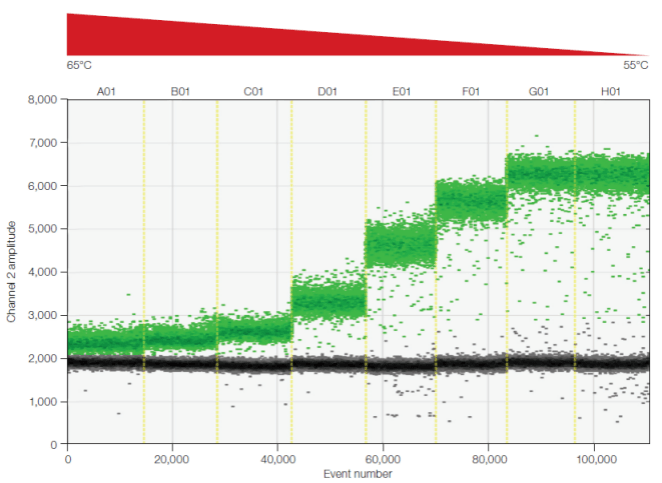
图 1. Bio-Rad 全系列 PCR 热循环仪的温度梯度模块和温度梯度分布 特别是新设计的 ddPCR 检测体系应该运行一次温度梯度实验(围绕引物 Tm 值上下设置待测试的温度范围),以找到一个理想的退火 / 延伸温度,使得阴阳性微滴的荧光强度差异最大化,弱化「下雨」(主要落在阳性和阴性微滴群之间的微滴)现象,同时避免非特异性扩增发生。 图 2 所示为退火温度优化实验,展示了 ddPCR 重复反应在温度梯度上的阴阳性微滴分离情况。对于基于探针的双重 ddPCR 反应来说,一次温度梯度实验可以用来确定对两个反应均表现良好的温度条件,而基于 EvaGreen 核酸嵌入式染料的 ddPCR 体系,也需要使用温度梯度筛选最适退火温度。
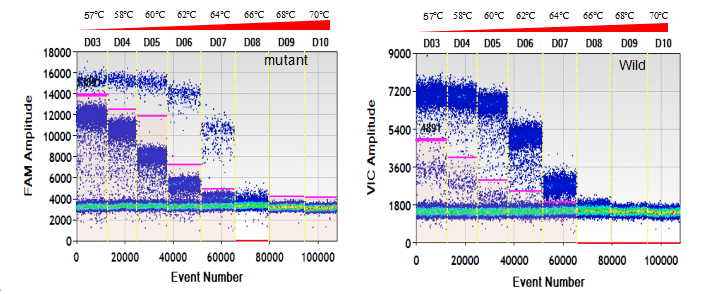
图 2.温度梯度优化 ddPCR 退火温度,不同退火温度下阳性微滴和阴性微滴有不同的区分程度 对于某些难度更大的稀有突变检测实验中,由于野生型背景的干扰以及引物探针设计困难,很可能出现非特异性扩增。这时 ddPCR 体系的退火温度不仅要确保阳性微滴和阴性微滴的区分,还要确保仅发生非特异性的微滴与特异性扩增的微滴明确分开。 图 3 演示了非特异性欠佳的引物探针在 ddPCR 上的表现。在不同的退火温度下(57 ℃~70 ℃),阳性微滴呈现不同的分层。每个温度下: 荧光强度最高的是含特异性扩增的阳性微滴簇; 荧光强度最低的是未发生 PCR 扩增的阴性微滴; 荧光强度居中的是仅发生非特异性扩增的假阳性微滴。 不同的退火温度使三种类型微滴有不同的区分程度,选择能将假阳性微滴与阳性微滴明确分开温度作为该 ddPCR 体系的退火温度。
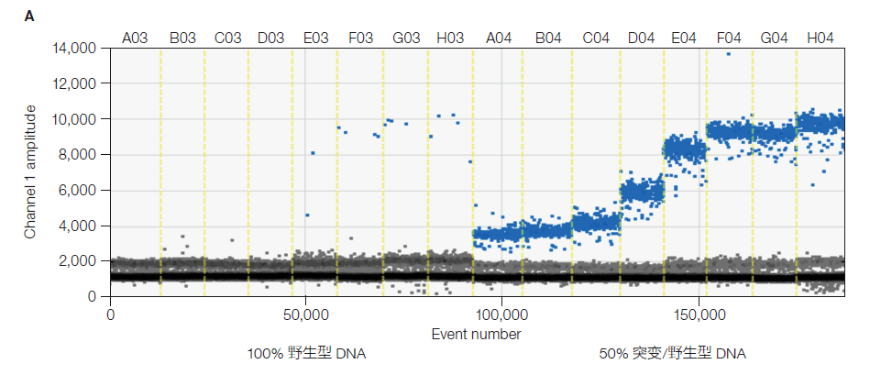
图 3. 温度梯度帮助克服 JAK2 V617F 引物探针非特异性扩增的影响。不同退火温度下,特异性扩增微滴和仅发生非特异性扩增的微滴有不同的区分效果。 为了获得稀有突变检测体系特异性更可靠的测试结果,需要在较高浓度野生型 DNA 背景下加入突变型 DNA 的温度梯度实验以及纯合野生型 DNA 温度梯度来验证。 例如,酶切过的浓度在 2,000~5,000 copies/μL 的 100% 纯合野生型 DNA 模板和浓度为 2,000~5,000 copies/μL 野生型 DNA 模板,混入浓度为 50~200 copies/μL 突变型 DNA 的混合模板,进行温度梯度测试。使用 1-D 荧光散点图选择无假阳性、阳性阴性微滴群分离良好、探针交叉反应最轻微的退火温度(图 4)。此外,必须同时检查定量结果,以确保所选退火温度下测得的拷贝数浓度是否符合预期结果。
图 4.PI3Kca_E545K ddPCR 突变检测体系的温度梯度测试效果。A03-H03 均为 100% 纯合野生型模板;A04-H04 均为含有突变型/野生型各 50% 的混合模板。在不同退火温度下,阳性微滴和阴性微滴的区分度,假阳性微滴数量有不同的表现。选择 D03 和 D04 对应的温度为本例的最适退火温度。 由此可见, 在没有温度梯度功能加持的情况下,相同的数字 PCR 体系优化和构建可能需要经过十数次重复实验来测试不同退火温度条件下的实验效果。此外也需要指出,并非所有的数字 PCR 技术都能通过温度梯度的方式优化检测体系,目前仅兼容标准 PCR 热循环仪的数字 PCR 平台才能使用温度梯度热循环程序, 如 Bio-Rad, QX200 ddPCR 系统、AutoDG QX200 ddPCR 系统和 QX ONE ddPCR 系统。
总 结 温度梯度功能是快速优化、构建数字 PCR 反应体系的利器,能大大减少体系优化阶段数字 PCR试剂耗材的额外消耗,缩短工作时间,快速取得理想的实验结果。对于如何从微滴式数字 PCR 温度梯度实验中选择最适退火温度,可把握以下原则: 1. 阴阳性微滴的荧光强度差异最大化; 2. 尽量避免非特异性扩增,如不能避免,需确保阳性微滴和假阳性微滴明确分开; 3. 确保最适退火温度下的定量结果与预期相符。 * BIO-RAD 是 BIO-RAD LABORATORIES, INC. 在特定区域的商标。 * 本产品仅用于科研用途,不用于临床诊断。 内容策划:刘果 内容审核:周育红 题图来源:站酷海洛 参考文献: [1]. Optimization of Annealing Temperature To Reduce Bias Caused by a Primer Mismatch in Multitemplate PCR[J]. Applied and Environmental Microbiology, 2001, 67(8). [2]. Optimization and troubleshooting in PCR.[J]. Cold Spring Harbor Protocols, 2009. [3]. Bustin S A , Vladimir B , Garson J A , et al. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments[J]. Clinical Chemistry, 2009(4):611.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |