融合 PCR 实验 |
您所在的位置:网站首页 › pcr技术要引物的原因 › 融合 PCR 实验 |
融合 PCR 实验
|
1、同源互补区域的长度 由于融合 PCR 主要是利用两个片段 3' 端的互补序列进行融合,所以待融合的片段越长,完整的融合产物的量越少。有时扩增产物在凝胶电泳中难以检测。但将待融合的两个片段之间的同源互补区延长是增加融合物产量的一个好办法。如图 10-12 中操作流程(b)所示容易获得高产量,而操作流程(a)得到的产物量少卬七范宝昌等为了获得登革 2 型病毒的全长 cDNA 分子,将 5' 半分子和 3' 半分子的互补序列长度增加到 1.6 kb,保证了半分子退火后的正确匹配和中间体的稳定 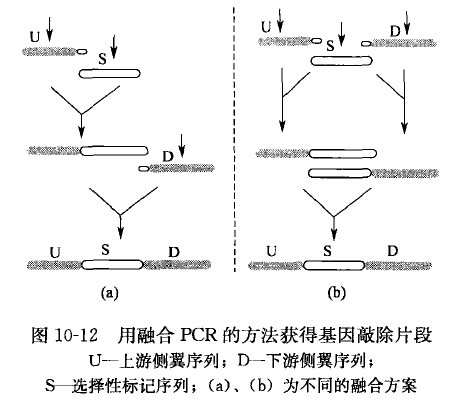
2、DNA 聚合酶的性能 融合 PCR 结果有时不理想,也与采用的 DNA 聚合酶的性能有关。在绝大多数情况下,推荐使用高保真的 DNA 聚合酶,以最大限度减少突变的产生。但保真性能好,扩增能力就有一定的局限,比如范宝昌等为了保证 11 kb 融合产物的获得,采用的是具有较好扩增能力,但保真度略低于 Pfu 的高保真 PCR 系统(B.M. 公司)。Wang 等的实验结果证明,如果高保真的 DNA 聚合酶的融合扩增效果不好,可以尝试利用普通 Taq 酶和高保真的 DNA 聚合酶混合使用。因为有的高保真 DNA 聚合酶对从琼脂糖凝胶和电泳缓冲液来源的模板比较敏感,不易获得好的扩增效果。 3、PCR 引物的设计和 PCR 反应条件 Oakley 实验室在进行如图 10-13 的融合 PCR 时,发现引物 P2 和 P5 距各自融合端衔接头的最佳距离为 1 000 bp 左右,至于 P2、P5 以及待融合片段的重叠区域的长度都仅有 18~21 bp。另外,他们为了保证在不同的 PCR 仪器上做出相同的 PCR 结果,他们规定了如下精细的 PCR 条件: ① 94 ℃,2 min; ② 10 个循环:94 ℃ 20 s,70 ℃ 1 s,以 0.1 ℃/s 的速度降到 55 ℃,55 ℃ 30 s,以 0.2 ℃/s 升温 到 68 ℃ ,68 ℃ 5 min; ③ 5 个循环:94 ℃ 20 s,70 ℃ Is,以 0.1 ℃/s 的速度降到 55 ℃, 55 ℃ 30 s,以 0. 2 ℃/s 升温到 68 ℃,68 ℃ 5 min(以后每个循环加 5 s,最后一个循环延伸时间为 5 min 20 s); ④ 10 个循环:94 ℃ 20 s,70 ℃ 1 s,以 0.1 ℃/s 的速度降到 55 ℃,55 ℃ 30 s,以 0.2 ℃/s 升温 到 68 ℃,68 ℃ 5 min 20 s(以后每个循环加 20 s,最后一个循环延伸时间为 9 min 20 s); 在步骤 ③ 和 ④ 中,延伸时间的延长是考虑到 Taq 酶的活力在逐步减弱。经过他们的严格而精细的 PCR 程序设定,得到了单一而高浓度的特异性产物。  4. 引物比例
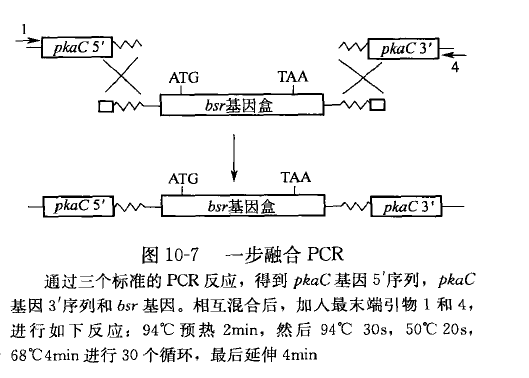
实验操作中也发现,不同引物的比例也影响融合 PCR 结果。在一步融合 PCR 反应中,(原理同图 10-7 所示),Karremann 在同一个反应管中添加了所有的三种引物和需要的模板,利用一个 PCR 反应来获得融合产物。他发现,引物 1 的量对融合 PCR 的结果关系密切。当引物引物 2:引物 3 的比例为时,中间产物的积累效果明显,而融合产物的量少;当引物量之比为时,融合产物的量占到绝大多数;当进一步增大引物 1 与引物 2 和 3 的比例时(1:100:100、1:1 000:1 000. 1:10 000:10 000),融合 PCR 效果变得很差,几乎检测不到融 台产物。因此,引物 1:引物 2:引物 3 的比例应保持在合适的水平。
4. 引物比例
实验操作中也发现,不同引物的比例也影响融合 PCR 结果。在一步融合 PCR 反应中,(原理同图 10-7 所示),Karremann 在同一个反应管中添加了所有的三种引物和需要的模板,利用一个 PCR 反应来获得融合产物。他发现,引物 1 的量对融合 PCR 的结果关系密切。当引物引物 2:引物 3 的比例为时,中间产物的积累效果明显,而融合产物的量少;当引物量之比为时,融合产物的量占到绝大多数;当进一步增大引物 1 与引物 2 和 3 的比例时(1:100:100、1:1 000:1 000. 1:10 000:10 000),融合 PCR 效果变得很差,几乎检测不到融 台产物。因此,引物 1:引物 2:引物 3 的比例应保持在合适的水平。
|
【本文地址】
今日新闻 |
推荐新闻 |