【学术前沿】Cell Discovery |
您所在的位置:网站首页 › p300蛋白 › 【学术前沿】Cell Discovery |
【学术前沿】Cell Discovery
|
PROTAC 技术是近年来蓬勃发展的新兴蛋白质降解策略。PROTAC 的基本原理是使用双功能小分子,通过泛素-蛋白酶体系统诱导靶蛋白的泛素化,进而实现靶蛋白降解。自2019年第一个靶向雄激素受体 PROTAC 分子 ARV-110 进入临床研究以来,PROTAC 领域进入快速发展期。 液液相分离(LLPS)是生物大分子在真核细胞中聚集形成无膜细胞器的基础,也是细胞区域化的重要机制,展现了真核细胞对各种生理活动的精准、动态的时空调控。当前,如何建立相分离现象和生物学功能之间的关系是该领域内的重要科学问题。相分离对系统计量高度依赖,各组分形成分相的临界浓度尤为关键,因此需要高效、快速、动态的扰动技术的支持。此外,如何避免体外实验中出现假阳性的可能、探究生理条件下的相分离状态、剖析分相液滴中支架蛋白与乘客蛋白身份和功能的转换及其内在分子机制等问题都迫切需要新技术和新方法的建立。 现有技术手段如 CRISPR-Cas9 基因编辑、RNA 干扰(RNAi)等遗传学工具在体内直接研究相分离面临很多挑战。基因编辑技术对 DNA 修改具有不可逆的特点,难以获得编码蛋白质的中间状态。RNAi 技术由于起效时间长,在体内快速动态的相变化过程中,RNAi 不足以作为一个强有力的研究工具。小分子抑制剂虽然能够影响相分离的形成,但其多作用于底物结合位点,而相分离常由蛋白质其他的如骨架功能诱导,会导致研究不够充分,同时小分子抑制剂发挥其功能往往会导致目标蛋白上调反馈,需要更高的作用剂量。相分离领域仍然缺乏在野生型细胞系上直接干扰 LLPS 的高效方法。 近日,清华大学药学院饶燏团队、清华大学医学院李海涛团队与清华大学生命学院李丕龙团队合作,在 Cell Discovery 期刊发表了题为“BRD4-targeting PROTAC as a unique tool to study biomolecular condensates”的研究论文。研究团队利用 PROTAC 高效、快速、可逆、动态降解靶蛋白的特性,通过降解 BRD4 探究其相关生物大分子凝聚物形成特征,联用免疫荧光染色和高通量测序对 PROTAC 诱导的靶蛋白分相形态和功能的改变进行监测,揭示该过程中 BRD4 与其他组分凝聚物的功能伴随,这是 PROTAC 在 LLPS 研究中的首次运用,为解决领域内关键问题提供了新方法和新见解。  首先,通过 PROTAC、免疫荧光染色、定量计算等技术的联用,研究者们建立了靶向细胞内 BRD4 凝聚物的“PROTAC-target protein-LLPS”研究方法。研究者们使用100 nM 的 ZXH-3-26 在 HeLa 细胞中测定内源的 BRD4 降解动力学。他们发现,靶向 BRD4 的 PROTAC 分子(ZXH-3-26)能够在低浓度、短时间内快速降解 BRD4 及其凝聚物(图1)。BRD4-PROTACs 处理细胞30分钟后即可观察到 BRD4 蛋白水平显著降低,4小时后 BRD4 蛋白完全降解,同时 BRD4 凝聚物数量也急剧减少。这说明 PROTAC 能够作为一个快速扰动凝聚物组分的工具。 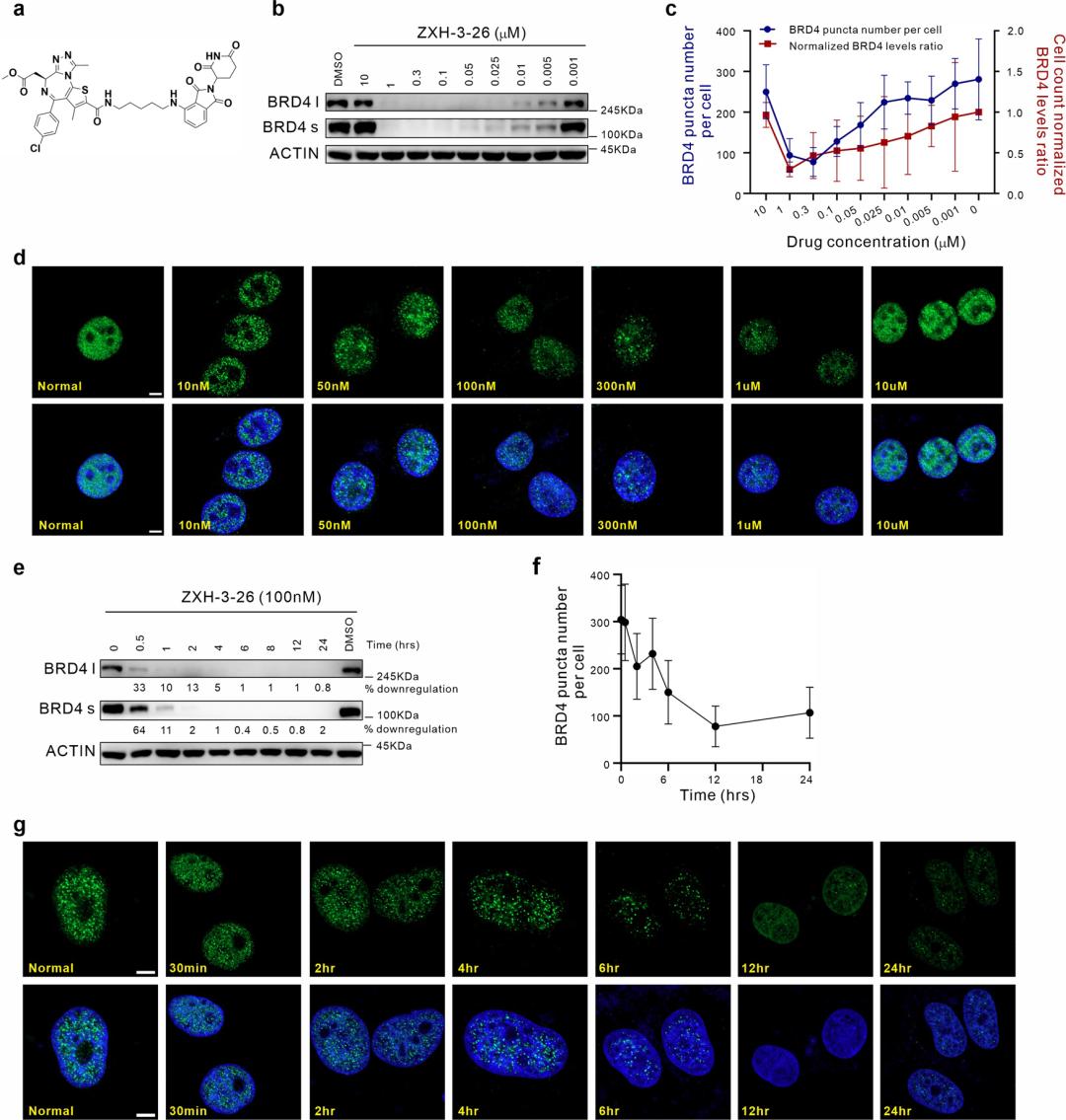 图1. “PROTAC-target protein-LLPS”研究方法的建立 随后,研究者们利用 PROTAC 的可逆性进一步探究该技术运用于 LLPS 研究的潜力。有趣的是,他们通过 Wash-out 实验发现,去除 BRD4-PROTACs 后24 小时,内源的 BRD4 凝聚物数量已几乎恢复到原始水平,而此时 BRD4的 蛋白水平才刚刚开始出现恢复迹象(图2)。即 BRD4 相关凝聚物的恢复可能优先于 BRD4 蛋白水平的恢复,这是 PROTAC 应用于 LLPS 研究首次发现的现象。 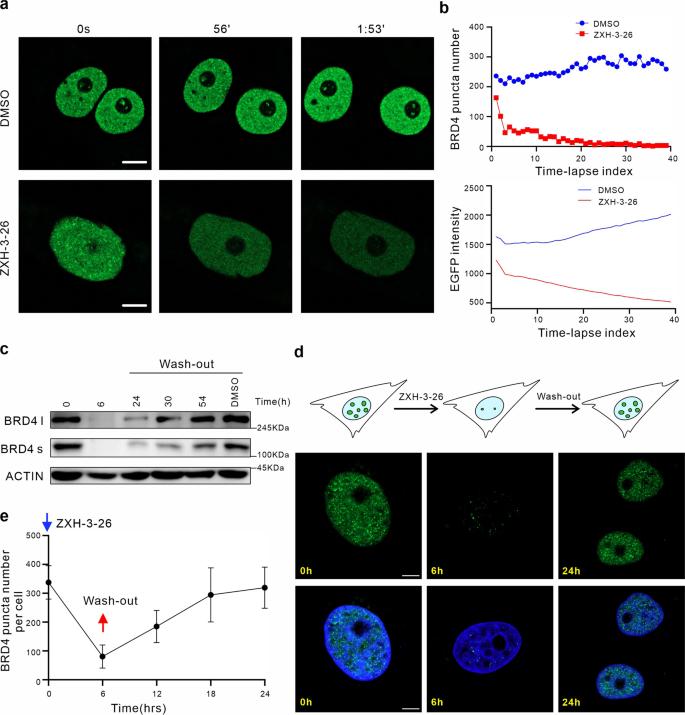 图2. BRD4-PROTACs 的可逆性助力 LLPS 研究 针对以上有趣的现象,研究者们进一步开展多组学分析阐释其可能的生理功能意义。通过 RNA-seq 和 Cut&Tag-seq 探讨对照组、BRD4-PROTACs 处理后6小时、wash-out 18小时、wash-out 42小时的基因表达谱,以及 BRD4 在 TSS 区、enhancer 区和 super-enhancer 区的定位变化。数据显示, wash-out 42小时组的基因表达情况已经恢复到与对照组接近。更令人意外的是,随着降解剂的去除,BRD4在短时间内迅速恢复并更偏好占据在 super-enhancer 区,尤其是一些关键癌基因和细胞周期基因的 super-enhancer 区 (图3)。这一结果说明 PROTAC 可以成为研究生物大分子凝聚物的生理病理功能的一种强有力工具,它的降解快速且可逆是其作为 LLPS 研究工具的关键优势。 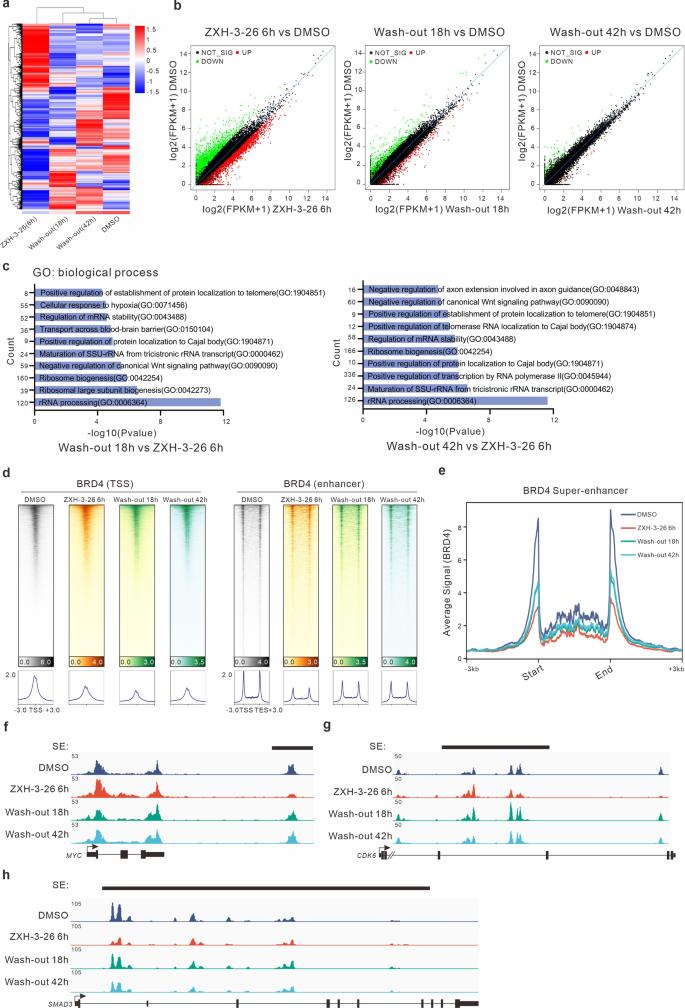 图3. BRD4-PROTAC 降解及 Wash-out 实验引起细胞基因组和染色质状态变化 生物大分子凝聚物中各组分的多价态相互作用是 LLPS 的基础,剖析其中关键组分蛋白之间的物理及功能交互是 LLPS 领域内的关键问题。于是研究者们基于 BRD4-PROTACs 探讨 BRD4 相关凝聚物中其他重要组分(MED1/CYCT1/p300)的分相变化。研究者发现,在 BRD4-PROTACs 的作用下,内源的 MED1 和 CYCT1 凝聚物在6小时内显著减少,12 小时又恢复到与对照组几近相同的水平。而 p300 作为 BRD4 的上游分子,其凝聚物不受干扰(图4)。另外,他们首次发现随着 BRD4 降解,BRD3 在 MED1 和 CYCT1 凝聚物的恢复过程中发挥了代偿功能。靶向 BRD4 的 PROTACs 不仅为研究 BRD4 相分离提供了一种新的有效工具,而且为剖析 BRD4 相分离的分子机制和动力学提供了一种新的策略。 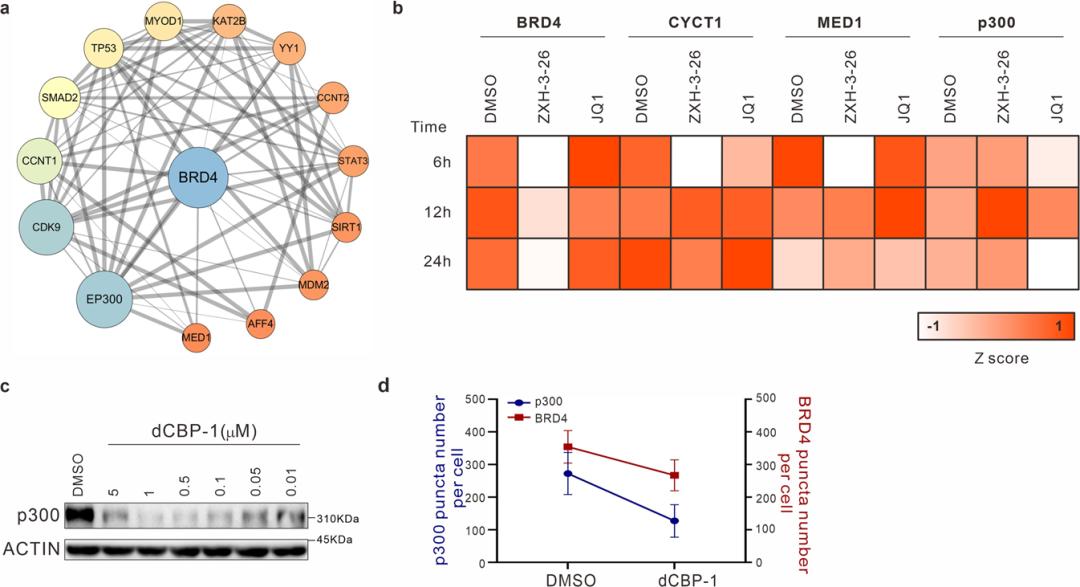 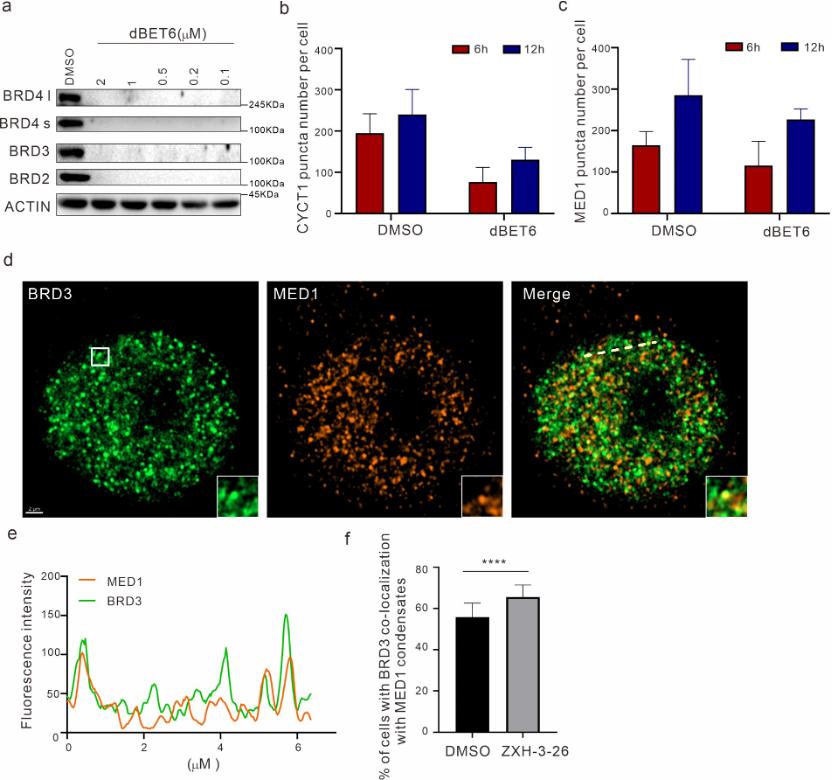 图4. 通过 BRD4-PROTACs 探究 MED1/CYCT1/p300/BRD3 在 BRD4 相分离中的关键功能 综上所述,在该工作中,研究者首次建立了“PROTAC-target protein-LLPS”的研究方法,以期从多维度探究 LLPS 相关的内源蛋白-蛋白相互作用、蛋白时空动态调控的精密机制。在 LLPS 研究中,基于 PROTAC 的研究方法快速、高效、可逆,优于传统遗传学工具对靶基因的扰动;同时,相较于常用解聚凝聚体的小分子(如1,6-己二醇),PROTAC 也更具有特异性和靶向性。另外,将此方法与多组学手段联合分析,不仅能够探究凝聚物中各组分之间的互作和功能伴随,而且将为相分离与生物功能之间建立因果关系提供可能。值得一提的是,PROTAC 技术被誉为助力小分子药物开发进入“新黄金时代”的技术, PROTAC 有望在相分离异常导致的疾病治疗中发挥其重要作用。 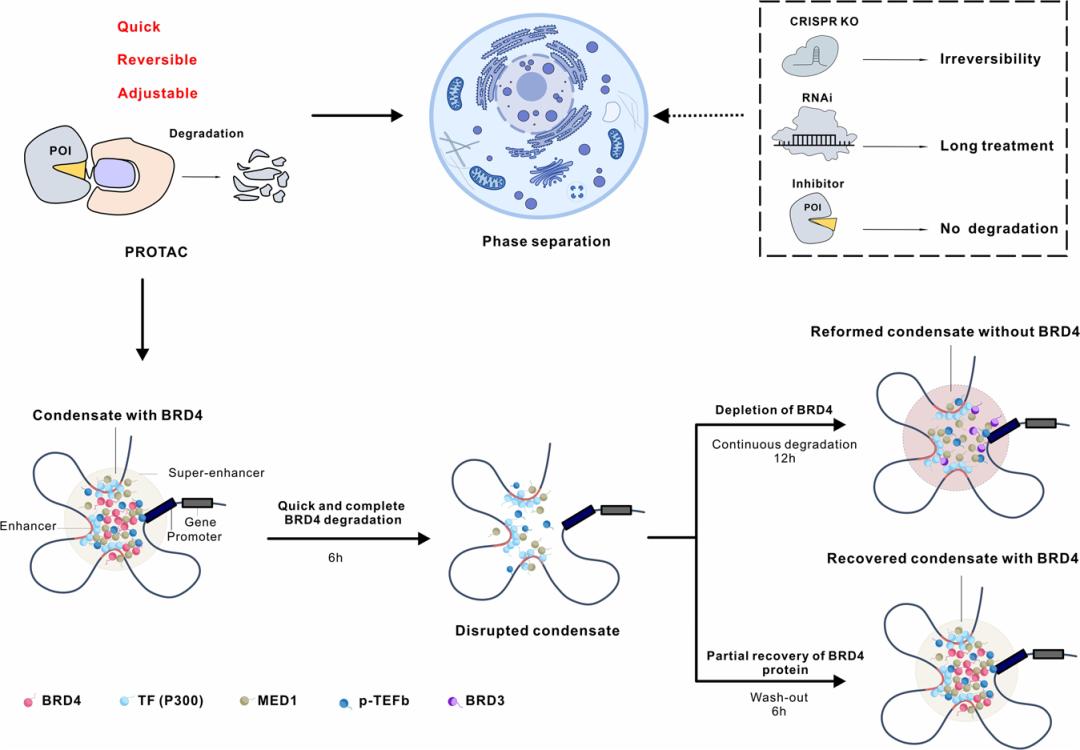 图5. BRD4-PROTACs 工作模型示意图 饶燏团队长期从事蛋白质靶向降解技术的开发工作,致力于发展新型降解技术及其应用,已取得了系列研究成果:提出了 PROTAC 和分子胶协同应用的模式。首次设计合成了新型双靶、双机制的降解剂,为靶向降解技术的发展提出了新的思路(Cell Research 2021);实现难成药靶点的药物开发,设计合成全球首例选择性 CDK2 降解剂,实现 AML 高效且低毒的分化治疗(Nature Chemical Biology 2021);构建高效的 BTK 降解剂,解决临床中出现的Ibrutinib耐药问题(Cell Research 2018;Leukemia 2019);构建 PROTACs 系统性敲除模型,快速可逆实现动物体内蛋白敲除(Cell Discovery 2019);构建新型 CDK4/6 降解剂,有效抑制肿瘤增殖(Journal of Medicinal Chemistry 2019);此次研究也是该团队拓展新型靶向蛋白降解技术与生物学新兴前沿-相分离领域的交叉探索。 清华大学药学院饶燏课题组2020级博士生施奕(CLS 项目)、清华大学医学院李海涛课题组2020级博士生廖源(PTN 项目)为该论文共同第一作者,清华大学药学院博士生刘乾隆,博士生倪智豪以及医学院博士生张真真参与了该工作,清华大学李丕龙教授、李海涛教授和饶燏教授为论文共同通讯作者。清华大学医学院师明磊研究员为本论文提供了宝贵建议和指导。该研究得到了清华大学吴畏教授、邓海腾教授和曾坚阳教授的帮助,并得到了清华大学细胞影像中心以及尼康影像中心的技术支持。该研究得到了中国国家自然科学基金和国家重点研发计划的大力支持。 论文链接 https://www.nature.com/articles/s41421-023-00544-0 原标题:《【学术前沿】Cell Discovery | 清华大学饶燏/李海涛/李丕龙团队首次将PROTAC技术应用于相分离研究》 阅读原文 |
【本文地址】
今日新闻 |
推荐新闻 |