一针见「耗子尾汁」:手把手教会你「小鼠尾静脉注射」操作技巧! |
您所在的位置:网站首页 › ori操作技巧 › 一针见「耗子尾汁」:手把手教会你「小鼠尾静脉注射」操作技巧! |
一针见「耗子尾汁」:手把手教会你「小鼠尾静脉注射」操作技巧!
|
图1 不止是静脉的选择,鼠尾穿刺位置的选择也同样重要。穿刺位置的血管首先要足够粗,在此基础上,位置越浅,越容易穿刺成功,这点后续还会讲到。 从图1(左)中可以看到,近端的血管位置较深,远端的血管位置较浅,但血管的管腔内径并没有随着鼠尾的变细而成比例的变细。在鼠尾远端,血管仍保持较粗的管腔内径。这就为定位一个理想的穿刺点提供了可能。 因此,我们一般首选离鼠尾远端约1/3的位置的侧面静脉进行穿刺。 选择合适的注射器 小鼠尾静脉的结构,导致我们对注射器提出了更高的要求。 我们需要选择针头足够细又有一定长度的注射器。那么,到哪里去找到合适的注射器呢? 注射器针头粗细规格表示方法为数字+Gauge(G)。数字越大,代表针头越细。 用于小鼠尾静脉的针头规格,最好在29G以上。目前,市面上容易买到的29G以上的注射器,主要是胰岛素注射器。其规格有29G,30G和32G。参数如表1。 但是32G的注射器针头长度太短,只有4 mm,并不方便操作,因此选择针头长度为8 mm和13 mm的30G和29G胰岛素注射器,是最为合适的。 表1
数据来源: https://www.sigmaaldrich.com/china-mainland/chemistry/stockroom-reagents/learning-center/technical-library/needle-gauge-chart.html 牢牢固定小鼠 在注射过程中,小鼠尾部若发生轻微摆动,都可能会造成注射的失败,因此, 小鼠的固定对尾静脉的成功注射至关重要。 在尾静脉注射中固定小鼠的方法五花八门,有粗暴纯手压、把小鼠装在50 ml离心管或烧杯里,以及各种自制的固定设备等等。 我在这里推荐使用准们的李氏鼠管固定小鼠(图3)。李氏鼠管固定效果好、使用简便,并且适配后文提到的小鼠尾静脉注射专用仪器。
图3 如图(3)所示,提着小鼠的尾巴,从李氏鼠管的(1)端拉入管内,再用滑块(2)塞住小鼠,注意不要挤压的太厉害造成小鼠脊柱骨折。拧紧旋钮固定滑块的位置。这样,整个小鼠就被牢牢固定在鼠管内,只有尾巴伸出管外(3)。 鼠尾血管扩张 小鼠尾静脉本身就难以观察,在小鼠紧张、衰弱、麻醉或外界气温较低的情况下,血管收缩,就更看不到了。收缩状态的尾静脉,甚至比针头还要细。 所以,要想提高注射的成功率,在尾静脉注射前让鼠尾血管尽可能的扩张,是至关重要的,除非鼠尾本身血管状态很好,否则千万不要嫌麻烦省略这一步。 扩张鼠尾血管,一般是通过加温的方式。我比较推荐热水浸泡鼠尾的方式加温。稍加浸泡后,鼠尾血管便会得到明显扩张,从而大大降低穿刺的难度。 鼠尾静脉血管的清晰显像 在我们定位了理想穿刺点,选择了合适的注射器,将小鼠牢牢固定,并通过热水浸泡让鼠尾血管得到了充分的扩张以后,已经解决了尾静脉注射的诸多困难。 但此时,我们还面临着一个关键问题,那就是如何清晰的看到穿刺点的尾静脉,并判断穿刺成功。 由于尾静脉十分纤细,不仅摸不到,也很难感受到针刺入血管的「落空感」,并且,如果注射的药物是深色的,也没法看到回血。因此,以上人静脉抽血的技巧都不适用了。 所以,还是需要通过清晰的显示尾静脉,直接用眼睛观察来穿刺并判断是否成功刺入鼠尾静脉血管。如何清晰的显示尾静脉呢?用热水扩张血管是可以帮助显示尾静脉,但还远远不够。 最好的方式是用灯光使血管清晰显像。 所以,一个人可以用微型手电筒或LED小夜灯等紧贴尾静脉,在灯光的照射下,尾静脉会被很清晰的显示,此时,另一个人便进行注射操作。但该操作不易实现,需要多加练习,培养默契。 鼠尾静脉的穿刺推注操作 按照要求完成上述准备工作后,恭喜你,尾静脉注射已经成功了一半。接下来,我们就要开始正式进行尾静脉注射操作了。 不过,在这之前我还是要推荐一个神器给大家,那就是小鼠尾静脉注射专用仪器。小鼠尾静脉注射专用仪器通过鼠管、黄灯、滑尺等元件,将上述讲到的大部分尾静脉注射问题给出了一个集成式的解决方案(图4)。 我本人也在一直使用(某宝上和丁香通都有出售,见图5),亲测确实非常好用。有了此神器的加成,操作成功率会进一步大大提高,整个流程也会变得更方便、更高效。 因此,下面我也就以小鼠尾静脉注射专用仪器为例来讲解如何进行正确标准的注射操作。当然,该仪器价格不菲,不过经费有限的小伙伴也不用担心,无论是否使用这个仪器,下面讲解的操作要点都是共通的。 我们完全可以通过多做练习,用「纯手工的方式」来同样达到令人满意的成功率。
图4
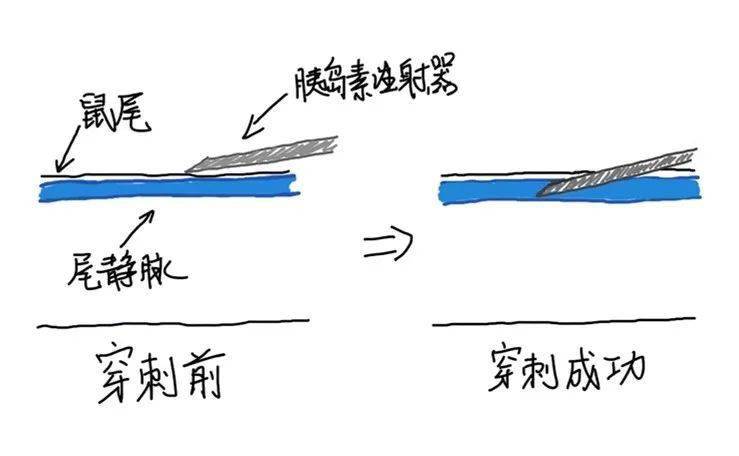
图5 注射主要分为两个步骤,首先是穿刺,然后是推注。 在穿刺和推注的那一瞬间,要保持高度专注,抱着『不成功,便成仁』的心态,深吸一口气,稳住手不要抖。 我们先说穿刺,首先,要确认排空了注射器里的气泡,否则有可能造成小鼠空气栓塞而死亡。随后,将鼠管安装在注射操作台上,打开黄灯(图4(1))。 接下来,前后调整滑尺,使黄灯照射在理想穿刺点所对应的鼠尾位置(图4(2,3))。一般首先以侧卧位摆放小鼠,找侧部尾静脉,如果侧部尾静脉不好,再找背侧尾静脉。 如图所示,在黄灯的照射下,已经可以清晰的看到尾静脉。找到穿刺点后,拧紧滑尺的旋钮固定黄灯的位置(图4(4))。使用酒精(一般用棉签或棉片)消毒,并压下「压脉夹」,使血管进一步充血扩张(图4(5))。 然后,一只手捏住鼠尾尖端,牢牢控制住鼠尾,使其不在整个注射过程中因小鼠挣扎而摆动。另一只手握住胰岛素注射器,使针尖的针眼朝上。整个针贴着尾部,沿着尾静脉的走向,平行缓慢进针,一般进针在1 mm左右时,便可刺入尾静脉(图6)。 因为尾静脉很细,又紧贴皮下,此时可能有落空感,也可能没有,但一般会有回血发生。但是在黄灯的穿透下,由于尾静脉清晰显影,所以我们用肉眼可以较好的判断是否成功刺入。
图6 判断穿刺成功后,保持稳定,用仪器配备的脚踏弹开压脉夹解除对血管的压迫,便可推注注射器里的内容物。先轻轻推注,如果感到很顺畅,说明穿刺成功。 接下来便可加速推注。如果内容物体积不多,小于100μL,可以快速推注,避免小鼠挣扎脱针。但较大体积的内容物,还是要适当控制流速,不可过快。 推注完毕后,等待几秒钟再抽针,快速抽针,然后立即止血。可以使用专用仪器配备的止血夹,也可采取其他的止血方式。止血非常重要,否则可能导致注射的药物随着血液一起流到体外而造成损失。 如果轻轻推注的时候感到有阻力,有可能是小鼠血压较高的原因,可先稍稍加大力度推注。但如果仍有阻力,则说明穿刺失败,可能未刺入血管,也可能将血管刺穿,内容物注射进了鼠尾组织。 此时,不应硬推,否则会导致鼠尾组织肿胀或染色,看不见血管,严重会导致该小鼠尾静脉永远无法穿刺,彻底「废掉」。正确的做法是快速抽针止血,待尾静脉有所恢复后,再尝试穿刺操作。 总结 「天下无难事,只要(pai)有师(xin)姐(ren)」。 通过以上讲解,抓住小鼠尾静脉注射的难点: 一是血管十分纤细,二是不易直接观察,三是不知如何定位穿刺点。 我们对症下药,逐个击破。我们通过热水浸泡让静脉血管扩张、使用压脉夹使血管充盈、选择针尖更细的注射器,并用灯光使尾静脉清晰显像,然后在理解鼠尾解剖结构的基础上,找到血管位置浅又足够粗的理想穿刺点。 怎么样,是不是特别「讲武德」。 希望这篇文章能够帮助你解决小鼠尾静脉注射这个「实验黑洞」,让你一针见「耗子尾汁」,实验顺利,牛年大吉! 文章图片来源:作者提供 主要参考资料: Staszyk C , Bohnet W , Gasse H , et al. Blood vessels of the rat tail: a histological re-examination with respect to blood vessel puncture methods.[J]. Laboratory Animals, 2003, 37(2):121-5.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |