三氧化硫分子杂化轨道的探讨 |
您所在的位置:网站首页 › o3杂化类型计算 › 三氧化硫分子杂化轨道的探讨 |
三氧化硫分子杂化轨道的探讨
|
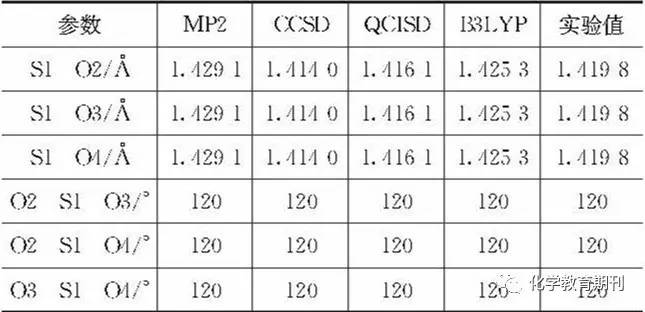
2结果与讨论 2.1 SO3分子的优化 通过上文谈到的4种计算方法分别对SO3结构进行优化,结果见表1。优化结果显示,4种方法所得到的SO3的键角均为120°,与实验值完全一致。4种方法得到的键长也较为接近,其优化的键长大小顺序为MP2>B3LYP>QCISD>CCSD。SO3中的S—O键长的实验值为1.4198 Å[8],与此值最为接近的值为1.4161 Å,对应的优化方法为QCISD,即相对来说QCISD在这4种方法中所得到的结果与实验值最为接近,所以后续计算都以QCISD/6-311++G(3df, 3pd)作为计算依据来进行。 表1 SO3键长、键角的优化值
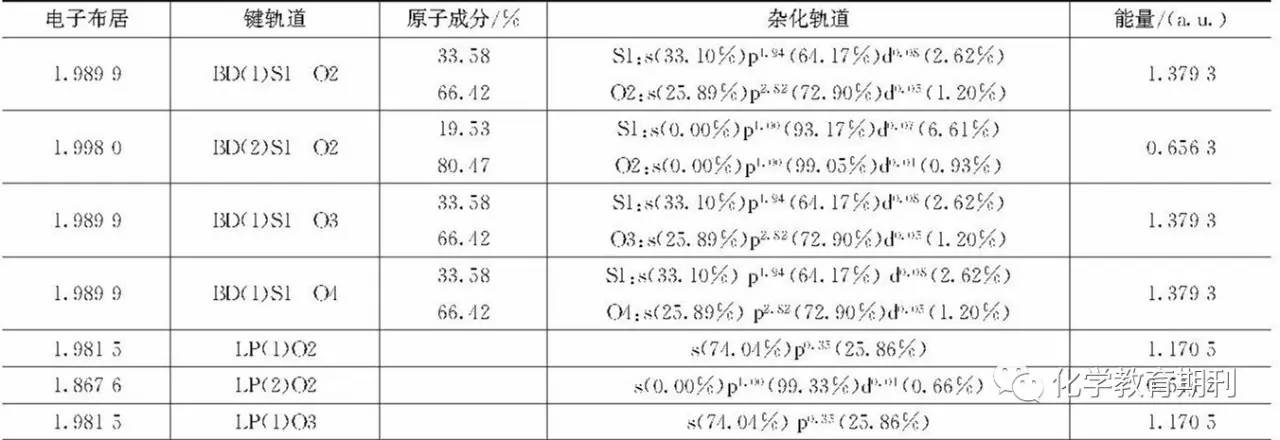
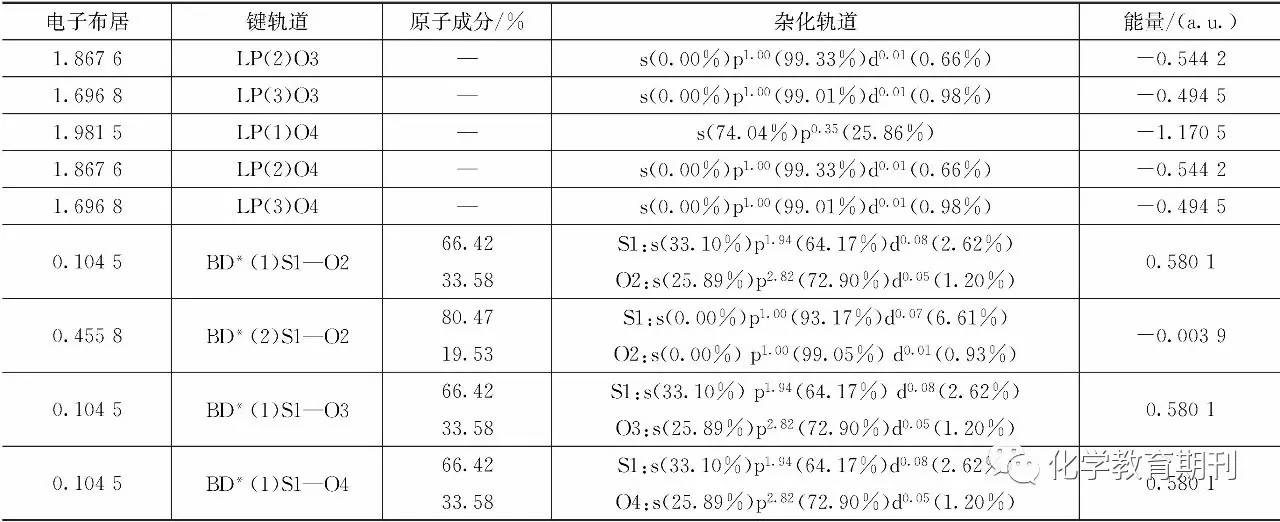
2.2 SO3杂化轨道分析 SO3的杂化轨道计算结果见表2。计算结果表明SO3分子中存在3个S—Oσ键,分别是BD (1)S1—O2,BD (1)S1—O3,BD (1)S1—O4。这3个σ键中S1原子采取的杂化轨道均是sp1.94 d0.08,很显然,d轨道参与了杂化,但含量很低,主要杂化形式可以近似认为是sp2杂化。与计算得到的自然原子轨道(NAO)联系起来,可以得出S原子中参与杂化的s和p轨道分别为3s,3px和3py轨道。表2数据也显示S原子参与杂化后,价层没有孤对电子存在,而且3个杂化轨道的能量均为 -1.379 3 a. u.。杂化轨道的成分相同,能量相同,因而可以证明中心S原子采取的是sp2等性杂化。与S形成σ键的O原子为sp2.82d0.05,同样的d含量成分低,可以近似认为O原子采取的是sp3杂化。与S原子不同的是,O2,O3和O4原子杂化完后,依然存在孤对电子,且孤对电子对应的能量与杂化轨道的能量也不完全相同,因而可以说明O原子采取的是sp3不等性杂化。 另外值得注意的是,在SO3分子中除了上述3个σ键外,还有一个BD(2)S1—O2的π键,构成该π键的S原子采取的是pd0.07的杂化方式,p成分占据93.17%,d成分占6.61%。对照NAO数据,可知p轨道为S的3pz轨道。构成π键的O2原子的p轨道成分高达99.05%,进一步分析也显示其p轨道为2pz。显然,SO3结构中除了杂化轨道形成的σ键外,还存在一个π键。那么,在SO3分子中一共就有4条键了。这就产生了一个问题,即成键情况与教材中所讲的有差异。教材中所讲到的SO3是由3条σ键与1个π64离域键构成。另外,我们回头看O原子形成sp3杂化后的孤对电子数目,可以发现O2有2对孤对电子,O3和O4各有3对孤对电子。O2少的1对孤对电子参与了S1=O2 π键的形成,因为在S1=O2 π键中,O2的成分高达80.47%,可以说这个π键主要来源于O2的2pz孤对电子的贡献。如果这样考虑,那么O2,O3和O4应该都是3对孤对电子。要使O原子sp3杂化后形成3对孤对电子,那么O的杂化轨道情况应该是 O,也就是O原子在杂化过程中,2个p轨道上的单电子被压缩在1个p轨道里,形成3对孤对电子,从而空出1个轨道。O的空轨道要与S形成σ键,那必然形成的是S→O配位键。由于S→O配位键的存在,而且是3个等性的S→O配位键,那就可以推出S原子采取的sp2杂化方式应该是 , 杂化之后,S原子剩余的1个空轨道为3pz轨道。 表2 SO3杂化轨道构成
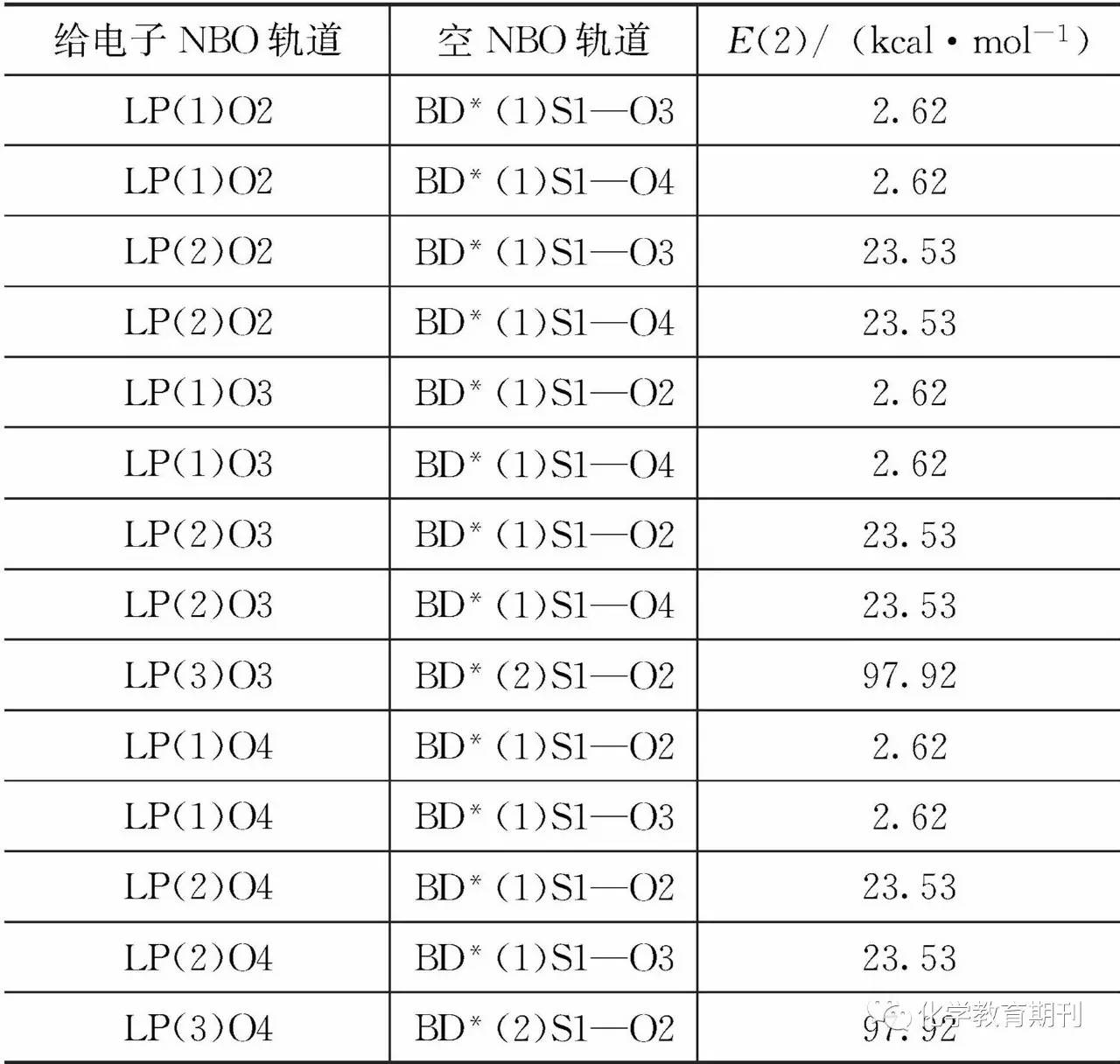
2.3 SO3分子中离域π键分析 观察LP(3)O3和LP(3)O4孤对电子的占据数,可以发现其值均为1.6968,严重偏离2.0的理论值。说明O3和O4的孤对电子存在着强烈的离域。另外,BD* (1)S1—O2,BD*(2)S1—O2,BD*(1)S1—O3和BD*(1)S1—O4反键轨道电子占据数都超过了0.1,甚至BD*(2)S1-O2的电子占据数达到了0.455 8,进一步证明SO3体系中除了定域的σ键外,一定存在严重的电子离域,否则S—O反键轨道上不可能有不可忽略的电子占据数。电子离域程度可以用二阶微扰稳定化能E(2)的大小来说明,E (2)越大,表示电子离域程度越大。表3列出了SO3分子中O孤对电子的E (2)分析。 表3 O孤对电子二阶微扰稳定化能分析
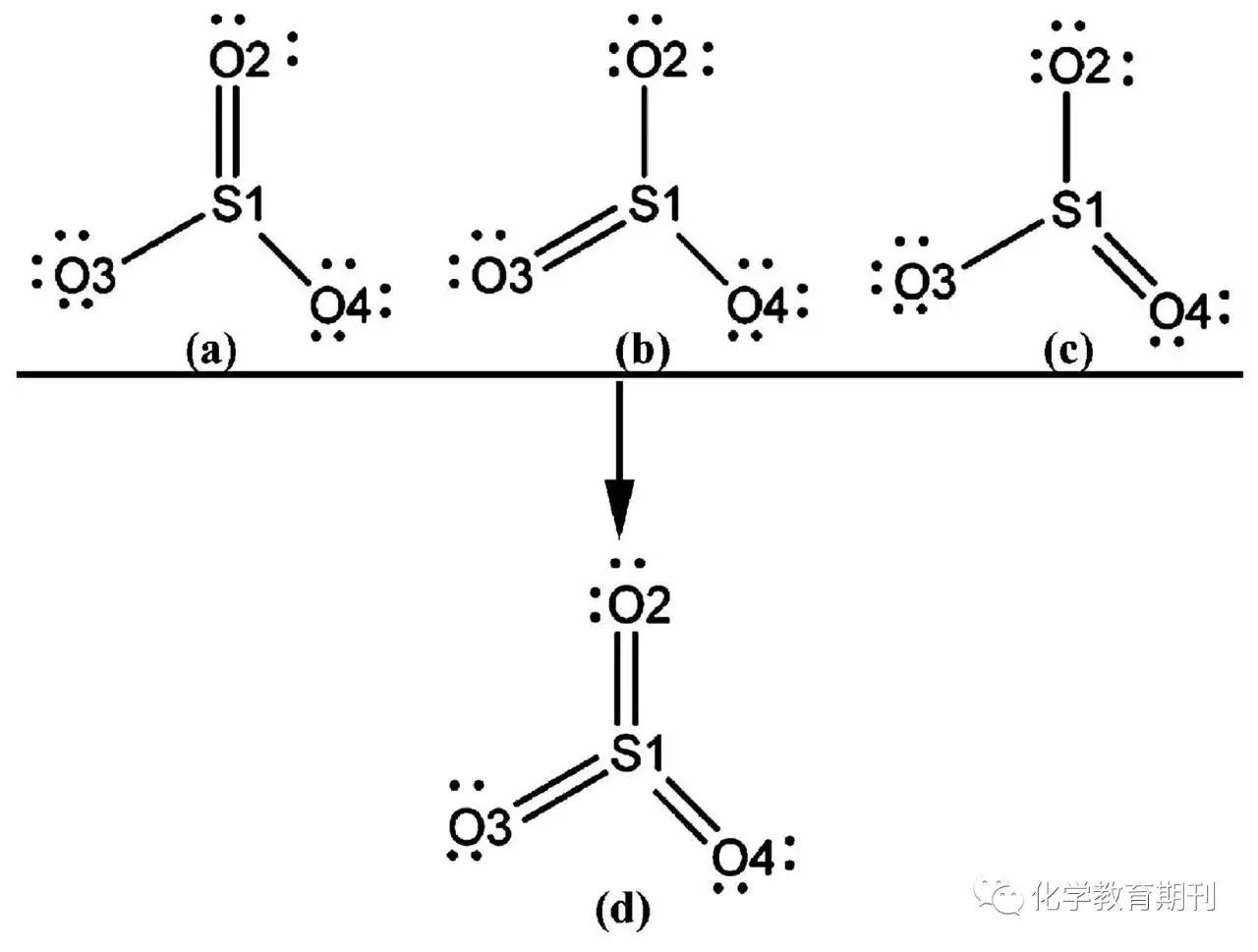
从表3可以看出,LP(3)O3和LP(3)O4孤对电子的E(2)能量达到97.92 kal·mol-1,表明LP (3)O3和LP(3)O4中的孤对电子向BD*(2)S1—O2强烈离域。L(3)O3和LP(3)O4孤对电子所在轨道的主要成分均为2pz轨道,BD*(2)S1—O2主要成分为π*S1(3pz)—O2(2pz),也就是说这种电子离域属于nO-π*(S1—O2)离域。这种孤对电子向π*轨道的离域导致π* (S1—O2)轨道电子占据数达到0.4558。 考虑到SO3分子中存在着强烈的电子离域,所以,利用NBO程序对SO3分子的共振结构进行了计算。发现SO3分子中存在3种等效共振结构,其共振结构如图1(a)—(c)所示。在每个共振结构中都存在一个等效的S=O π键,那么把具有3个等效π键的共振结构合并,就得到实际SO3的分子结构,如图1(d)所示。 图1 SO3分子的共振结构(a), (b), (c)与实际结构(d)
3个等效共振π键的存在,使得围绕中心S原子构筑起了4中心的离域π键。该离域π键是由3个氧的各一对2pz孤对电子与S原子的空3pz轨道耦合而成。由表2可知,π(S1—O2)的电子占据数为1.9980,由于3个共振π键是等效的,所以另外两个共振π键的电子占据数也应为1.9980,故参与构建离域π键的电子数为3×1.9980≈6,此结果表明SO3分子中存在的离域的π键是π64。进一步分析SO3的Mayer键级,可以发现S1—O2,S1—O3,S1—O4的键级均为1.77,这个值已经快接近2了,从而更加确切地证明SO3分子中S与O之间的键具有明显的双键特性。 3结论 从以上的分析可知,SO3分子中S原子采取sp2等性杂化,并有少量3d成分参与了轨道杂化。每个sp2轨道中都有1对电子,空余的3pz轨道参与形成离域π键。O原子采取的是sp3不等性杂化,其中前3个sp3轨道各有1对孤对电子,剩余1个空轨道。S—Oσ键实际上是S→O σ配位键。3个氧原子的各1对2pz孤对电子与S原子的空3pz轨道耦合形成了π64离域π键。另外,Mayer键级分析显示SO3分子中3个S=O键级均为1.77,进一步证实了S与O共价键具有显著的双键特性。 参考文献 [1] Mayer I.J. Mol. Struct. Theochem., 1987, 149:81-89 [2] Yadav A, Surján P R, Poirier R A. J. Mol. Struct. Theochem.,1988, 165:297-307 [3] Patterson C H, Messmer R P. J. Am. Chem. Soc.,1990, 112 (11):4138-4150 [4] 张桂玲,戴柏青.化学通报,2000, 63 (10):46-49 [5] 冯传启.湖北科技学院学报,1989, (2):77-78 [6] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09 (Revision D.01), Gaussian Inc.:WallingfordCT, 2013 [7] Glendening E D, Badenhoop J K, Reed A E, et al. NBO 5.0, Theoretical Chemistry Institute, University of Wisconsin:MadisonWI, 2001 [8] Kaldor A, Maki A G. J. Mol. Struct.,1973, 15 (1):123-130 参考文献 [1] Mayer I.J. Mol. Struct. Theochem., 1987, 149:81-89 [2] Yadav A, Surján P R, Poirier R A. J. Mol. Struct. Theochem.,1988, 165:297-307 [3] Patterson C H, Messmer R P. J. Am. Chem. Soc.,1990, 112 (11):4138-4150 [4] 张桂玲,戴柏青.化学通报,2000, 63 (10):46-49 [5] 冯传启.湖北科技学院学报,1989, (2):77-78 [6] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09 (Revision D.01), Gaussian Inc.:WallingfordCT, 2013 [7] Glendening E D, Badenhoop J K, Reed A E, et al. NBO 5.0, Theoretical Chemistry Institute, University of Wisconsin:MadisonWI, 2001 [8] Kaldor A, Maki A G. J. Mol. Struct.,1973, 15 (1):123-130 引用本文: 荣成, 蒋疆. 三氧化硫分子杂化轨道的探讨[J]. 化学教育(中英文), 2017, 38(12): 72-75
《化学教育》是教师专业发展的好参谋、好助手、好伙伴! 补订2017年《化学教育》办法 国家级全国中文核心期刊 栏目整合 印刷换新 品质提升 权威、客观、全面、实用 《化学教育》是中国科学技术协会主管,中国化学会、北京师范大学共同主办的国家级全国中文核心期刊,被北京大学《中文核心期刊要目总览》2008版、2011版和2014版连续收录,排同类期刊第1名;美国化学文摘(CA)收录源期刊。 《化学教育》为半月刊,全年共计24期,每期16元,全年共计384元。为了保证能及时收到期刊,由中国邮政承担订阅及投递服务。 订阅方式1:请到当地就近邮局的报刊订阅窗口办理,邮发代号为2-106。 订阅方式2:微信订阅,请扫描下方的二维码,进入订阅页面,按照步骤依次操作:选择投送地区—填写订阅份数—单击立即购买—提交订单—(如果首次操作,请按照提示添加详细可靠的收获地址)—确认订单—微信支付,即可完成订阅。请记住CNSI开头的订单号,以便查询,由“中国邮政”微信公众服务号提供查询和客户服务,全国统一客服电话:11185-9-2。 立即扫码订阅 有化学课程的地方,就应该有《化学教育》期刊! 微信征稿:观点评述、教学案例、教学心得、微课视频、实验视频、趣味实验、活动报道、科普文章、论文交流、人物事迹、试题评析等,新鲜、热门、有趣、实用,统统都可以,让分享促进你我成长,让传播增强化学力量!如果文章阅读人数超过3000,朋友圈分享人数超过300,则赠送1套全年《化学教育》!投稿邮箱:[email protected],邮件主题请写明“微信投稿”。鼓励原创,若参考了他人的文章,请注明来源,以免引起抄袭和剽窃的争议。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |