一种NK/T淋巴瘤小鼠模型的建立方法 |
您所在的位置:网站首页 › nk一t › 一种NK/T淋巴瘤小鼠模型的建立方法 |
一种NK/T淋巴瘤小鼠模型的建立方法
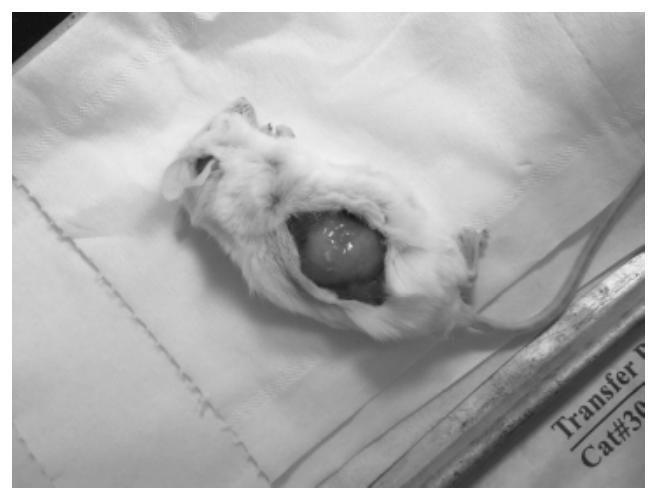 一种nk/t淋巴瘤小鼠模型的建立方法技术领域1.本发明属医学实验技术领域,涉及肿瘤实验动物模型的构建,具体涉及利用nk/t淋巴瘤细胞系构建免疫缺陷小鼠模型的方法。 一种nk/t淋巴瘤小鼠模型的建立方法技术领域1.本发明属医学实验技术领域,涉及肿瘤实验动物模型的构建,具体涉及利用nk/t淋巴瘤细胞系构建免疫缺陷小鼠模型的方法。背景技术: 2.文献记载了鼻型结外nk/t淋巴瘤是一种与eb病毒感染相关的罕见非霍奇金淋巴瘤,主要来源于nk细胞,少量来源于t细胞,亚洲、拉丁美洲发病率高于欧洲和美洲。研究显示,该肿瘤好发于鼻中部,鼻窦区,鼻咽部和腭部等面中部区域,呈侵袭性进展。目前临床针对该疾患常用的放疗和化疗方案的治疗效果尚不理想。nk/t淋巴瘤的发病机制至今未被清晰阐释,也尚未有疗效理想地针对性药物面世,其中缺乏稳定的动物模型是横亘在nk/t淋巴瘤研究领域里的一道难关。3.业内知晓,适宜的动物模型的构建是肿瘤发病机制和治疗药物研究的重要一环,实践证实,性状稳定的动物模型能真实反应肿瘤在体内的状态和对各种药物刺激的反应,稳定模型的建立则是肿瘤研究进展的基础之一。通常,肿瘤模型建立方法有:药物诱导,辐射诱发,人源肿瘤组织移植瘤模型和人源肿瘤细胞系移植模型等,前两者因为费时较长,高异质性以及特异性差等缺点较少被采用,采用稳定的肿瘤细胞系或患者来源的肿瘤组织构建免疫缺陷动物荷瘤模型是目前构建荷瘤动物模型的常用方法。4.业内若干研究人员尝试通上述两种方法构建nk/t淋巴瘤的模型,但是均不能获得理想的结果。其中,一方面,利用患者肿瘤组织进行荷瘤实验的难点在于合格组织的获取和稳定的传代,某研究组,如华西医院的科学家曾多次尝试采用取自鼻腔的肿瘤组织构建免疫缺陷小鼠模型,但皆因小鼠死于感染而失败。2008年,该研究组利用一例nk/t淋巴瘤病人的胃部复发转移瘤组织进行balb/c(nu/nu)裸鼠右侧腋下皮下荷瘤实验,造模成功[1],但后期肿瘤性状开始改变,随着肿瘤传代次数的增加,与原代肿瘤组织相比,混合的炎症细胞数量逐渐减少,肿瘤细胞变大,多态性减少,间质组织的含量也减少,一些抗原的表达变得不稳定,在大约保存80代以后彻底丢失。另一方面,利用细胞系建立小鼠荷瘤模型也存在较多困难,nk/t淋巴瘤细胞系难以成瘤,鲜有成瘤报道。本技术的研究团队曾进行了snt8,snk10,snt16和nk92的荷瘤实验,即使在重度免疫缺陷的nsg小鼠上也均未成功,其原因推测可能是上述细胞均需依赖人白介素-2生存,在小鼠体内因缺乏人白介素-2而无法正常生长。2019年郑州大学第一附属医院的团队利用nkys细胞系建立nod/scid小鼠模型,而成功建模的前提是给小鼠每周腹腔注射一次人白介素2[2],但是,由于白介素2是一种有效的免疫调节因子,现已用于肿瘤的生物治疗,而全身运用白介素2存在产生多种严重的并发症,如肺水肿、低血压、贫血以及毛细血管渗漏综合征所产生的器官功能异常等的风险,因此,其对荷瘤小鼠的生长状况的影响是不得不考虑的影响因素。[0005]鉴于此,目前尚未见稳定的nk/t细胞淋巴瘤的动物模型可供研究。科学家们所做的多种尝试均存在成功率低,标本难以获取,无法稳定传代保存,操作繁琐等缺点,尚不能满足相关研究的需求。[0006]基于现有技术的现状,本技术的发明人拟提供一种nk/t淋巴瘤小鼠模型的建立方法,尤其是利用nk/t淋巴瘤细胞系构建免疫缺陷小鼠模型的方法。[0007]与本技术相关的现有技术有:[0008]1.zhao s,tang ql,he mx,yang f,wang h,zhang wy,jiang w,wang xl,mo xm,li gd,liu wp:a novel nude mice model of human extranodal nasal type nk/t-cell lymphoma.leukemia 2008,22:170-178.[0009]2.xue w,li w,shang y,zhang y,lan x,wang g,li z,zhang x,song y,wu b,et al:one method to establish epstein-barrvirus-associated nk/t cell lymphoma mouse models.j cell mol med 2019,23:1509-1516.。 技术实现要素: [0010]本发明的目的是为克服现有技术的缺陷,基于现有技术的现状,提供一种nk/t淋巴瘤小鼠模型的建立方法,尤其是利用nk/t淋巴瘤细胞系构建免疫缺陷小鼠模型的方法。[0011]本发明利用一种可稳定表达人白介素2的nk/t淋巴瘤细胞系接种于免疫缺陷小鼠的皮下或肾包膜,建立免疫缺陷小鼠模型,本发明方法使肿瘤细胞在免疫缺陷实验小鼠的皮下及肾包膜下能够固定和生长,成瘤率100%,且成瘤的速度快。[0012]本发明方法通过如下技术方案施现:其包括步骤:[0013]1.免疫缺陷小鼠准备[0014]购买5周龄雌性免疫缺陷小鼠,于spf环境适应性饲养一周,接种前将右侧腋下或背部剃毛,75%酒精消毒;[0015]2.细胞系预处理[0016]培养可稳定表达人白介素2的nk/t淋巴瘤细胞系nk92mi(购于atcc),接种前进行如下处理:[0017]冰上融化高浓度基质胶,-20℃预冷1ml注射器;800rpm离心5min收集生长状态良好的细胞,每只小鼠所需细胞数量约为1×106-1×107,用无血清培养液重悬后,再次离心收集细胞,弃上清。按照每只小鼠80-100μl基质胶的比例向细胞沉淀中加入高浓度基质胶,充分混合成混悬液,注意冰上操作;[0018]3.荷瘤操作[0019]将nk/t淋巴瘤细胞系nk92mi接种于免疫缺陷小鼠的皮下或肾包膜,建立免疫缺陷小鼠模型:[0020](1)小鼠皮下荷瘤[0021]在超净工作台中用电动剃毛器去除小鼠右腋下被毛,酒精棉球消毒。将步骤2中处理好的细胞沉淀与基质胶的混悬液立即于小鼠右腋下进行皮下注射;[0022](2)小鼠肾包膜下注射细胞悬液[0023]将小鼠腹腔注射1%戊巴比妥钠(0.1ml/10g)麻醉后,用组织剪剖开右侧背部皮肤,轻轻地用手指将右侧肾脏推出;[0024]将步骤2中处理好的细胞沉淀与基质胶的混悬液立即注射至小鼠肾包膜下;每只小鼠注射80μl混悬液;注射完成后,轻轻地将肾脏用手指推入体内,缝合皮肤,正常饲养小鼠;[0025]4.观察肿瘤形成情况,注射一周后即可触摸到肿瘤形成,建得nk/t淋巴瘤小鼠模型。[0026]注射2周后处死nk/t淋巴瘤小鼠模型小鼠,取肿瘤组织和内脏进行he染色、免疫组化和原位杂交检测,进一步证明nk/t淋巴瘤小鼠模型建立成功(如附图所示)。[0027]本发明提供了利用可稳定表达人白介素2的nk/t淋巴瘤细胞系构建动物模型的方法,利用高浓度基质胶的支持作用和促进生长作用,使肿瘤细胞在免疫缺陷小鼠肾包膜下能够固定和生长,成瘤率100%,且成瘤的速度快。[0028]本发明建立的nk/t淋巴瘤小鼠模型方法中,可应用除了nk92mi之外的,其他能稳定表达人白介素2的nk/t淋巴瘤细胞系,所述方法中,可采用所有类型的免疫缺陷小鼠,通过皮下或肾包膜接种,构建nk/t淋巴瘤小鼠荷瘤模型。[0029]本技术提供了一种nk/t淋巴瘤小鼠模型构建方法,该方法能较快地构建nk/t淋巴瘤的稳定小鼠模型,从而为该领域的研究奠定应用基础,具有较好的实用价值和推广应用意义。[0030]本发明的优点有:[0031]克服现有技术中nk/t淋巴瘤细胞系在免疫缺陷小鼠体内的成瘤率低,难以稳定传代以及操作繁琐等的缺陷;对本技术领域而言具有突破性的进展意义。附图说明[0032]图1为nsg小鼠肾包膜接种2周后生长的肿瘤组织。[0033]图2为nsg小鼠皮下接种2周后生长的肿瘤组织。[0034]图3为nod/scid小鼠皮下接种2周后生长的肿瘤组织。[0035]图4为nod/scid小鼠皮下接种后的肿瘤体积生长曲线。[0036]图5为肿瘤组织的he染色结果。[0037]图6为肿瘤组织的免疫组化检测结果。[0038]图7为小鼠内脏he染色结果。具体实施方式[0039]下面结合实施例对本技术做进一步的解释说明,在介绍具体实施例前,就下述实施例中涉及部分生物材料、实验设备等情况简要介绍说明如下。[0040]生物材料:[0041]nod scid雌鼠,五周龄,购买于上海灵畅生物科技有限公司;nsg雌鼠,5周龄,15-20g,购于北京百奥赛图基因生物技术有限公司,在spf级动物房饲养,提供无菌饲料和水,适应性饲养1周后进行实验操作;[0042]nk/t淋巴瘤细胞系nk92mi,购于atcc(crl2408)。[0043]实验试剂与设备材料:[0044]不含核酸的α-mem培养基,life technologies,12000-063;[0045]碳酸氢钠,sigma,s-5761;[0046]肌醇,solarbio,i-8050;[0047]2-巯基乙醇;solarbio;21985-023;[0048]叶酸,sigma,f-8758;[0049]胎牛血清,biological industries,04-001-1a;[0050]马血清,biological industries,04-004-1a;[0051]高浓度基质胶,corning,354248;[0052]75%乙醇;[0053]一次性注射器(1ml);[0054]50ml、1.5ml离心管;[0055]电动剃毛器;[0056]电动助吸器及一次性移液管(10ml);[0057]移液枪及枪头;[0058]冰盒;[0059]离心机;[0060]生物安全柜、二氧化碳培养箱。[0061]实施例1[0062]本实施例利用nk/t淋巴瘤细胞系nk92mi,利用prkdc和il2rg双基因敲除的nsg小鼠构建了nk/t淋巴瘤免疫缺陷小鼠皮下荷瘤模型,具体过程如下。[0063]1.准备nsg小鼠:采用prkdc和il2rg双基因敲除的免疫缺陷型小鼠:nsg雌鼠,5周龄,适应性饲养一周。接种前将右侧腋下部位剃毛,75%酒精消毒;[0064]2.预处理nk92mi细胞:每只小鼠需1×107个细胞,计数后取适量细胞悬液离心收集细胞,800rpm离心5min,再用无血清培养液洗涤细胞一次,弃上清;[0065]3.制备肿瘤细胞与高浓度基质胶混合液,注射小鼠:冰上融化高浓度基质胶,-20℃预冷1ml注射器。按照每只小鼠100μl基质胶的比例向上步中收集的nk/t淋巴瘤细胞中加入高浓度基质胶,混合均匀,注意冰上操作,将混悬液皮下注射至小鼠右侧腋下。每只小鼠注射80μl注射液,注射完成后,正常饲养小鼠;[0066]4.观察肿瘤形成情况,注射一周后可触摸到肿瘤,模型建立成功。[0067]实施例2[0068]本实施例利用nk/t淋巴瘤细胞系nk92mi,利用prkdc和il2rg双基因敲除的nsg小鼠构建了nk/t淋巴瘤免疫缺陷小鼠肾包膜荷瘤模型,具体过程如下:[0069]1.准备nsg小鼠:接种对象采用prkdc和il2rg双基因敲除的免疫缺陷型小鼠:nsg雌鼠,5周龄,适应性饲养一周。接种前将背部位剃毛,75%酒精消毒;[0070]2.细胞系预处理[0071]培养可稳定表达人白介素2的nk/t淋巴瘤细胞系nk92mi(购于atcc),接种前进行如下处理:[0072]冰上融化高浓度基质胶,-20℃预冷1ml注射器;800rpm离心5min收集生长状态良好的细胞,每只小鼠所需细胞数量约为1×106-1×107,用无血清培养液重悬后,再次离心收集细胞,弃上清。按照每只小鼠80-100μl基质胶的比例向细胞沉淀中加入高浓度基质胶,充分混合成混悬液,注意冰上操作;[0073]3.荷瘤操作:nsg小鼠肾包膜下注射细胞悬液[0074]将nsg小鼠腹腔注射1%戊巴比妥钠(0.1ml/10g)麻醉后,用组织剪剖开右侧背部皮肤,轻轻地用手指将右侧肾脏推出;[0075]将步骤2中处理好的细胞沉淀与基质胶的混悬液立即注射至小鼠肾包膜下;每只小鼠注射80μl混悬液;注射完成后,轻轻地将肾脏用手指推入体内,缝合皮肤,正常饲养nsg小鼠;[0076]4.观察肿瘤形成情况,注射一周后即可触摸到肿瘤形成,建得nk/t淋巴瘤小鼠模型。[0077]实施例3[0078]本实施例利用nk/t淋巴瘤细胞系nk92mi,利用nod/scid免疫缺陷小鼠构建了nk/t淋巴瘤免疫缺陷小鼠皮下荷瘤模型,具体过程如下:[0079]1.准备nsg小鼠:采用nod/scid免疫缺陷雌鼠,5周龄,适应性饲养一周。接种前将右侧腋下部位剃毛,75%酒精消毒;[0080]2.预处理nk92mi细胞:每只小鼠需1×107个细胞,计数后取适量细胞悬液离心收集细胞,800rpm离心5min,再用无血清培养液洗涤细胞一次,弃上清;[0081]3.制备肿瘤细胞与高浓度基质胶混合液,注射小鼠:冰上融化高浓度基质胶,-20℃预冷1ml注射器。按照每只小鼠100μl基质胶的比例向上步中收集的nk/t淋巴瘤细胞中加入高浓度基质胶,混合均匀,注意冰上操作,将混悬液皮下注射至小鼠右侧腋下。每只小鼠注射80μl注射液。注射完成后,正常饲养小鼠;[0082]4.观察肿瘤形成情况,注射一周后可触摸到肿瘤,模型建立成功。[0083]注射2周后处死小鼠,取肿瘤组织进行he染色、免疫组化和原位杂交检测,结果如图1、2、3所示;he染色结果如图5所示,可见大量异型淋巴细胞弥散分布,胞体大,胞浆丰富,核不规则,染色质较粗,存在凋亡或坏死的肿瘤细胞;肿瘤组织的免疫组化检测显示cd56、cd2,胞浆cd3ε、granzyme b、perforin、tia1、ki67均为阳性,cd4、cd8阴性(如图6所示),经pcr检测eb病毒阳性,符合nk/t淋巴瘤的病理诊断。小鼠的内脏he染色结果图显示肝肾有nk/t细胞淋巴瘤的肿瘤累及(如图7所示)。[0084]本技术提供了一种可以快速稳定建立模型的方法,具有用时短,操作简单,肿瘤性状稳定,可以真实地反应肿瘤体内状态,进行后续机制研究等的优点。 |
【本文地址】
今日新闻 |
推荐新闻 |