孙倍成/林安宁团队揭示肝癌 |
您所在的位置:网站首页 › nfkb与炎症因子 › 孙倍成/林安宁团队揭示肝癌 |
孙倍成/林安宁团队揭示肝癌
|
原创 Cell Press CellPress细胞科学  生命科学 Life science 近日,南京大学医学院附属鼓楼医院孙倍成教授研究团队和南京大学现代生物研究院林安宁教授研究团队在Cell Press细胞出版社期刊Immunity上发表了一篇论文,题为“The zinc finger protein Miz1 suppresses liver tumorigenesis by restricting hepatocyte-driven macrophage activation and inflammation”,报告了锌指转录因子Miz1可限制肝细胞驱动的炎症,从而抑制HCC的发生,并且这一过程独立于其转录活性。 摘要 慢性炎症在肝细胞癌(HCC)发展中具有核心作用,但肝细胞对肿瘤相关炎症的影响仍不清楚。在此,我们报告了锌指转录因子Miz1可限制肝细胞驱动的炎症,从而抑制HCC的发生,并且这一过程独立于其转录活性。Miz1在HCC小鼠模型和相当一部分HCC患者中处于下调状态。小鼠的肝细胞特异性Miz1缺失产生了一个独特的肝细胞亚群,该细胞亚群产生促炎性细胞因子和趋化因子,使肿瘤浸润巨噬细胞的极化向促炎性表型倾斜,从而促进HCC。从机制上看,Miz1封存了肿瘤蛋白异粘蛋白(MTDH),防止MTDH促进转录因子核因子κB(NF-κB)的激活。在部分HCC患者中,研究者也观察到了一个独特的肝细胞亚群,这些细胞可产生促炎性细胞因子。此外,Miz1的表达水平与HCC患者的疾病复发和预后不良成反比。我们的研究结果表明,Miz1是一种肿瘤抑制因子,可以防止肝细胞驱动HCC的炎症。 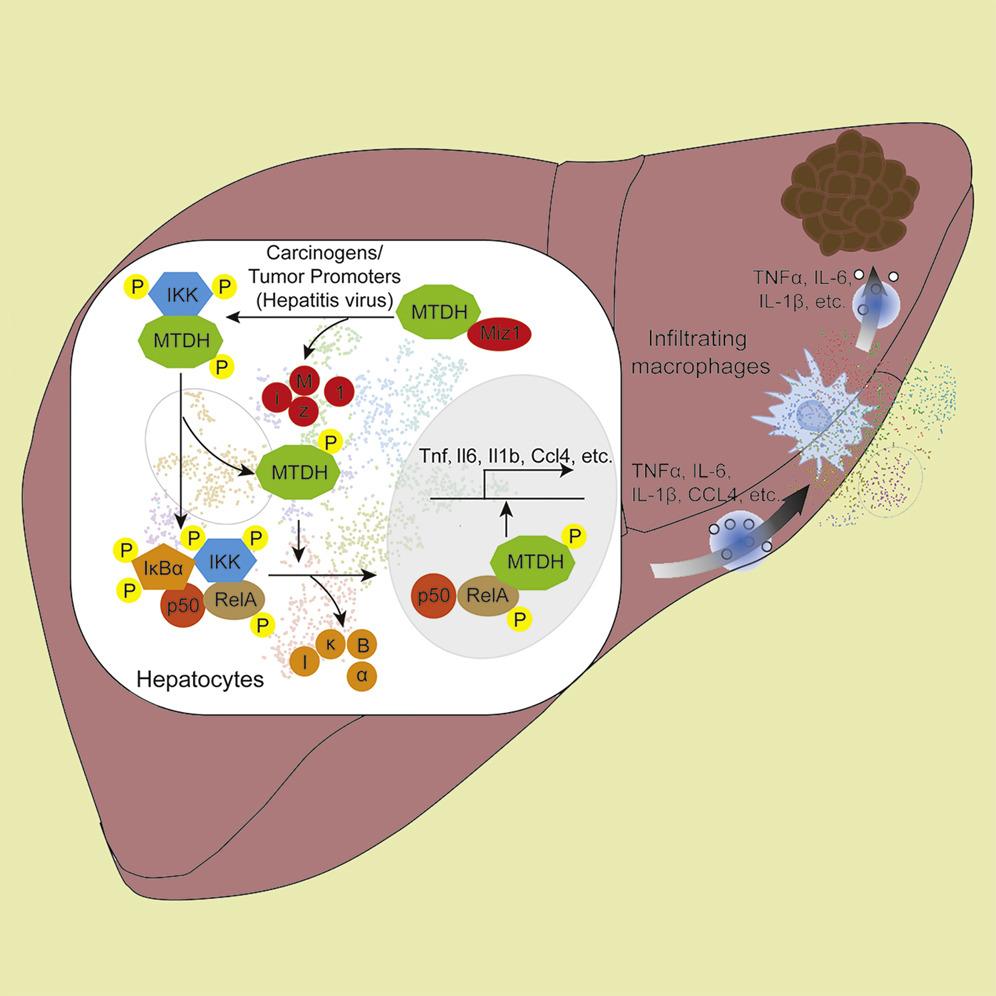 作者专访 Cell Press细胞出版社特别邀请论文通讯作者孙倍成教授和林安宁教授代表研究团队进行了专访,请他们为大家进一步详细解读。 CellPress:锌指转录因子Miz1的结构有什么特征?为什么POZ域对其转录活性十分重要? 孙倍成教授、林安宁教授:Miz1,又称为Zbtb17(Zinc finger and BTB domain-containing protein 17),是一个含有多个锌指结构的转录因子,其N端104个氨基酸编码了保守的BTB/POZ功能域。Miz1的POZ域可以与启动子区特定的DNA序列结合,转录激活Mad4、CDKN1A和CDKN2B等基因的表达,从而调控细胞周期、凋亡、自噬和DNA损伤修复等多个生理病理过程。多个转录因子(如Myc,Bcl6和Gfi1)可以通过与Miz1形成复合物,转录抑制Miz1的靶基因的表达,这一转录抑制功能也依赖于Miz1的POZ功能域。 CellPress:Miz1基因或POZ域的缺失会导致小鼠胚胎死亡,研究如何获得肝细胞特异性缺失Miz1或POZ结构域的小鼠? 孙倍成教授、林安宁教授:全身敲除Miz1基因或POZ功能域会导致小鼠胚胎死亡,其机制尚不清楚。我们的研究基于Cre-loxp系统,利用肝细胞特异性启动的Albumin-Cre小鼠与Miz1基因或POZ功能域的loxp小鼠杂交,获得了肝细胞特异性Miz1基因或POZ域敲除的小鼠。这两种基因型小鼠的生长发育正常,表明肝细胞中特异性敲除Miz1基因或POZ域对小鼠的生长发育并没有明显影响。 CellPress:Miz1及其POZ结构域的缺失是否影响了肝脏的平衡和发育功能?研究如何证明了这一点? 孙倍成教授、林安宁教授:肝细胞特异性Miz1基因或POZ功能域敲除并不影响肝脏的平衡和发育功能。首先,肝细胞特异性敲除Miz1基因或POZ域小鼠并不引起胚胎死亡,且出生后其生长发育与野生小鼠无明显差异。对基因敲除小鼠出生后6周和20周肝脏组织进行H&E染色和血清检测转氨酶的分析表明肝细胞特异性Miz1基因或POZ功能域敲除并不引起小鼠肝脏自发性的损伤。增殖(PCNA,Ki67)、凋亡(TUNEL)和纤维化(Masson)等分析也证明肝细胞特异性Miz1基因或POZ功能域敲除对正常肝脏中肝细胞的增殖、凋亡和纤维化没有明显影响。 CellPress:研究如何证明Miz1的缺失导致了肝细胞NF-kB活化增强,且该作用独立于其转录活性? 孙倍成教授、林安宁教授:利用单细胞测序深度分析方法,我们发现Miz1基因全长敲除促进了一个新颖的具备高活性转录因子NF-kB的肝细胞亚群产生,这个亚群特异性高度表达NF-kB下游的炎症因子TNFα、IL-1β、IL-6和CCL4等。通过提取两种不同小鼠肝癌模型(DEN/CCl4,STZ/HFD)肿瘤组织中的肝细胞进行WB检测、并利用小鼠肿瘤组织切片进行免疫组化染色等多种实验方法,我们证明肝细胞Miz1基因全长敲除明显促进肝细胞里代表NF-kB转录活性的RelA/p65亚基第536位丝氨酸磷酸化,同时伴随着NF-kB下游炎症因子表达的明显升高。相比之下,肝细胞POZ功能域敲除并不影响RelA/p65亚基第536位丝氨酸磷酸化。此外,我们通过检测在体外培养的不同基因型小鼠的原代肝细胞中被TNFα刺激后的 NF-kB活性,也得到了同样的结论,因此,我们从体内外、多方面证明了Miz1的缺失导致了肝细胞NF-kB活化增强,并且证明该作用独立于Miz1自身的转录活性。 CellPress:Miz1的表达与HCC患者的疾病复发和预后不良相关,那么能否将Miz1作为临床的预后指标? 孙倍成教授、林安宁教授:我们的研究发现Miz1的表达水平在肝癌的发生发展过程中呈现渐进性的下调,并且与肝癌患者的临床分期、预后和复发密切相关,所以Miz1可以作为辅助肝癌患者临床分期,预测生存的潜在指标。 CellPress:Miz1-MTDH-RelA轴的发现具有重要的病理和临床意义。本研究的转化面临哪些挑战? 孙倍成教授、林安宁教授:Miz1-MTDH-RelA轴的发现对肝癌治疗具有重要的病理和临床意义。NF-kB在体内不同组织和细胞类型均有表达,在调控细胞生存、凋亡和炎症等多个生理病理过程中有着极为重要的作用。可是,能否通过靶向NF-kB治疗肝癌,长期以来尚无定论。先前的研究揭示在致癌物引起的肝癌,肝细胞中NF-kB失活会诱导肝细胞代偿性增殖,促进肝癌发生发展,提示直接靶向抑制NF-kB转录活性将导致促肿瘤风险。但是又有报道表明肿瘤肝细胞NF-kB失活可以抑制炎性肝癌的发生。我们的研究证明无论在致癌物或炎性引起的肝癌动物模型中,Miz1敲除均引起肝细胞中NF-kB过度激活,促进肝细胞癌发展。更为重要的是,我们发现Miz1水平在RelA/p65亚基第536位丝氨酸磷酸化呈阳性的HCC患者中处于下调状态。因此,通过干预肝细胞中Miz1降解,有可能将NF-kB的激活水平控制在正常范围,同时也可以避免过度抑制NF-kB所导致的促肿瘤风险,减少对其他细胞和脏器的副作用。但是,如何特异性地干预肝细胞的Miz1-MTDH-RelA轴的调控仍然是本研究临床转化应用所面临的挑战。  作者简介  孙倍成 教授 孙倍成,现任南京大学医学院附属鼓楼医院(南京鼓楼医院)教授,主任医师,博士生导师,副院长,肝胆胰中心主任,工会主席。国家自然科学基金杰出青年基金获得者。中华医学会器官移植分会青年委员,中国抗癌协会肝癌专业委员会常委,中华肿瘤学会肝癌学组委员,江苏省抗癌协会肝癌专业委员会主任委员,江苏省医学会器官移植分会副主委、江苏省医学会肝病学分会副主委。2018年1月作为人才引进就职南京大学医学院附属鼓楼医院,任副院长,肝胆胰中心主任。为江苏省十大医学杰出人才。获排名第一的江苏省科学技术一等奖2项,教育部自然科学一等奖1项,同时还获国家科技进步二等奖1项,江苏省科学技术二等奖1项(排名第一)。目前以第一作者或通讯作者发表SCI文章70余篇,总影响因子700余分。主持“精准医学研究”国家重点研发计划1项、国家杰出青年科学基金1项、国家自然科学基金重点课题2项、国家973课题1项,总科研经费3000万元。获国家发明专利9件。主要从事肝脏外科和肝移植基础和临床研究。  林安宁 教授 林安宁教授是蛋白激酶JNK-c-Jun细胞信号转导通路的发现者之一,是细胞信号转导研究领域的国际著名学者,长期系统性地研究肿瘤坏死因子TNFα 细胞信号转导网络整合和调控以及其在重大疾病中的作用机理。现任南京大学现代生物研究院创院院长,博士生导师,回国任职前,是美国芝加哥大学Ben May癌症生物学系终身正教授,在芝加哥大学任教和从事科研20余年,在Cell、Nature、Science、Immunity、Molecular Cell、PNAS等著名国际期刊发表80余篇研究论文,引用次数超过20000,其研究工作长期受到美国NIH经费支持。在2009到2014年期间,曾任中科院上海生化与细胞所所长,期间担任科技部重大研究计划项目首席科学家, 其研究工作并得到基金委重点项目支持。 相关论文信息 研究成果发表在Cell Press旗下Immunity期刊上,点击“阅读全文”或扫描下方二维码查看论文。 ▌论文标题: The zinc finger protein Miz1 suppresses liver tumorigenesis by restricting hepatocyte-driven macrophage activation and inflammation ▌论文网址: https://www.cell.com/immunity/fulltext/S1074-7613(21)00189-8 ▌DOI: https://doi.org/10.1016/j.immuni.2021.04.027 阅读原文 |
【本文地址】
今日新闻 |
推荐新闻 |